◆醫藥快訊◆
美國FDA批準生物鐘調節藥物Tasimelteon上市
美國FDA于2014年1月31日批準Vanda制藥公司的Tasimelteon(參考譯名:他司美瓊,商品名:Hetlioz)膠囊上市,用于治療非24小時睡眠覺醒障礙。
Tasimelteon為褪黑素 MT1和 MT2受體激動藥,確切作用機制尚不明確,MT1和MT2受體與生物周期節律相關。
Tasimelteon用于非24小時睡眠覺醒障礙的有效性已通過兩項隨機、雙盲、安慰劑對照、多中心、平行組試驗評估。受試者為全盲的非24小時睡眠覺醒障礙患者,試驗通過患者日記記錄評估夜間睡眠和日間小睡的時長與時間。試驗結果顯示,與安慰劑組相比,Tasimelteon可明顯改善癥狀。臨床試驗中,Tasimelteon與β腎上腺素受體拮抗藥合用時,療效可能減弱。
Tasimelteon最常見的不良反應為頭痛、丙氨酸氨基轉移酶升高、噩夢、夢境異常、上呼吸道或尿路感染。
(來源:http://www.fda.gov)
美國FDA批準抗腫瘤藥Ibrutinib上市
美國FDA近期批準Pharmacyclics公司的Ibrutinib(商品名:Imbruvica)膠囊上市,用于治療已接受過至少一種療法治療的套細胞淋巴瘤(MCL)患者。
Ibrutinib為一種小分子布魯頓氏酪氨酸激酶(BTK)抑制藥,其于BTK活性部位與半胱氨酸殘基形成共價鍵,導致BTK酶活性抑制。BTK為B細胞抗原受體和細胞因子受體通路的信號分子,其在信號傳導中的作用為通過B細胞表面受體,激活通路對B細胞交換、趨化及黏附的需求。非臨床研究顯示,Ibrutinib在體內可抑制惡性B細胞增殖和存活,在體外可抑制細胞轉移和底物黏附。
Ibrutinib的安全性及有效性通過一項非盲、多中心、單臂試驗證明。試驗的首要終末指標為研究者評估的總緩解率(ORR)。試驗結果顯示,ORR為65.8%,外部獨立審查委員會(IRC)復審的 ORR為69%。中位緩解時間為1.9個月。有33%患者出現一過性淋巴細胞計數增加。
試驗中最常見的不良反應有血小板減少、腹瀉、中性粒細胞減少、貧血、疲勞、肌肉骨骼痛、外周水腫、上呼吸道感染、惡心、瘀傷、呼吸困難、皮疹、腹痛、嘔吐、食欲減退。
(來源:http://www.fda.gov)
美國FDA批準抗菌藥物盧立康唑上市
美國FDA近期批準Medicis公司的盧立康唑(通用名:Luliconazole, 商品名:Luzu)1%外用乳膏上市,用于局部治療18歲及以上患者因紅色毛癬菌和絮狀表皮癬菌引起的趾間足癬、股癬及體癬。
盧立康唑為唑類抗真菌藥,其用于皮膚癬菌的確切機制尚不明確,但其通過抑制羊毛甾醇脫甲基酶似可抑制麥角固醇(真菌細胞膜的組成部分,也是羊毛甾醇的對應累積產物)合成,致麥角固醇數量減少。
盧立康唑作用于趾間足癬的安全性和有效性通過2項隨機、多中心、雙盲、媒介對照試驗證明。用于股癬的安全性和有效性通過1項隨機、多中心、雙盲、媒介對照試驗證明。治療完全成功以完全清除(趾間足癬4周,股癬3周)定義。
試驗結果顯示,用于趾間足癬的2項試驗中,達完全清除的受試者比例分別為26%和14%,達有效治療的比例分別為48%和33%,臨床治愈的比例分別為29%和15%,真菌學治愈比例分別為62%和56%。用于股癬的試驗中,達完全清除的受試者比例為21%,有效治療比例為43%,臨床治愈比例為24%,真菌學治愈比例為78%。
盧立康唑安全性較好,多為輕度不良反應,最常見的不良反應為用藥部位反應。
(來源:http://www.fda.gov)
Eluxadoline用于腹瀉型腸易激綜合征的兩項Ⅲ期臨床試驗達首要終末指標
美國Furiex制藥公司于2014年2月4日宣布,其藥物Eluxadoline用于腹瀉型腸易激綜合征(IBS-d)的兩項Ⅲ期臨床試驗達首要終末指標。
Eluxadoline為在研口服藥物,具有μ型阿片受體激動和δ阿片受體拮抗活性,其主要在腸道起效,口服生物利用度低。其雙重阿片活性可用于治療IBS-d腹瀉和疼痛癥狀且不引起μ型阿片激動藥所致便秘。
兩項試驗(3001、3002)皆為隨機、雙盲、安慰劑對照試驗。試驗的首要療效終末指標為復合指標,評估最初12周(美國食品藥品監督管理局要求)和26周(歐洲藥品審評局要求)的治療反應。反應率比較依據的是1~12周和1~26周一半及以上天數達到每日復合反應標準 (對疼痛和糞便硬度的改善)的患者數。
兩項試驗在首要聯合和部分次要終末指標上皆顯示統計學上顯著的高反應率,具體試驗數據如表1所示。
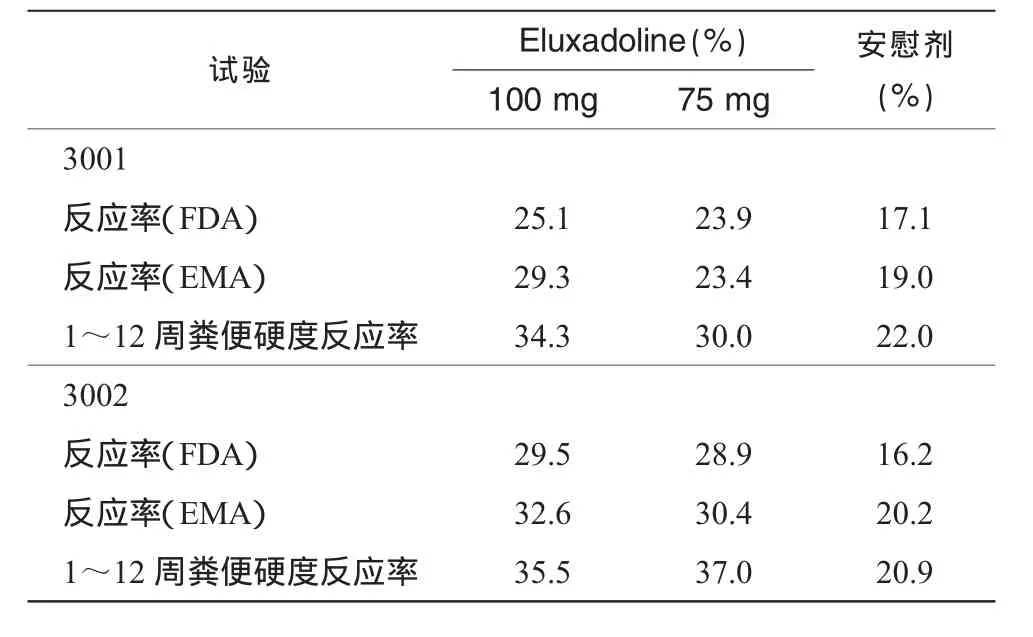
表1 兩項試驗終末指標的比較
兩項試驗中,Eluxadoline100mg組1~12周疼痛數值也有改善,但尚未達到統計學上顯著差異。兩項試驗中,Eluxadoline顯示較好耐受性,最常見的副作用為便秘、惡心。
(來源:http://www.drugs.com)
歐洲藥品評審局批準降糖藥Dapagliflozin/Metformin上市
歐洲藥品評審局 (EMA)于2014年1月16日批準阿斯利康(Astrazeneca)公司和百時美施貴 寶(Bristol Myers Squibb)的 Dapagliflozin/Metformin(參考譯名:達格列凈-二甲雙胍,商品名:Xigduo)片劑上市,作為飲食和運動的輔助療法,用于18歲及以上2型糖尿病患者提高血糖控制能力。
用藥患者應為單用最大耐受量的二甲雙胍或二甲雙胍與其他降糖藥合用仍不能充分控制血糖者,或為已接受達格列凈和二甲雙胍單獨片劑聯合治療者。
Dapagliflozin/Metformin包含兩種降糖藥:達格列凈和鹽酸二甲雙胍。達格列凈為高效、選擇性、可逆性Ⅱ型鈉葡萄糖協同轉運體(SGLT2)抑制藥;鹽酸二甲雙胍具有降糖作用,可同時降低基礎血糖和餐后血糖。以上兩種藥物作用機制不同但互補。
與單用達格列凈與鹽酸二甲雙胍相比,聯用未見額外的不良反應。
(來源:http://www.ema.europa.eu)
抗菌藥物Ceftolozane/Tazobactam與甲硝唑合用于復雜性腹腔內感染的Ⅲ期臨床試驗取得滿意成果
美國Cubist公司于2013年12月16日宣布,其抗菌藥物Ceftolozane/Tazobactam與甲硝唑合用于復雜性腹腔內感染的Ⅲ期臨床試驗取得滿意成果。
Ceftolozane/Tazobactam包含 2種成分:Ceftolozane為新型頭孢菌素,與當前頭孢菌素相比,在體外顯示對綠膿假單胞菌的強效抗性;Tazobactam(中文通用名:三唑巴坦)為β-內酰胺酶抑制藥。Ceftolozane與Tazobactam合用可擴大覆蓋產生超廣譜β-內酰胺酶的細菌的范圍。
本項試驗成果源自2項多中心、全球性、隨機、雙盲試驗。試驗旨在確定復雜性腹腔內感染患者使用Ceftolozane/Tazobactam(與甲硝唑合用)和美羅培南(通用名:Meropenem)相比的安全性及有效性。試驗的首要終末指標為初次用藥后26~30日隨訪時,美國FDA和歐洲藥品審評局(EMA)定義的Ceftolozane/Tazobactam與美羅培南非劣效性標準。FDA定義為治愈測試(TOC)達臨床治愈的微生物學意向治療(MITT)人群患者比例,EMA定義為臨床可評估人群患者比例。
試驗結果顯示,Ceftolozane/Tazobactam與美羅培南非相比,具有顯著的非劣效性,達首要終末指標。二級分析結果亦支持主要結果。
試驗中最常見的不良事件為惡心、腹瀉、發熱、失眠、嘔吐。
(來源:http://www.drugs.com)

