HIF-1α和VEGF在扁平苔蘚中的表達及意義
王勝 葛清蓮
扁平苔蘚是常見的慢性炎癥性皮膚病之一, 其主要組織病理學(xué)改變?yōu)楸砥そ腔^度, 基底細胞液化變性, 真皮淺層淋巴細胞帶狀浸潤[1], 其確切的發(fā)病機制至今尚未闡明。近年來扁平苔蘚發(fā)病的機制一直是人們研究的熱點。缺氧誘導(dǎo)因子-1α(HIF-1α)是在缺氧條件下廣泛存在于動物和人體內(nèi)的轉(zhuǎn)錄因子, 于1992年在細胞核提取物中發(fā)現(xiàn), 可能為扁平苔蘚發(fā)病的關(guān)鍵因素之一, 而HIF-1α可在基因水平上直接調(diào)控血管內(nèi)皮生長因子(VEGF)的表達并促進扁平苔蘚中真皮毛細血管的增生, 本實驗擬用免疫組織化學(xué)方法, 檢測扁平苔蘚組織中的HIF-1α、VEGF的表達, 探討HIF-1α、VEGF與扁平苔蘚發(fā)病的關(guān)系。
1 材料與方法
1.1 材料 40例標本均來自本院皮膚科2011年5月~2013年12月手術(shù)切除的并經(jīng)病理檢查證實的扁平苔蘚患者, 其中男15例, 女25例, 年齡25~72歲, 平均年齡48.5歲, 組織標本取出后立即浸入10%甲醛溶液中固定, 常規(guī)石蠟包埋,4 μm連續(xù)切片, HE染色, 同時取正常皮膚標本10例作為對照, 對照組病例均來自本院整形科。
1.2 主要試劑 鼠抗人HIF-1α單克隆抗體和鼠抗人VEGF單克隆抗體、即用SP型試劑盒和濃縮型DAB試劑盒均購自武漢博士德生物有限公司。
1.3 實驗方法 鏈霉親和素-過氧化物酶法(S-P):將石蠟切片脫蠟至水化;加3%雙氧水滅活內(nèi)源性過氧化物酶;微波修復(fù)20 min, 滴加正常山羊血清封閉液, 依次加入一抗(HIF-1α工作濃度1:100稀釋, VEGF工作濃度1:50稀釋)、辣根過氧化物酶標記鏈霉素親和素工作液;DAB顯色, 蘇木素復(fù)染脫水透明、封片。
1.4 染色結(jié)果的判定 HIF-1α表達定位于細胞核或細胞漿中, 陽性細胞染色呈棕黃色顆粒;VEGF表達以血管內(nèi)皮細胞漿中出現(xiàn)棕黃色顆粒為陽性。每張切片在500倍光學(xué)顯微鏡下選取10個視野, 每個視野統(tǒng)計10個細胞中的陽性細胞數(shù), 總數(shù)除以10, 乘以100%, 得到該標記物的陽性細胞表達指數(shù)。
1.5 統(tǒng)計學(xué)方法 應(yīng)用SPSS10.0軟件進行分析, 計數(shù)資料采用χ2檢驗和Spearman相關(guān)分析, 以P<0.05為差異具有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 HIF-1α在扁平苔蘚皮損中和正常皮膚組織中的表達HIF-1α蛋白表達分級方法如下:(-)陽性細胞數(shù)<1%;(+)陽性細胞數(shù)1%~10%;(+ +)陽性細胞數(shù)10%~50%; (+ + +)陽性細胞數(shù)>50%, 將HIF-1α分為高表達和低表達二組。40例扁平苔蘚皮損中HIF-1α陽性表達率為85.00%(34/40), 正常皮膚中陽性率20.00%(2/10)與扁平苔蘚皮損組相比, 差異有統(tǒng)計學(xué)意義(P<0.05)。VEGF表達分級沿用HIF-1α表達分級法, 分為(-)~(+ + +)共四級。本組實驗中, 扁平苔蘚皮損中VEGF表達陽性率為95.00%(38/40);正常皮膚中陽性率10.00%(1/10), VEGF在扁平苔蘚及正常對照皮膚中的表達差異有統(tǒng)計學(xué)意義(P<0.05)。
2.2 HIF-1α與VEGF在扁平苔蘚皮損與正常皮膚表達的關(guān)系 經(jīng)Spearman相關(guān)分析, 本實驗扁平苔蘚中HIF-1α表達與VEGF表達呈正相關(guān)(相關(guān)系數(shù)r=0.56)。見表1。
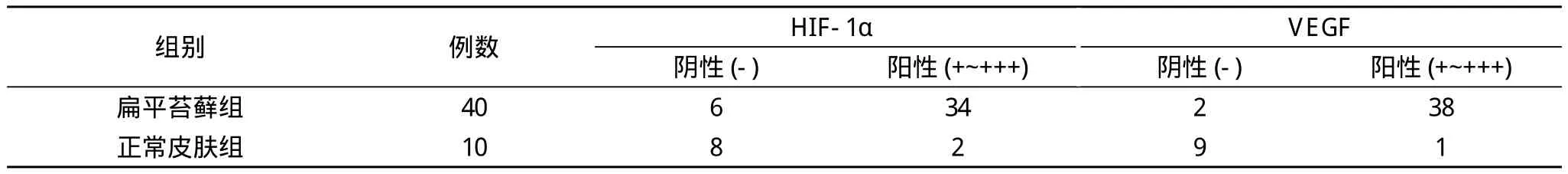
表1 HIF-1α與VEGF在扁平苔蘚皮損和正常皮膚的表達情況(n)
3 討論
扁平苔蘚是一種病因不明的慢性炎癥性疾病, 好發(fā)于皮膚、毛囊、黏膜和指(趾)甲, 皮損通常為紫紅色多角形瘙癢性扁平丘疹, 有特征的組織病理學(xué)變化[2]。扁平苔蘚的發(fā)生機制尚不明確, 目前研究認為, 扁平苔蘚的發(fā)生與免疫失調(diào)及炎性損傷有關(guān), 近些年來研究表明, HIF-1α是介導(dǎo)腫瘤細胞缺氧適應(yīng)的關(guān)鍵性轉(zhuǎn)錄調(diào)控因子, 可能在基因水平上直接調(diào)控VEGF的表達并促進扁平苔蘚真皮血管的生長[3]。HIF-1α是一種核轉(zhuǎn)錄因子, 在總體上調(diào)控細胞對缺氧的反應(yīng)狀況, 通過上調(diào)血管內(nèi)皮生長因子表達促進血管形成, 研究表明[4], 在人類許多腫瘤中檢測出HIF-1α、VEGF的過度表達。HIF-1α可能是實體腫瘤血管形成的初始啟動因素之一[3]。研究已證實VEGF是刺激扁平苔蘚血管生成的最關(guān)鍵的生長因子, 而HIF-1α能增加VEGF的表達, 促進扁平苔蘚血管的生成, 緩解缺氧狀態(tài)。本實驗研究結(jié)果表明:HIF-1α、VEGF在扁平苔蘚組織中表達陽性率高, 而在正常皮膚組織中表達陽性率低, 且HIF-1α與VEGF在扁平苔蘚組織中表達呈正相關(guān), 說明VEGF通過誘導(dǎo)血管生成來促進扁平苔蘚的生長, 推測在扁平苔蘚的血管生成過程中HIF-1α與VEGF呈協(xié)調(diào)一致的表達, 提示HIF-1α參與血管形成是通過影響VEGF的表達來實現(xiàn)的, 二者在扁平苔蘚的血管生成中具有協(xié)同作用。研究也表明以HIF-1α為靶點, 抑制靶基因VEGF的表達, 可能減少扁平苔蘚血管的生成, 從而抑制扁平苔蘚的生長, 可能將來成為扁平苔蘚治療的新方法。
總之, 扁平苔蘚的生長演變過程是一個T細胞增殖和凋亡的動態(tài)轉(zhuǎn)化過程[3]。而本實驗研究表明扁平苔蘚血管的形成有可能通過HIF-1α→VEGF→微血管形成的途徑實現(xiàn)的。目前關(guān)于HIF-1α的研究剛剛開始, 還有很多臨床未研究的領(lǐng)域, 但是隨著基礎(chǔ)研究的不斷深入, 以HIF-1α為靶點治療扁平苔蘚將可能成為新的重要手段之一。
[1] 朱學(xué)駿, 涂平.皮膚的組織病理學(xué)診斷.第2版.北京:北京醫(yī)科大學(xué)出版社, 2001:138.
[2] 趙辯.中國臨床皮膚性病學(xué).南京:江蘇科學(xué)技術(shù)出版社,2010:1037.
[3] Semenza GL.HIF-1 and tumor progression; pathophysiology and therapeutics.Trends Mol Med, 2002(8):62-67.
[4] Greijer AE, van der wall E.The role of hypoxia inducible factor 1 inhypoxia induced apoptosis.Journal of Clinical Pathology, 2004(57):1009-1014

