膠質瘤細胞中miR-223對PAX6基因3'非翻譯區的調控作用*
羅奇志,鄔力祥,文 芳,韓 仰,黃柏勝*
(中南大學湘雅醫學院 a.免疫學系;b.生理學系,湖南 長沙 410078)
膠質瘤起源于膠質細胞或其前體細胞,是臨床上常見的原發性中樞神經系統惡性腫瘤,大約占顱內腫瘤的40%-50%,病人確診后5年存活率少于3%[1,2]。膠質瘤具有高侵襲性,與鄰近正常腦組織無明顯分界,是構成其難治性的重要因素,導致手術治療難以根除,常易復發、死亡率高。目前膠質瘤的常規治療手段如手術切除、放療、化療效果并不滿意[3],經治療后的患者的中位生存期僅有14個月左右[4]。因此,如何延長膠質瘤患者的存活期是我們目前正面臨的緊迫問題。轉錄因子PAX6是進化上高度保守的PAX(Paired box)家族成員之一,與腦的發育有關,在腦中持久表達[5]。然而與鄰近的正常組織相比,膠質瘤中PAX6的表達水平明顯降低[6],過表達PAX6可抑制膠質瘤細胞的生長和侵襲[7,8]。近年來的研究使microRNA(miRNAs)已經迅速發展成為癌癥和其它疾病的重要的潛在分子標志[9]。miRNAs屬于一類18-22個堿基的、非編碼的單鏈RNAs,它可以通過與靶基因mRNA的3'非翻譯區(3'-untranslation region,3'-UTR)特異性結合,引起靶基因mRNA降解和/或翻譯受阻,在轉錄后水平調控基因的表達[10,11]。因此深入探討膠質瘤中 PAX6表達下調的具體機制,有望為膠質瘤的治療提供新思路。在本研究中,我們采用生物信息學軟件在線預測可能與PAX63'-UTR相互作用的miRNAs,構建野生型和突變型PAX6基因3'-UTR雙熒光素酶報告基因質粒,驗證miR-223與PAX63'-UTR的靶向關系,為進一步研究miR-223對PAX6的調控作用奠定實驗基礎。
1 材料與方法
1.1 材料
DMEM高糖培養基(Hyclone公司),胎牛血清(杭州四季青公司),psiCHECKTM-2載體(Auragene公司),Not I、Xho I內切酶和 T4連接酶(Fermentans公司),DH5α感受態細胞(Auragene公司),瓊脂糖(西班牙Biowest公司),質粒小提試劑盒(康為世紀公司),DNA回收試劑盒(Omega公司),雙熒光素酶報告基因檢測試劑盒(Promega公司),1 kb DNA ladder、DS2000 DNA ladder(康為世紀公司),miR-223 mimics(廣州復能公司)。
1.2 方法
1.2.1 細胞培養
膠質瘤細胞系(U251)購自中國科學院上海細胞生物學研究所,用含10%胎牛血清的DMEM高糖培養基,于37℃、5%CO2、飽和濕度的條件下培養,每2~3天傳代一次,取處于對數生長期的細胞用于后續實驗。
1.2.2 miRNA 靶點預測
應用 www.targetscan.org和 www.microrna.org在線生物信息學預測軟件對人PAX63'-UTR可能作用的miRNAs進行預測分析,尋找調控PAX6的可能的miRNAs。
1.2.3 PAX63'-UTR-psiCHECKTM-2、PAX6 Mut3'-UTR-psiCHECKTM-2雙熒光素酶報告基因質粒構建
根據NCBI中人PAX63'-UTR基因序列(NM_001604),采用Primer5.0軟件進行引物設計,上游、下游引物5'端分別加入 Xho I、Not I酶切位點序列(下劃線部分),預計擴增產物大小為455 bp,引物序列如下:

以慢性粒細胞白血病K562細胞cDNA為模版,用以上引物擴增目的基因片段,將PCR產物行1%瓊脂糖凝膠電泳后用DNA凝膠回收試劑盒回收目的條帶,再用Xho I和Not I對回收的目的基因片段和psiCHECKTM-2雙熒光素酶報告基因空載體同時進行過夜酶切16 h,將酶切產物電泳并回收酶切后的目的基因片段和psiCHECKTM-2雙熒光素酶報告基因質粒,T4連接酶連接回收的目的基因片段和psiCHECKTM-2載體,室溫連接2 h,連接產物轉化DH5α感受態細胞,挑取陽性克隆,搖菌。
1.2.4 雙熒光素酶報告基因重組質粒的鑒定
1.2.4.1 菌落PCR鑒定 以所構建的質粒為模板,用相應的引物擴增目的片段的全長或部分。挑取平板上長出的單個菌落重懸于10 μL LB培養液中,從中取1 μL做模板進行菌落PCR鑒定,擴增引物序列及擴增產物大小同1.2.3。
1.2.4.2 雙酶切鑒定 用Xho I和Not I內切酶對抽提重組質粒進行雙酶切,切出兩條帶,一條是原載體psiCHECKTM-2,另一條為目的片段,與用相同引物從基因組中擴增出來的片段大小相同。
1.2.4.3 測序鑒定 測序可以識別出擴增過程中出現的堿基突變等情況,將菌落PCR鑒定和雙酶切鑒定均正確的樣品送武漢華大基因進行雙向測序。
1.2.5 質粒共轉染U251細胞
取對數生長期的U251細胞,在轉染前1天按照每孔5×105個細胞接種于24孔培養板中,轉染時細胞密度大約為60%~70%;利用脂質體lipofectamine2000進行共轉染miR-223 mimics和雙熒光素酶重組質粒至U251細胞。按照以下實驗分組進行:①轉染PAX63'-UTR-psiCHECKTM-2雙熒光素酶質粒組(NC組);②共轉染PAX63'-UTR-psiCHECKTM-2+miR-223 mimics組(PAX63'-UTR+miR-223);③轉染PAX6 Mut 3'-UTR-psiCHECKTM-2雙熒光素酶質粒組(NC組);④共轉染 PAX6 Mut 3'-UTR-psi-CHECKTM-2+miR-223 mimics組(PAX6 Mut 3'-UTR+miR-223)。每組實驗樣本3個復孔,轉染48 h后進行熒光素酶活性檢測。
1.2.6 熒光素酶報告基因活性檢測
應用Promega公司雙熒光素酶報告基因系統檢測轉染后各組細胞的熒光素酶報告基因活性。按試劑盒說明書操作如下,棄原細胞培養液,用1×PBS清洗待轉染的細胞兩次,每孔細胞加入20 μL 1×PLB裂解液裂解細胞,室溫振蕩裂解細胞15分鐘,收集細胞裂解液。加入100 μL LARⅡ工作液,快速混勻后,檢測螢火蟲熒光素酶活性值;然后加入100 μL Stop溶液,快速混勻后,置入發光檢測儀中,檢測海腎熒光素酶活性值;取測定的3個復孔的平均值計算相對熒光值。按照以下公式計算:相對熒光值=螢火蟲熒光素酶活性值/海腎熒光素酶活性值。
1.3 統計學分析
2 結果
2.1 PAX6 mRNA靶向miRNAs的預測結果
通過生物信息學的預測軟件,分析miR-223與其靶基因的結合情況,兩個在線軟件預測結果均顯示PAX6的3'-UTR區有7個堿基(AACUGAC)能夠與miR-223的“種子區”的堿基(UUGACUG)存在互補配對,該兩個網站的預測結果均提示PAX6可能是miR-223的靶基因。(圖1)。

圖1 PAX6基因3'-UTR的miRNAs靶點預測Fig.1 Prediction result of miRNAs targeting PAX6 gene 3'-UTR
2.2 PAX63'-UTR 及 PAX6 Mut 3'-UTR 的 PCR擴增瓊脂糖凝膠電泳
以K562細胞cDNA為模板,PCR擴增PAX63'-UTR和PAX6 Mut 3'-UTR,經1%瓊脂糖凝膠電泳跑膠后,結果可見擴增產物條帶大小為455 bp,與預期的擴增產物大小一致(圖2)。
2.3 psiCHECKTM-2雙熒光素酶載體雙酶切的瓊脂糖凝膠電泳
psiCHECKTM-2載體購自Auragene公司,分別用Not I/Xho I雙酶切,經1%瓊脂糖凝膠電泳結果如下(圖3)。
2.4 雙熒光素酶重組質粒的鑒定
2.4.1 菌落PCR 鑒定
1%瓊脂糖凝膠電泳結果顯示,1-6號孔為PAX63'-UTR-psiCHECKTM-2 克隆檢菌,其中 1、2、3、4、6 號孔為陽性,擴增條帶大小與預計產物455 bp一致,5號孔為陰性;7-14號孔為PAX6 Mut3'-UTR-psi-CHECKTM-2克隆檢菌,其中 7、9、10、13 號孔為陽性,擴增條帶大小亦與預計產物455 bp一致,8、11、12、14號孔為陰性(圖4)。
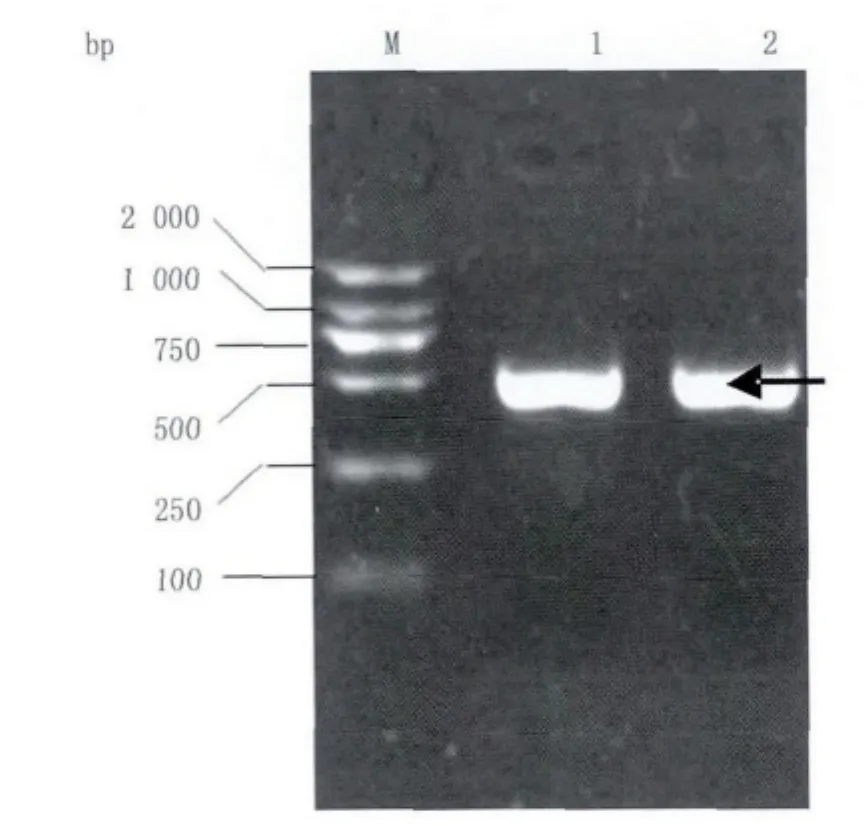
圖2 PAX63'-UTR和PAX6 Mut 3'-UTR的PCR擴增Fig.2 PCR amplification of PAX63'-UTR and PAX6 Mut 3'-UTR
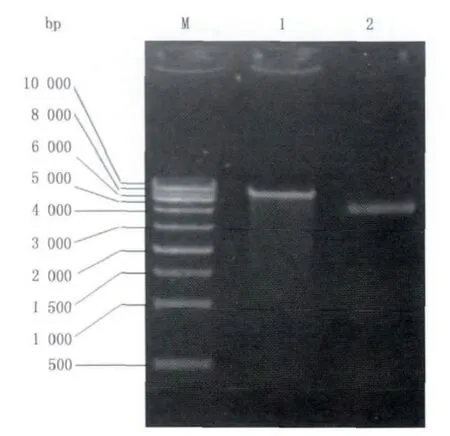
圖3 psiCHECKTM-2載體的雙酶切鑒定Fig.3 Double-enzyme digestion of psiCHECKTM-2 vector
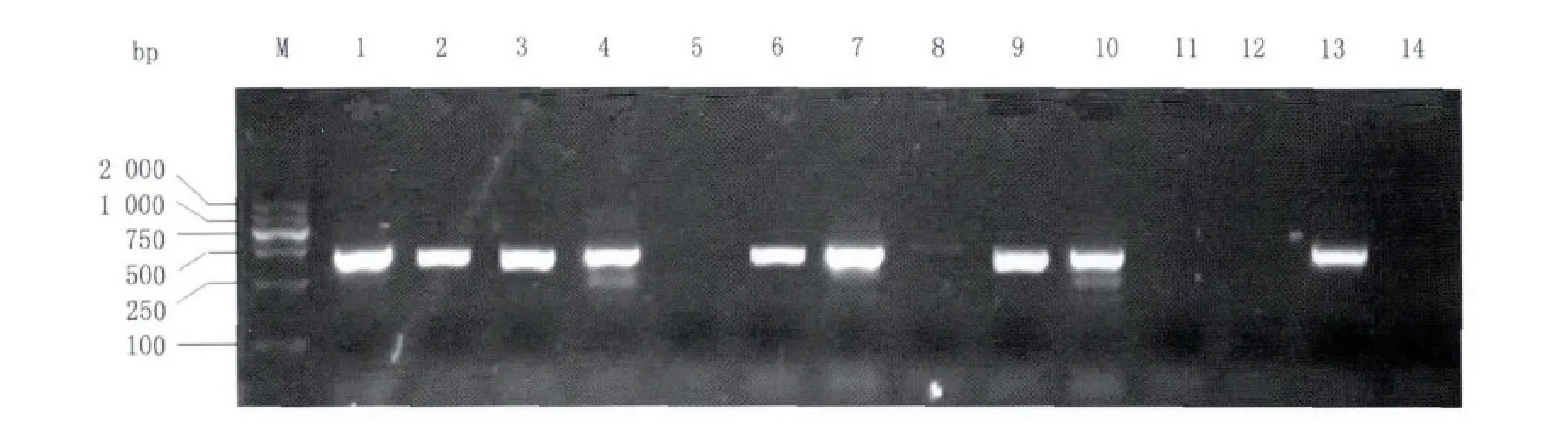
圖4 雙熒光素酶重組質粒的菌落PCR鑒定Fig.4 Identifying dual luciferase recombinant plasmid by colony PCR
2.4.2 雙酶切鑒定
雙熒光素酶重組質粒經Not I/Xho I雙酶切后,1%瓊脂糖凝膠電泳圖可見有兩條條帶,由圖5可見,其中一條條帶與psiCHECKTM-2空載體大小6273 bp一致,另一條條帶為插入的目的片段,大小與455 bp相同,說明雙熒光素酶重組質粒構建成功。
2.4.3 重組質粒的測序鑒定
將菌落PCR鑒定和雙酶切鑒定均正確的雙熒光素酶重組質粒送武漢華大基因公司進行測序,測序結果證實插入片段是PAX63'-UTR、PAX6 Mut3'-UTR序列,且與模板序列比對無點突變,質粒部分測序峰圖如下(圖6)。
2.5 miR-223與PAX63'-UTR靶向關系分析
在生物信息學軟件在線預測PAX6為miR-223靶基因的基礎上,為了進一步驗證miR-223是否能夠靶向結合PAX63'-UTR,我們將PAX63'-UTR-psi-CHECKTM-2質粒和PAX6 Mut 3'-UTR-psiCHECKTM-2質粒與miR-223 mimics分別共轉染至U251細胞,應用雙熒光素酶報告基因系統檢測轉染后各組細胞的熒光素酶報告基因活性,檢測結果如圖7所示。與單一的質粒轉染組相比,miR-223 mimics能明顯降低PAX63'-UTR-psiCHECKTM-2的熒光素酶活性,差異具有統計學意義(P<0.05)。結果提示miR-223與PAX6基因3'-UTR區存在靶向作用關系,它能夠靶向負性調節PAX63'-UTR。
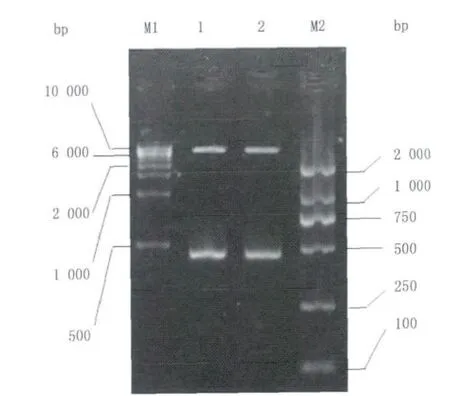
圖5 雙熒光素酶重組質粒經Not I/Xho I雙酶切鑒定Fig.5 Enzyme digestion of the dual luciferase recombinant plasmid
圖6 雙熒光素酶重組質粒的序列測定Fig.6 The sequencing map of dual luciferase recombinant plasmid
3 討論
膠質瘤是常見的原發性中樞神經系統惡性腫瘤,因它具有獨特的侵襲性而難以治療,因此尋找腦膠質瘤新的治療靶點具有重要意義。研究報道,與鄰近的正常組織相比,膠質瘤中PAX6的表達水平明顯降低[6]。目前認為,PAX6在膠質瘤的發生發展過程中是一種抑制性調控因素,過表達PAX6能抑制膠質瘤細胞的生長和侵襲[7,8]。因此深入探討膠質瘤中PAX6表達下調的確切機制,有望為明確膠質瘤的侵襲性指明新思路。
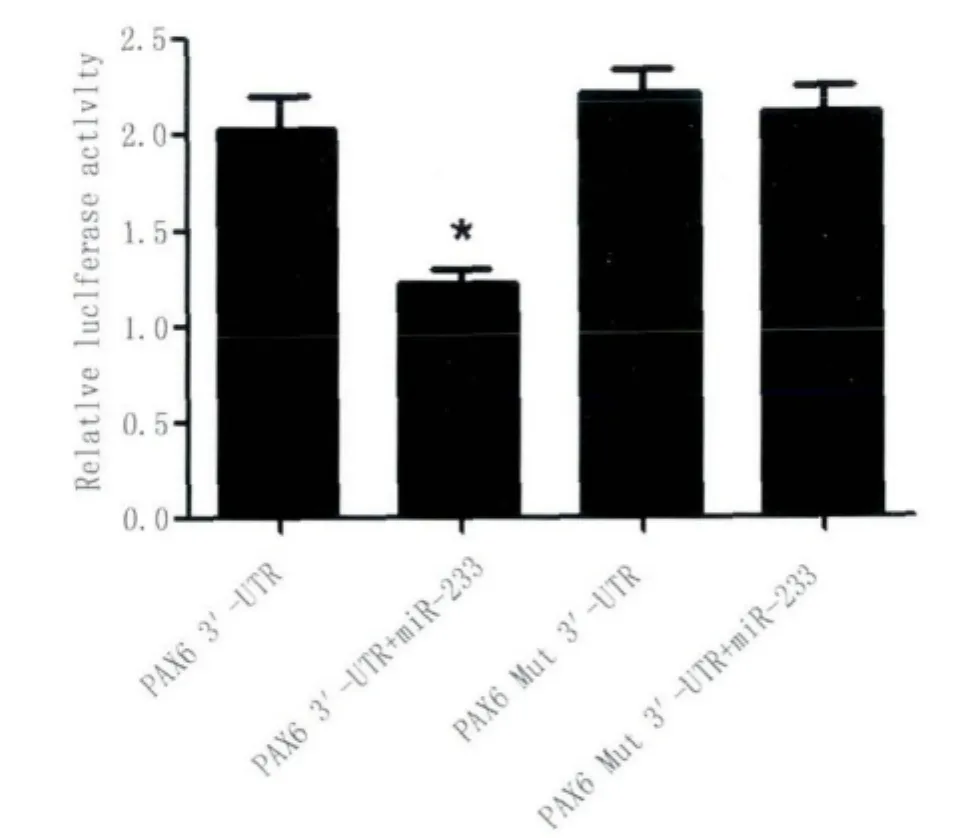
圖7 膠質瘤U251細胞中雙熒光素酶活性分析Fig.7 Analysis of the reporter activities in U251 cells
miRNAs屬于一類小的、非編碼的單鏈RNA,它可以通過與靶基因mRNA的3'-UTR結合,引起靶基因mRNA降解或翻譯受阻,從而在轉錄后水平調節蛋白的表達。miRNAs具有多種生物學作用,它作為抑癌基因還是致癌基因取決于它們相關靶基因的功能。隨著人們對miRNAs的基本特征、生物學功能等的進一步了解,發現miRNAs能夠通過調節下游基因的表達和功能從而參與調控個體發育、細胞凋亡、增殖及分化等生命活動[9]。另外一些特異性的miRNAs在膠質瘤中的表達水平異常或發生突變,且影響膠質瘤的增殖、凋亡及侵襲轉移,提示miRNAs的異常表達與膠質瘤密切相關,很多miRNAs的靶基因就是抑癌基因或致癌基因。目前已經將miRNAs作為膠質瘤臨床診斷的生物學標志以及最有潛力的治療靶點之一[12,13]。相關的研究也證實了一些 miRNAs在膠質瘤形成、生長、增殖、侵襲和轉移等方面起到重要的調控作用。作為癌癥重要調節因子的miRNAs給我們帶來了治療膠質瘤的新希望[1,14,15]。
有研究報道miRNAs作為腫瘤抑制基因或致癌基因取決于它作用的靶基因的功能,如miR-223作為致癌基因或腫瘤抑制基因與癌癥的不同類型有關,在不同類型的癌癥或腫瘤細胞中miR-223靶向不同或相同的基因而呈現不同的作用[16-20]。例如,它可以通過靶向Hsp90B1而抑制骨肉瘤的生長[16];miR-223在結腸直腸癌HCT116細胞、宮頸癌Hela細胞和肝癌HuH7細胞中低表達,而過表達miR-223可以通過靶向FOXO1而抑制上述三種癌細胞的增殖[17]。但miR-223在胃癌細胞中高表達,它作為致癌基因通過靶向結合腫瘤生長抑制基因EPB41L3[18]的3'-UTR,在轉錄后水平下調靶基因的表達,與癌細胞的轉移有關,或者抑制FBXW7/hCdc4[19]的表達而促進胃癌細胞的增殖和侵襲。在乳腺癌細胞中,miR-223通過Mef2c-b-catenin信號通路,提高癌細胞的侵襲能力[21]。另外在胃癌中miR-223靶向抑制stathmin1的表達而發揮致癌作用[20],然而在膠質瘤中miR-223的生物學功能目前還不清楚。此外,與PAX6相關的miRNAs的報道非常少見[22],在膠質瘤中,靶向調節PAX6的miRNAs尚需要進一步實驗證實。
隨著對miRNAs研究的不斷深入,miRNAs靶基因預測的生物信息學軟件迅速興起,研究者根據已知miRNAs及其靶基因mRNA之間的某些序列特征制定不同運算規則,開發出多種軟件進行miRNAs靶基因的預測。在本研究中,我們選用了兩個比較權威的在線軟件 Targetscan 5.1和 Microrna預測了PAX6基因3'-UTR可能的靶向miRNAs。本實驗中,生物信息學軟件在線預測結果顯示,miR-223與PAX6基因3'-UTR能夠不完全互補結合,可能對PAX6基因具有靶向調節作用。據此,我們構建了野生型PAX63'-UTR-psiCHECKTM-2和突變型PAX6 Mut 3'-UTR-psiCHECKTM-2雙熒光素酶重組質粒,并將該質粒分別與miR-223 mimics共轉染U251細胞,實驗結果顯示,共轉染PAX63'-UTR-psiCHECKTM-2重組質粒和miR-223 mimics的細胞樣本中,熒光素酶活性強度相比其它組顯著下降,miR-223 mimics顯著地抑制了野生型PAX63'-UTR-psiCHECKTM-2熒光素酶報告基因的活性,miR-223能識別PAX63'-UTR序列而使報告基因熒光素酶活性下降(P<0.05),說明miR-223與PAX6基因3'-UTR區存在靶向作用關系;該實驗初步證實了miR-223能夠與PAX63'-UTR靶向結合,并能夠負性調節PAX6的表達,但仍需要進一步在mRNA和蛋白水平給予驗證。
[1]QU S,YAO Y,SHANG C,et al.MicroRNA-330 is an oncogenic factor in glioblastoma cells by regulating SH3GL2 gene[J].PLoS One,2012,7(9):e46010.
[2]DOLECEK T A,PROPP J M,STROUP N E,et al.CBTRUS statistical report:primary brain and central nervous system tumors diagnosed in the United States in 2005-2009[J].Neuro Oncol,2012,14(Suppl 5):v1-49.
[3]PREUSSER M,D E RIBUPIERRE S,W?HRER A,et al.Current concepts and management of glioblastoma[J].Ann Neurol,2011,70(1):9-21.
[4]ZHENG Y F,LI L,ZHENG Z H.TGF-alpha induces upregulation and nuclear translocation of Hes1 in glioma cell[J].Cell Biochem Funct,2008,26(6):692-700.
[5]SIMPSON T I,PRICE D J.PAX6:a pleiotropic player in development[J].Bioessays,2002,24(11):1041-1051.
[6]ZHOU Y H,TAN F,HESS K R,et al.The expression of PAX6,PTEN,vascular endothelial growth factor,and epidermal growth factor receptor in gliomas:relationship to tumor grade and survival[J].Clin Cancer Res,2003,9(9):3369-3375.
[7]MAYES D A,HU Y J,TENG Y,et al.PAX6 suppresses the Invasiveness of glioblastoma cells and the expression of the matrix metalloproteinase-2 gene[J].Cancer Res,2006,66(20):9809-9817.
[8]ZHOU Y H,WU X S,TAN F,et al.PAX6 suppresses growth of human glioblastoma cells[J].J Neurooncol,2005,71(3):223-229.
[9]NIMMO R A and SLACK F J.An elegant miRror:microRNAs in stem cells,developmental timing and cancer[J].Chromosoma,2009,118(4):405-418.
[10]BRODERSEN P,VOINNET O.Revisiting the principles of microRNA target recognition and mode of action[J].Nat Rev Mol Cell Biol,2009,10(2):141-148.
[11]CROCE C.Causes and consequences of microRNA dysregulation in cancer[J].Nat Rev Genet,2009,10(10):704-714.
[12]MIZOGUCHI M,GUAN Y,YOSHIMOTO K,et al.Clinical implications of microRNAs in human glioblastoma[J].Front Oncol,2013,3:19.
[13]MIZOGUCHI M,GUAN Y,YOSHIMOTO K,et al.MicroRNAs inhumanmalignant gliomas[J].J Oncol, 2012,2012:732874.
[14]LI C,FENG Y,COUKOS G,et al.Therapeutic microRNA strategies in human cancer[J].AAPS J,2009,11(4):747-757.
[15]ZHONG X,COUKOS G,ZHANG L.miRNAs in human cancer[J].Methods Mol Biol,2012,822:295-306.
[16]LI G,CAI M,FU D,et al.Heat shock protein 90B1 plays an oncogenic role and is a target of microRNA-223 in human osteosarcom[J].Cell Physiol Biochem,2012,30(6):1481-1490.
[17]WU L,LI H,JIA C Y,et al.MicroRNA-223 regulates FOXO1 expression and cell proliferation[J].FEBS Lett,2012,586(7):1038-1043.
[18]LI X,ZHANG Y,ZHANG H,et al.miRNA-223 promotes gastric cancer invasion and metastasis by targeting tumor suppressor EPB41L3[J].Mol Cancer Res,2011,9(7):824-833.
[19]LI J,GUO Y,LIANG X,et al.MicroRNA-223 functions as an oncogene in human gastric cancer by targeting FBXW7/hCdc4[J].J Cancer Res Clinical Oncol,2012,138(5):763-774.
[20]KANG W,TONG J H,CHAN A W,et al.Stathmin1 plays oncogenic role and is a target of microRNA-223 in gastric cancer[J].PloS One,2012,7(3):e33919.
[21]YANG M,CHEN J Q,SU F,et al.Microvesicles secreted by macrophages shuttle invasion-potentiating microRNAs into breast cancer cells[J].Mol Cancer,2011,10:117.
[22]CHEN K C,HSI E,HU C Y,et al.MicroRNA-328 may influence myopia development by mediating the PAX6 gene[J].Invest Ophthalmol Vis Sci,2012,53(6):2732-2739.

