紫杉醇對絨癌JEG-3細胞增殖與凋亡的影響
李 岑,劉惠寧
(1.江蘇省揚州市第一人民醫院婦產科,江蘇 揚州 225000;2.中南大學附屬湘雅醫院婦科,湖南 長沙 410000)
紫杉醇對絨癌JEG-3細胞增殖與凋亡的影響
李 岑1,2,劉惠寧2
(1.江蘇省揚州市第一人民醫院婦產科,江蘇 揚州 225000;2.中南大學附屬湘雅醫院婦科,湖南 長沙 410000)
目的 該文圍繞紫杉醇對人絨毛膜癌細胞 JEG-3的增殖與凋亡的影響進行研究。方法 通過 MTT法檢測細胞增殖及流式細胞術檢測不同濃度紫杉醇作用下細胞的凋亡及其對細胞周期的影響。結果 隨紫杉醇濃度的增加或時間的延長,JEG-3細胞增殖抑制率及凋亡率均增大,各組間比較有統計學意義(P<0.05)。結論 該次實驗的結果顯示紫杉醇在抑制絨癌細胞 JEG-3增殖及促凋亡方面均有顯著的作用。
紫杉醇;JEG-3細胞;增殖;凋亡
絨毛膜癌(choriocarcinoma,CC)是一種繼發于妊娠之后的滋養細胞腫瘤。取代以滋養細胞形成絨毛或水泡狀結構,絨癌細胞呈片狀高度增生,并廣泛侵入子宮肌層,破壞子宮肌層內血管,一方面造成組織缺血壞死,另一方面通過侵蝕血管,絨癌細胞隨血液轉移至肺、陰道等處并在轉移部位繼續侵蝕血管造成局部出血。區別于其他婦科惡性腫瘤,化療藥對絨癌的治療效果極好,FIGO評分低危的患者基本可全部治愈,高危患者治療失敗率也僅15%左右[1]。目前國內常用的化療藥物有甲氨蝶呤、5-氟尿嘧啶(5-FU)等,其毒副作用較大,嘔吐等化療副反應常導致患者無法堅持全療程化療,且耐藥問題逐漸明顯[2],故尋找新的、有效的、低毒反應的治療絨癌藥物的需求逐漸迫切。紫杉烷類藥物是一種三環二萜化合物[3],起初由Wani等從短葉紅豆杉的樹皮中分離出天然紫杉醇[4],隨后,由法國羅納普朗克·樂安公司經半合成漿果紫杉針葉中的提取物得到多西紫杉醇即半合成紫杉醇。最初,Harwitz等于20世紀70年代末初步揭示了紫杉醇獨特的抗腫瘤機制,此后,各國研究人員相繼證明了其在治療卵巢癌、子宮內膜癌、肺癌、食管癌、乳腺癌及直腸癌等多種癌癥中的明確作用[5-6]及其作用機制[7],這些研究結果被應用于臨床,目前紫杉醇已成為晚期乳腺癌、小細胞肺癌、卵巢癌等治療的一線藥物。本研究的目的是通過研究紫杉醇影響絨癌 JEG-3細胞的增殖能力與誘導凋亡情況,為應用紫杉醇治療絨癌提供實驗依據。
1 材料與方法
1.1 材料
1.1.1 細胞株來源 人絨毛膜癌細胞系 JEG-3為北京中國科學院動物研究所“計劃生育及生殖生物學國家重點實驗室”購得后于湘雅醫院中心實驗室傳代保存。
1.1.2 主要試劑 多西紫杉醇自江蘇恒瑞醫藥股份有限公司購買;胎牛血清、RMPI-1640由湘雅醫院中心實驗室提供;胰蛋白酶購買于美國 Sigma公司。
1.2 絨癌細胞株 JEG-3細胞培養 在含有15%胎牛血清-RPMI1640培養液中貼壁培養JEG-3細胞。環境溫度37℃,CO2濃度5%,飽和濕度。隔天更換培養液一次。細胞覆蓋率達到 70%~80%時消化傳代,用對數生長期的細胞進行實驗。
1.3 方法
1.3.1 MTT法檢測多西紫杉醇對 JEG-3細胞增殖的影響 實驗分組:根據作用于細胞的多西紫杉醇濃度不同將實驗分為7組,樣本數 4個(濃度分組:0.0、0.001、0.01、0.1、1、10、100 mg·L-1)。藥物作用時間分別為 24、48、72 h;實驗方法:制備單細胞懸液→96孔板內培養至貼壁生長→根據分組加入藥物溶液→繼續培養 24、48、72 h→MTT法測定細胞增殖抑制率。
1.3.2 流式細胞儀檢測多西紫杉醇對絨癌 JEG-3細胞凋亡及細胞周期的影響 實驗分組:根據作用于細胞的多西紫杉醇濃度不同將實驗分為 4組。樣本數4個(濃度分組:0.0、0.001、0.01、0.1 mg· L-1)。藥物作用時間分別為:24、48 h;實驗方法:制備單細胞懸液→培養瓶內培養至貼壁生長→根據分組加入藥物溶液→繼續培養 24、48 h→將培養瓶內細胞制備成單細胞懸液并固定細胞→細胞凋亡及細胞周期情況檢測(由流式細胞儀完成)。
1.4 數據整理與統計學分析 數據經 SPSS15.0統計軟件統計分析,組內數據行正態分布性檢驗,組間數據經方差齊性檢驗后行方差分析;Spearman分析各變量之間的相關性;IC50用probit回歸分析計算,P<0.05認為有統計學意義。
2 結果與分析
2.1 MTT法檢測 JEG-3細胞增殖抑制率 見表1。用不同濃度多西紫杉醇處理 JEG-3細胞 24、48 和72 h后的細胞增殖抑制率。各多西紫杉醇作用組細胞增殖抑制率與空白對照組比較(P<0.05,有統計學意義)。同一濃度多西紫杉醇作用下,時間延長與細胞增殖抑制率與同一作用時間下,多西紫杉醇濃度增加與細胞增殖抑制率均呈直線相關(P <0.05,有統計學意義),相關系數 r>0.8,P<0.05。多西紫杉醇作用 24、48、72 h的IC50分別為99.6、4.1、0.1 mg·L-1。
2.2 流式細胞儀檢測絨癌 JEG-3細胞凋亡率和細胞周期
2.2.1 細胞凋亡率的統計 根據流式細胞儀檢測結果分析:用呈 10倍增加濃度的多西紫杉醇處理JEG-3細胞24和48 h后的細胞凋亡率(表 2)。各多西紫杉醇作用組細胞凋亡率均大于空白對照組,且細胞凋亡率隨多西紫杉醇作用濃度的增加和作用時間的延長而增大(P<0.05,有統計學意義)。凋亡曲線圖顯示凋亡峰于G1期前出現(圖1,2)。
表1 不同濃度多西紫杉醇作用24、48、72 h后的 JEG-3細胞增殖抑制率%[(±s),n=4]
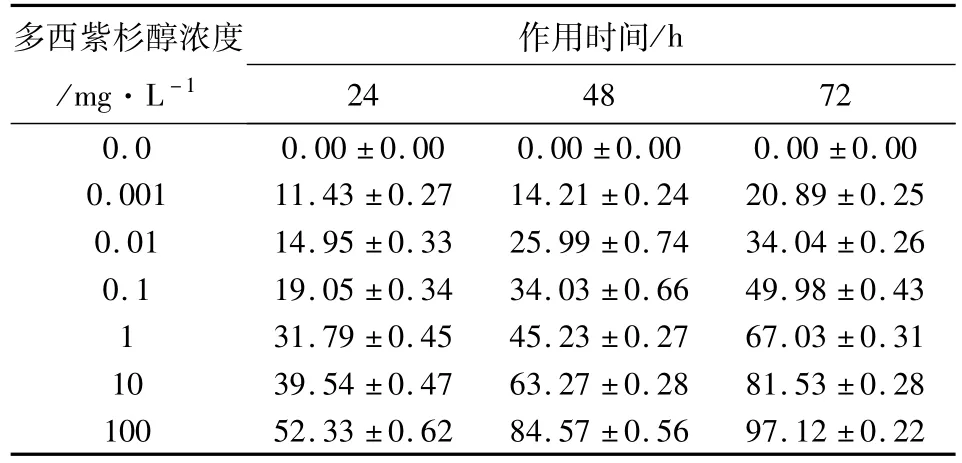
表1 不同濃度多西紫杉醇作用24、48、72 h后的 JEG-3細胞增殖抑制率%[(±s),n=4]
注:按a=0.05水準,同一濃度不同時間組及同一時間不同濃度組與對照組增殖抑制率比較(P<0.05,具有統計學意義)。
多西紫杉醇濃度/mg·L-1作用時間/h 24 48 72 0.0 0.00±0.00 0.00±0.00 0.00±0.00 0.001 11.43±0.27 14.21±0.24 20.89±0.25 0.01 14.95±0.33 25.99±0.74 34.04±0.26 0.1 19.05±0.34 34.03±0.66 49.98±0.43 1 31.79±0.45 45.23±0.27 67.03±0.31 10 39.54±0.47 63.27±0.28 81.53±0.28 100 52.33±0.62 84.57±0.56 97.12±0.22
表2 不同濃度多西紫杉醇作用24、48 h后的JEG-3細胞凋亡率%[(±s),n=4]
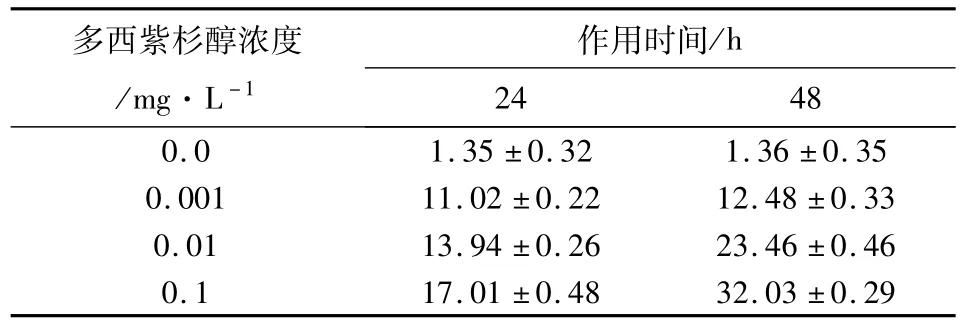
表2 不同濃度多西紫杉醇作用24、48 h后的JEG-3細胞凋亡率%[(±s),n=4]
注:按a=0.05水準,同一濃度不同時間組及同一時間不同濃度組與對照組凋亡率比較,P<0.05,具有統計學意義,不同時間組間及不同濃度組間兩兩比較,P<0.05,具有統計學意義。
多西紫杉醇濃度/mg·L-1作用時間/h 24 48 0.0 1.35±0.32 1.36±0.35 0.001 11.02±0.22 12.48±0.33 0.01 13.94±0.26 23.46±0.46 0.1 17.01±0.48 32.03±0.29
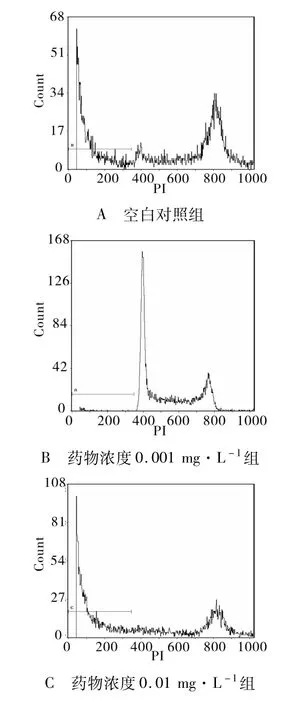
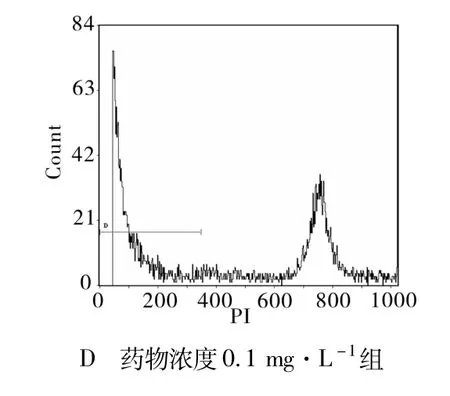
圖1 不同濃度多西紫杉醇作用24 h后 JEG-3細胞凋亡圖
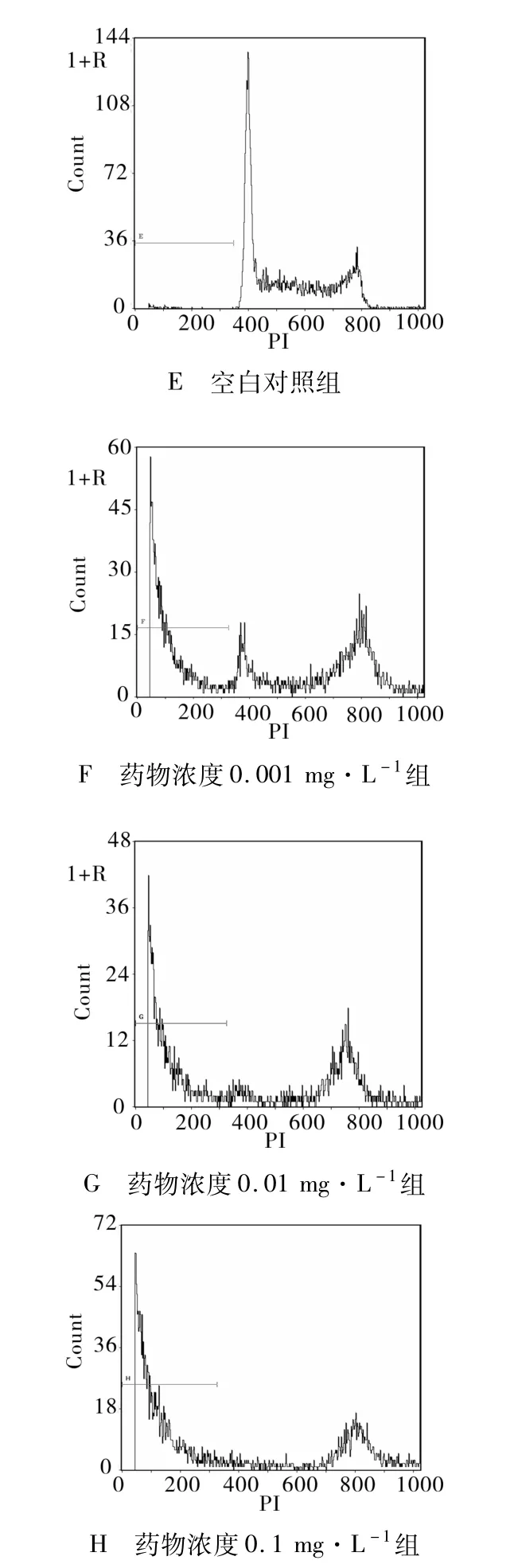
圖2 不同濃度多西紫杉醇作用48 h后 JEG-3細胞凋亡圖
2.2.2 細胞周期分析 分別用終濃度為0.001、0.01、0.1 mg·L-1的多西紫杉醇處理 JEG-3細胞24和48 h后的JEG-3細胞周期百分比(見表 3、圖3,4)。不同濃度多西紫杉醇作用于JEG-3細胞后G2/M期的百分比與對照組比較均增加(P<0.05,有統計學意義),且 G2/M期 JEG-3細胞百分率隨多西紫杉醇濃度增高而遞增。
表3 不同濃度多西紫杉醇處理 JEG-3細胞24和48 h后的細胞周期百分比[(±s),n=3]
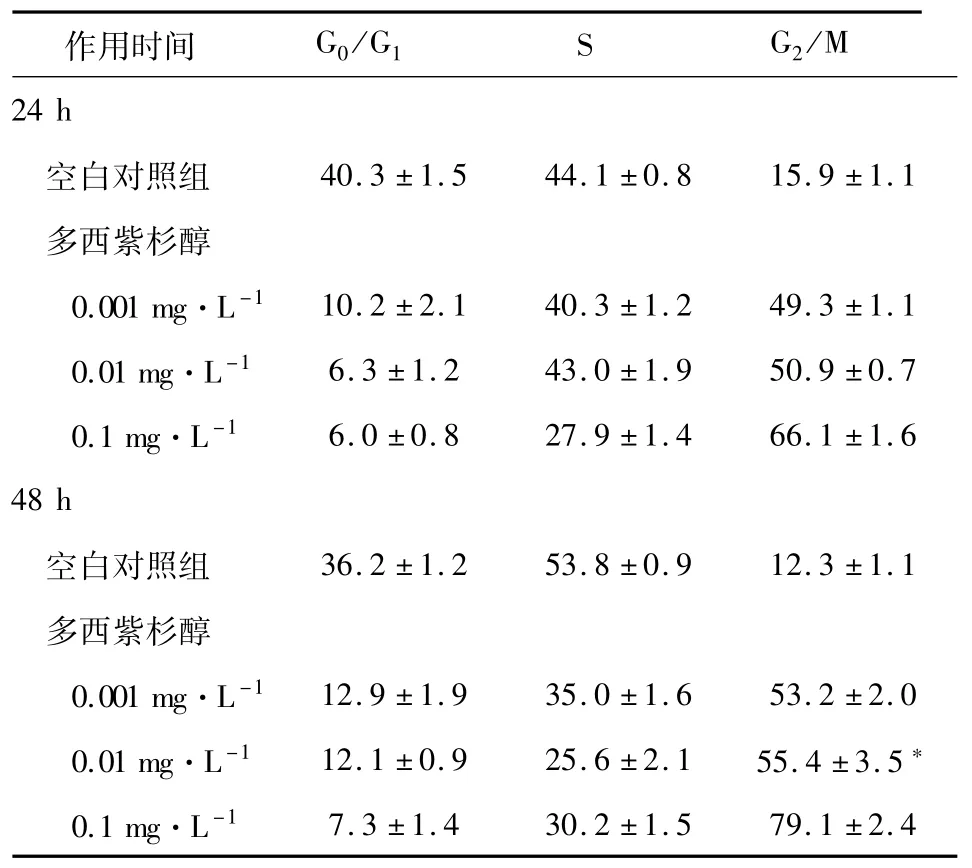
表3 不同濃度多西紫杉醇處理 JEG-3細胞24和48 h后的細胞周期百分比[(±s),n=3]
注:按a=0.05水準,同一時間不同濃度組G2/M期細胞百分比均大于對照組,P<0.05,具有統計學意義。*為實驗誤差。
作用時間 G0/G1S G2/M
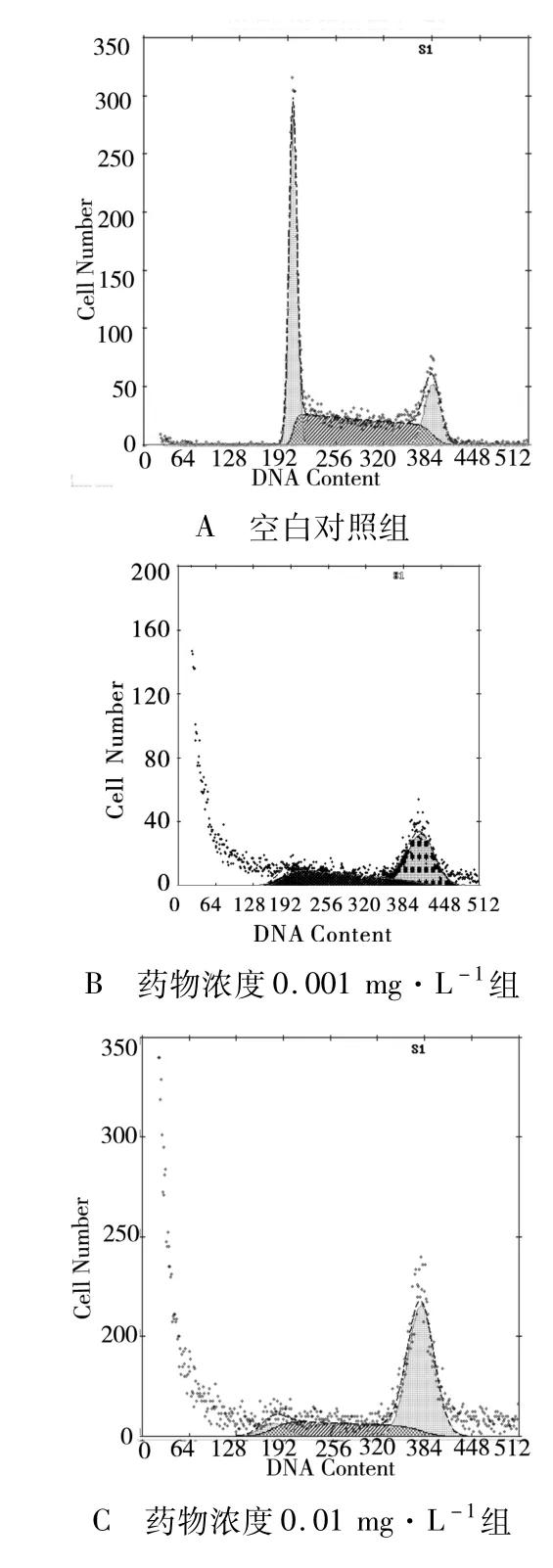
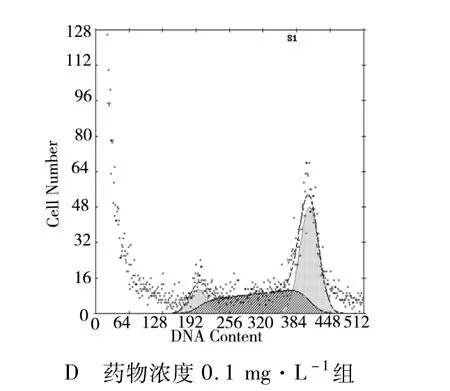
圖3 不同濃度多西紫杉醇作用24 h后 JEG-3細胞周期圖
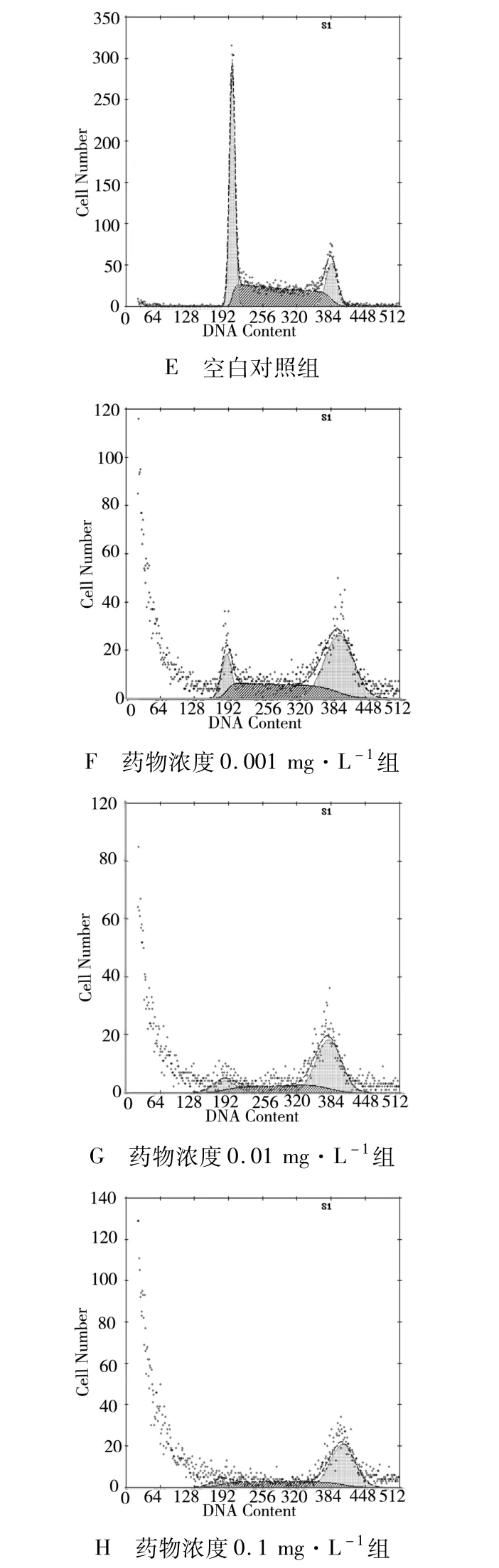
圖4 不同濃度多西紫杉醇作用48 h后 JEG-3細胞周期圖
3 討論
本實驗經由 MTT比色法,檢測出多西紫杉醇作用后,存活的絨癌 JEG-3細胞減少,存活絨癌 JEG-3細胞的百分比隨藥物濃度的增加及作用時間的延長而下降,呈明顯時間、濃度相關,多西紫杉醇作用于 JEG-3細胞 72 h的IC50為 0.1 mg·L-1,與該類藥物對其敏感的惡性腫瘤細胞的IC50相近[8]。
紫杉醇是典型的細胞毒劑,藥物通過作用于細胞質中的細胞微管網,結合至微管蛋白 N端第 217 ~231位和第31位氨基酸,促進微管蛋白的聚合并抑制其解聚,使組成微觀的細胞內骨架的合成停止而形成穩定的非功能性微管束,微觀組織中心與非功能性微觀束連接增加,與功能性維管束的相互連接被阻斷,細胞有絲分裂停止于 G2/M期后死亡[9]。本實驗發現多西紫杉醇作用于絨癌細胞后,JEG-3細胞的有絲分裂停止于 G2/M期,且細胞凋亡與藥物具有時間—濃度依賴性,支持該種觀點。另有觀點認為紫杉醇還能與巨噬細胞上的腫瘤壞死因子(TNF)受體結合,使細胞釋放TNF-α1、INF-α、INF-β、IL-1、IL-2、IL-6增加,而達到對腫瘤細胞抑制和殺傷的作用[10]。紫杉醇能否經此種方法誘導 JEG-3細胞凋亡,本次試驗未涉及,有待進一步試驗明確。
[1] Blutt SE,Mc Donnell TJ,Polek TC,et al.Calcitriol induced apoptosis in LNCaP cells is blockde by overexpression of Bcl-2[J].Endocrinology,2000,141(1):10-17.
[2] Feng SS,Mu L,Chen BH,et al.Polymeric nanospheres fabricated with natural emulsifiers for clinical administration of an anticancer drug paclitaxel(Taxol)[J].Mater Sci Eng,2002,20(122):85-89.
[3] 肖崇厚.中藥化學[M].上海:上海科學技術出版社,1997:461 -463.
[4] Wani MC,Taylor HL,Wall WE,et al.Plant antitumor agents VI:The isolation and structure of Taxol,a novel antileukemic and antitumor agent from Taxus brevifolia[J].J Am Chem soc,1971,93 (9):2325-2327.
[5] 李世偉,季楚舒,何義富.紫杉醇方案治療晚期食管癌的臨床研究進展[J].安徽醫藥,2012,16(11):1561-1563.
[6] 楊慧玲,李 軍.多西他賽單藥一線治療晚期非小細胞肺癌臨床研究[J].實用臨床醫藥雜志,2012,16(17):109-111.
[7] 余景星,劉 心,徐 波.多西他賽誘導 HL-60/ADR細胞凋亡對P-gp、BCL-2、BAX蛋白表達的影響[J].中國實驗血液學雜志,2010,18(2):311-316.
[8] Stierle A,Strobel G,Stierle D,et al.The search for taxol producing microorganisms among the endophytic fungi of the Pacific yew.Taxus Brevifolia[J].J Nat Prod,1995,58:1315-1324.
[9] Schiff PB,Fant J,Horwitz SB.Promotion of microtubule assembly in vitro by taxol[J].Nature,1979,277(5698):665-667.
[10]Extra JM,Rousseau F,Bruno R,et al.PhaseⅠ and pharmacokinetic study of Taxotere(RP 5697;NSC 628503)give as a short intravenous infusion[J].Cancer Res,1993,53(5):1037-1042.
Effect of Docetaxel on the proliferation and apoptosis of choriocarcinoma JEG-3 cells
LI Cen1,2,LIU Hui-ning2
(1.Department of Obstetrics and Gynecology,First People’s Hospital of Yangzhou,Jiangsu 225000,China;2.Xiangya Hospital,Changsha,Hunan 410000,China)
Objective To explore the effect of Docetaxel on the proliferation and apoptosis of choriocarcinoma JEG-3 cells.Methods MTT assay was used to detect the proliferation of choriocarcinoma JEG-3 cells and flow cytometry to detect the effect of Docetaxel under different concentrations on apoptosis and cell cycle.Results With the increase of drug concentration in Docetaxel and drug action time,the degree of inhibition and apoptosis of human choriocarcinoma JEG-3 cells was significantly increased(P<0.05).Conclusions The experimental results show that Docetaxel has significant effect on inhibiting proliferation and promote apoptosis of choriocarcinoma JEG-3 cells.
Docetaxol;JEG-3 cells;proliferation;apoptosis
10.3969/j.issn.1009-6469.2014.05.049
2013-12-28,
2014-03-06)

