去鐵胺(DFO)誘導骨髓增生異常綜合征(MDS)細胞株SKM-1的P15INK 4B基因去甲基化
丁倩倩 陳勤奮 王小欽
(復旦大學附屬華山醫院血液科 上海 200040)
骨髓增生異常綜合征(myelodysplastic syndr o me,MDS)是起源于造血干細胞的克隆性疾病,表現為粒系、紅系和巨核細胞系一系或多系發育異常和無效造血導致外周血一系或多系血細胞計數減少,其轉歸是骨髓衰竭或演變為急性髓性白血病(acute myeloid leukemia,A ML)。近年來,MDS的表觀遺傳改變和鐵過載危害成為研究熱點。DNA異常甲基化是目前研究最多的MDS表觀遺傳改變,其中P15INK4B基因啟動子區Cp G島的高度甲基化在血液系統腫瘤出現頻繁[1],與 MDS的發生發展及轉化為AML密切相關[2],啟動子區的高度甲基化可導致該抑癌基因失活[3-4]。同時,MDS患者由于骨髓無效造血反饋性刺激腸道鐵吸收增多以及反復紅細胞輸注等原因,導致鐵過載(iron overload),造成重要臟器損害,加速白血病的轉化,抑制造血功能,因此鐵過載是MDS總生存(overall survival,OS)和無白血病生存的一個獨立預后因素[5-6]。除了去甲基化治療外,去鐵治療已被列入多個治療指南[5]。最新研究表明,在去甲基化治療前使血清鐵蛋白(serum ferritin,SF)降至1 000μg/L以下,可獲得更高的總體反應率(overall response,OR)和OS[7]。本研究首次采用鐵螯合劑去鐵胺(def er oxa mine,DFO)誘導鐵過載的 MDS細胞株SK M-1 P15INK4B基因去甲基化,以探討去鐵對MDS的治療作用,國內外尚未見報道。
材料和方法
研究對象 MDS細胞株SK M-1來源于1名MDS-RAEBT轉化為A ML-M5的76歲男性患者的外周血,由本科室保存。SK M-1是研究MDS發生、發展、DNA重排改變以及基因不穩定性的理想細胞株,呈淋巴細胞形態,強烈表達髓過氧化物酶[8-9]。
細胞培養及分組 SK M-1細胞在含10%滅活胎牛血清的RPMI 1640培養液(美國Hy Cl one公司)于37℃、5%CO2培養箱(美國Ther mo公司)中培養。取對數生長期細胞,以1×106/ml密度接種于12孔板,1 ml/孔,分為3組(每組3復孔),分別為對照組、枸櫞酸鐵銨(ferric ammoiu m citrate,FAC)組和FAC+DFO組。其中對照組不加FAC和DFO培養48 h;FAC組加入400μmol/L FAC(美國Sigma公司)培養48 h,使SK M-1細胞鐵過載;FAC+DFO組加入400μmol/L FAC培養24 h后,換用含100μmol/L DFO(瑞士Novartis公司)的培養液繼續培養24 h,以對鐵過載的SK M-1細胞進行去鐵處理。3組分別收集細胞備用。
細胞內可變鐵池(labile iron pool,LIP)的檢測 采用Calcein-A M單染法檢測LIP。收集3組細胞,無血清RPMI 1640培養液洗滌2次,調節細胞密度為1×106/ml,加入 Calcein-AM (美國 Sigma公司),終濃度為0.125μmol/L,37℃、5%CO2培養箱中孵育5 min,RPMI 1640培養液洗滌2次,流式細胞儀(美國BD公司)檢測平均熒光強度(mean fluorescence intensity,MFI)。以對照組為基線,用MFI下降的百分比即相對熒光淬滅率反映LIP的相對水平,LIP (%)= (MFI對照組-MFI實驗組/MFI對照組)×100%。
細胞內活性氧類(reactive oxygen species,ROS)的檢測 收集3組細胞,調節細胞密度為1×106/ml,按ROS檢測試劑盒(上海碧云天公司)說明進行操作,流式細胞儀檢測 MFI。熒光探針DCFHDA本身沒有熒光,可自由穿過細胞膜進入細胞內,酯酶水解生成DCFH。DCFH不能通透細胞膜,探針很容易被裝載到細胞內。細胞內的ROS可以氧化無熒光的DCFH生成有熒光的DCF。DCF的熒光強度與細胞內ROS水平成正比。
P15INK4B基因甲基化的檢測 采用甲基化特異性PCR(MSP)法檢測P15INK4B基因的甲基化水平。收集3組細胞,按DNA提取試劑盒(德國Qiagen公司)說明提取DNA,按甲基化修飾試劑盒(美國Zy mo公司)說明用亞硫酸氫鈉修飾DNA,經乙醇沉淀回收重懸于溶解液中。分別用甲基化(M)和非甲基化(U)兩種引物進行擴增。引物序列見表1。PCR反應條件:95℃變性10 min,95℃變性30 s,60℃退火30 s,72℃延伸30 s,擴增40個循環,最后一次72℃延伸7 min。PCR反應總體系25μL,包括:Zy mo TaqTMPre Mix 12.5μL,正向引物(濃度20μmol/L)0.5μL,反向引物(20μmol/L)0.5 μL,DNA 2μL,dd H2O 9.5μL。取5μL擴增產物,6×加樣緩沖液1μL,3.0% 瓊脂糖膠100 V電泳,UVP凝膠成像系統觀察結果并照相。空白對照為不加DNA的dd H2O。
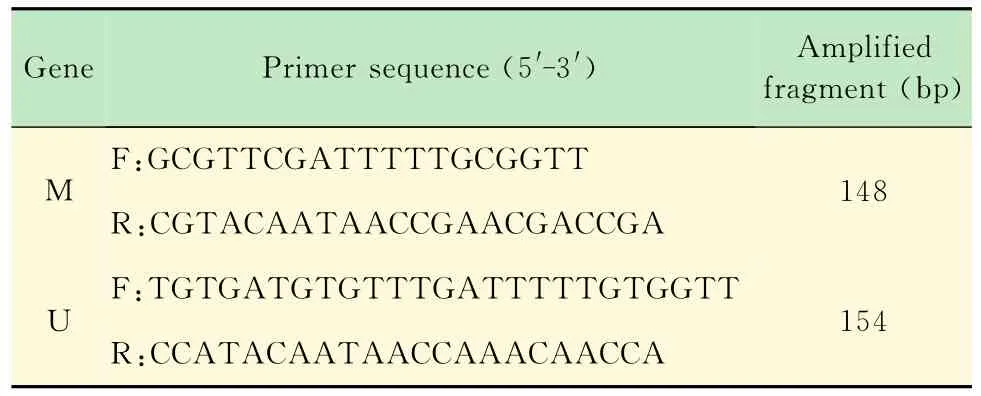
表1 P15INK 4B引物序列Tab 1 Pri mer sequences of P15 INK 4B
P15INK4B基因mRNA的檢測 采用實時熒光PCR (real-ti me fluorescent PCR)相對定量法,以GAPDH為內參,計算各樣品的ΔCt(目的基因Ct值-GAPDH基因Ct值),以表達最低樣本作為校正樣品,計算RQ值,公式:RQ=2-(樣品的ΔCt-校正品ΔCt)。引物由上海生工公司通過Pri mer 5.0軟件設計合成(表2)。PCR反應條件:95℃預變性30 s,95℃30 s,60℃ 34 s,共40個循環,72 ℃滅活5 min,PCR產物4℃保存。PCR反應體系按照Ta Ka Ra公司說明書配制,2×SYBR Premix Ex Taq 10μL,Rox DyeⅡ0.4μL,正向引物0.4μL,反向引物0.4μL,c DNA 2μL,雙蒸水6.8μL。每一個樣本均設3個復孔,計算平均值作為RQ值。
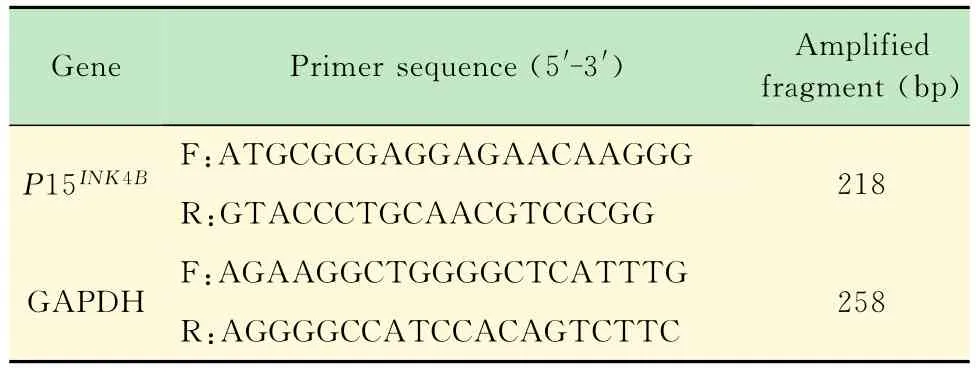
表2 P15 INK 4B和GAPDH引物序列Tab 2 Pri mer sequences of P15 INK 4B and GAPDH
細胞增殖的檢測 采用羥基熒光素二醋酸鹽琥珀酰亞胺脂(carboxy fluorescein diacetate succini midyl ester,CFDASE,簡稱CFSE)法。收集3組細胞,調節細胞密度為1×106/ml,按CFSE細胞增殖與示蹤檢測試劑盒(日本Dojindo公司)說明操作,流式細胞儀檢測MFI。CFSE是一種可穿透細胞膜的熒光染料,進入細胞后不可逆地與細胞內的氨基結合偶聯到細胞蛋白質上。當細胞分裂時,CFSE標記的熒光平均分配至2個子代細胞中,其MFI是親代細胞的一半,隨傳代而衰減。
細胞早期凋亡的檢測 采用Annexin V-FITC單染法。收集3組細胞,調節細胞密度為1×106/ml,按Annexin V-FITC凋亡檢測試劑盒(美國BD公司)說明操作,加入5μL Annexin V-FITC,室溫避光反應20 min,立即進行流式細胞儀檢測。
細胞周期的檢測 采用碘化丙啶(PI)單染法檢測細胞周期。收集3組細胞,PBS洗滌,加入預冷的70%乙醇(PBS配制),于4℃固定過夜,1 200 r/min離心5 min(離心半徑13.5cm),棄上清,PBS洗滌,調節細胞密度為1×106/ml,取100μL,加入RN ase A酶,終濃度為1 mg/ml,混勻后37℃水浴30 min,加入PI綜合染液(美國 Molecular Pr obes公司),終濃度為50μg/ml,混勻,流式細胞儀檢測。
統計學處理 采用SPSS 16.0統計軟件進行分析,計量資料以±s表示,兩組間比較采用配對t檢驗,P<0.05為差異有統計學意義。
結 果
不同鐵負荷組細胞內的LIP 與對照組相比,FAC組和FAC+DFO組的LIP均明顯升高,差異有統計學意義(F=10.60,P<0.001;F=41.79,P=0.0485);與FAC組相比,FAC+DFO組的LIP明顯降低,差異有統計學意義(F=3.942,P<0.0001)。說明FAC使SK M-1細胞鐵負荷增加,DFO則使鐵負荷下降(圖1、表3)。
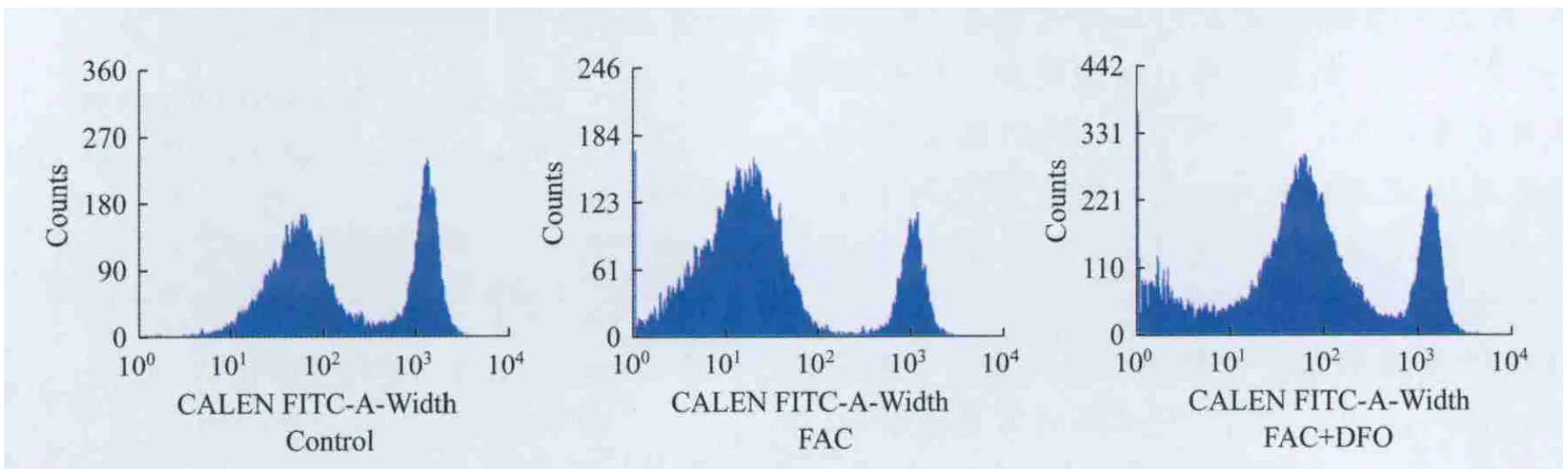
圖1 不同鐵負荷組細胞內LIPFig 1 Cellular LIP of different iron loading groups
表3 不同鐵負荷組的檢測結果Tab 1 Detection results of different iron loading groups (±s)
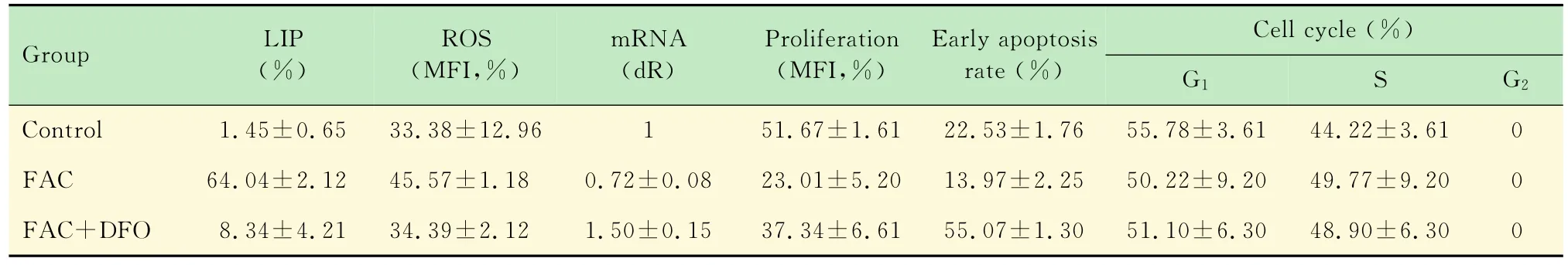
表3 不同鐵負荷組的檢測結果Tab 1 Detection results of different iron loading groups (±s)
Group LIP(%)ROS(MFI,%)mRNA(d R)Pr oliferation(MFI,%)Early apoptosis rate(%)Cell cycle(%)G1 S G2 Control 1.45±0.65 33.38±12.96 1 51.67±1.61 22.53±1.76 55.78±3.61 44.22±3.610 FAC 64.04±2.12 45.57±1.18 0.72±0.08 23.01±5.20 13.97±2.25 50.22±9.20 49.77±9.20 0 FAC+DFO 8.34±4.21 34.39±2.12 1.50±0.15 37.34±6.61 55.07±1.30 51.10±6.30 48.90±6.300
不同鐵負荷組細胞內的ROS 與對照組相比,FAC組的ROS明顯升高,差異有統計學意義(F=6.016,P=0.0025);FAC+DFO組的ROS無明顯升高,差異無統計學意義(F=2.541,P=0.764)。與FAC組相比,FAC+DFO組的ROS明顯降低,差異有統計學意義(F=15.29,P=0.0154)。說明隨著鐵負荷增減,細胞內ROS水平也有所增減,DFO在使鐵負荷下降的同時,降低SK M-1細胞內ROS水平(圖2、表3)。
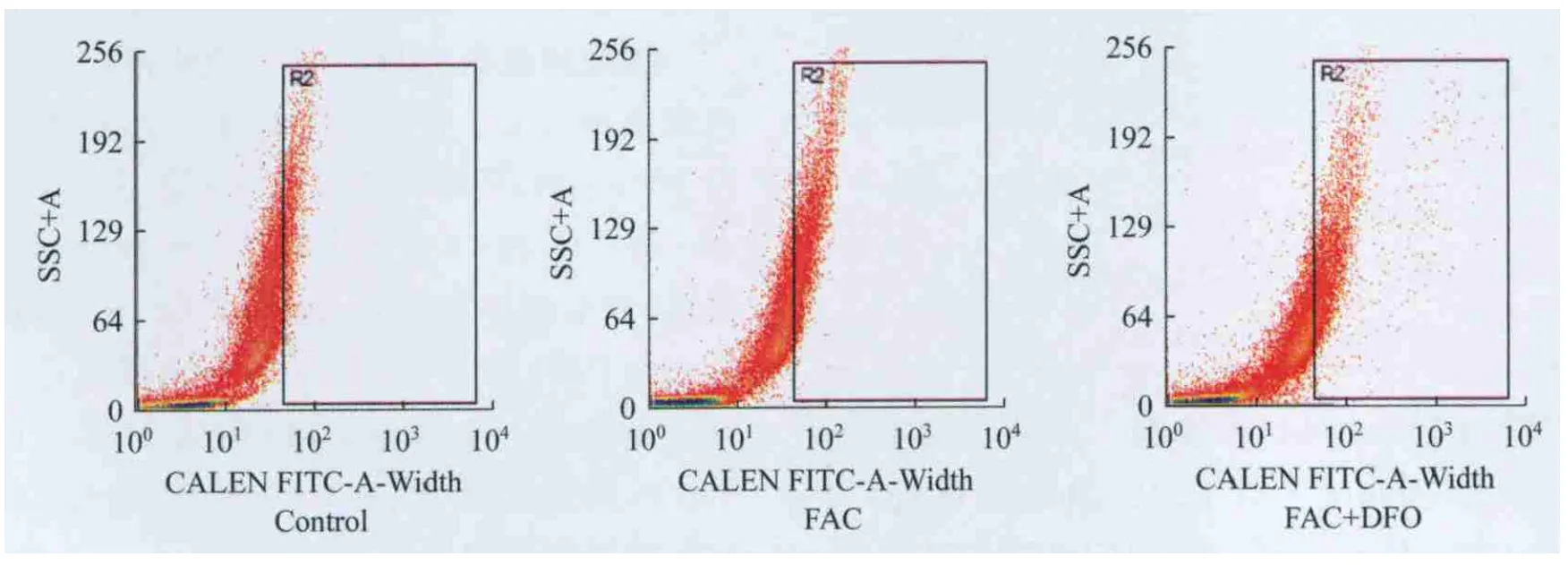
圖2 不同鐵負荷組細胞內ROSFig 2 Cellular ROS of different iron loading groups
不同鐵負荷組細胞的P15INK4B基因甲基化情況電泳圖顯示,對照組的SKM-1細胞呈現明顯甲基化,未出現非甲基化條帶;FAC組的甲基化條帶略淡,但未出現非甲基化條帶;FAC+DFO組的甲基化條帶明顯變淡,并出現非甲基化條帶(圖3)。

圖3 不同鐵負荷組細胞P15INK 4B基因甲基化狀態電泳圖Fig 3 The electr ophotogram of P15INK 4B gene methylation state in different ir on loading groups
不同鐵負荷組細胞的P15INK4B基因mRNA表達情況 與對照組相比,FAC組的P15INK4B基因mRNA表達水平下降(F=2.2 6 5,P=0.0274),FAC+DFO組的表達水平升高(F=1.483,P=0.0117),差異均有統計學意義(P<0.05),說明鐵過載抑制了P15INK4B基因的表達,而去鐵可使P15INK4B基因重新表達(圖4、表3)。
不同鐵負荷組細胞的增殖情況 與對照組相比,FAC組和FAC+DFO組CFSE的MFI均減少(F=10.42,P=0.0008;F=16.84,P=0.0218),差異均有統計學意義(P<0.05),說明兩組細胞均有增殖。但與FAC組相比,FAC+DFO組CFSE的MFI升高,差異有統計學意義(F=1.617,P=0.0419),說明加入DFO后部分抑制了鐵過載SKM-1細胞的增殖(圖5、表3)。
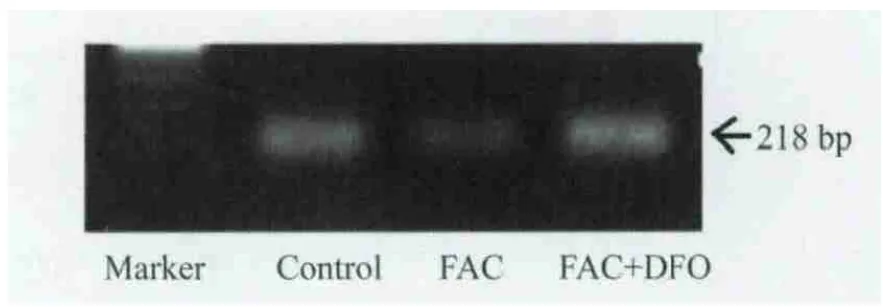
圖4 不同鐵負荷組細胞P15 INK 4B基因mRNA表達電泳圖Fig 4 The electrophotogram of P15 INK 4B gene mRNA expression in different iron loading groups
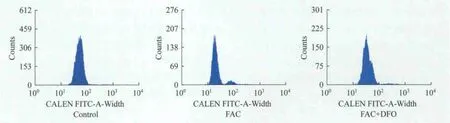
圖5 不同鐵負荷組細胞CFSE的MFIFig 5 MFI of CFSE in different iron loading groups
不同鐵負荷組細胞的早期凋亡情況 與對照組相比,FAC組早期凋亡率減少(F=1.628,P=0.04),FAC+DFO組早期凋亡率增加(F=1.845,P<0.001),差異均有統計學意義(P<0.05);與FAC組相比,FAC+DFO組早期凋亡率明顯增加,差異有統計學意義(F=3.005,P<0.001)。說明鐵負荷抑制SK M-1細胞的凋亡,而去鐵能促進SK M-1細胞的凋亡(圖6、表3)。
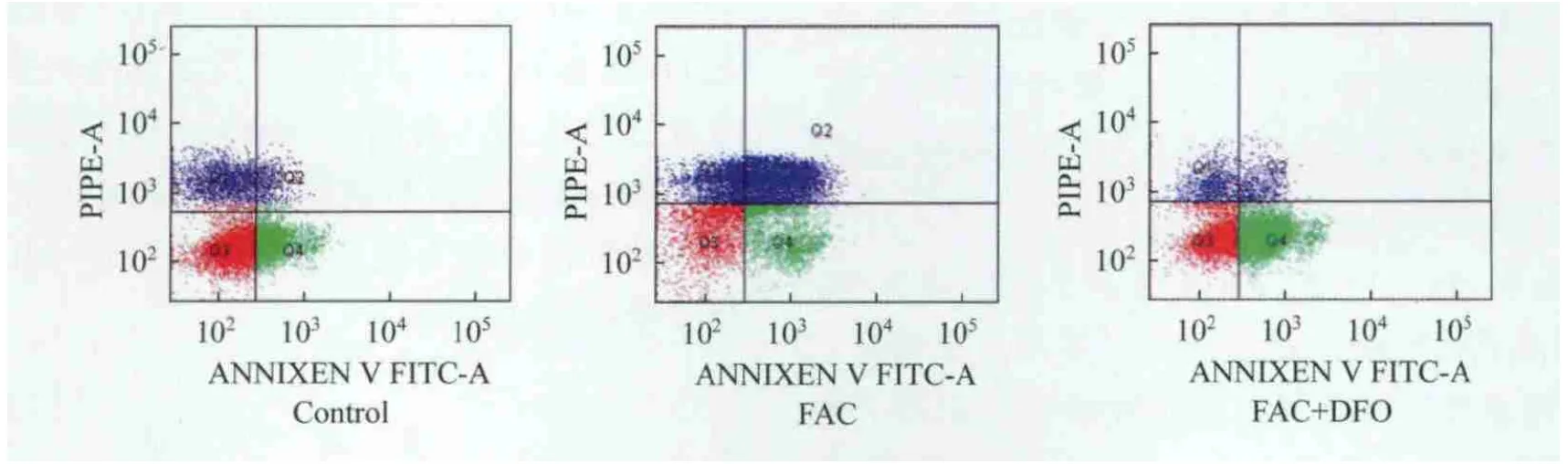
圖6 不同鐵負荷組細胞的早期凋亡率Fig 6 Early apoptosis rate in different iron loading groups
不同鐵負荷組細胞的細胞周期 與對照組相比,FAC組和FAC+DFO組G1期細胞比例有下降,S期細胞比例有升高(F=6.486,P=0.386;F=3.040,P=0.326),但差異無統計學意義 (P>0.05),說明鐵負荷對SK M-1細胞周期無明顯作用(圖7、表3)。
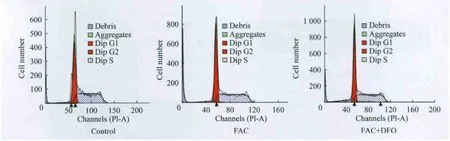
圖7 不同鐵負荷組細胞的細胞周期Fig 7 The cell cycle in different iron loading gr oups
討 論
近年來對MDS的診斷、分型和預后判斷有較大的進展,而治療上或以支持治療為主,或借鑒A ML化療方案。直至2004年以后,由美國FDA批準的DNA甲基轉移酶(DNA met hyltransferase,DNMT)抑制劑阿扎胞苷(5-azacitidine,5-AZA,5-氮胞苷)和地西他濱 (5-aza-2′-deoxycytidine,Decitabine,DAC,5-氮雜-2′-脫氧胞苷)、新型口服鐵螯合劑地拉羅司(Deferasir ox,DFX)以及免疫調節劑雷利度胺(lenalidomide)陸續上市,才改變了長期以來MDS治療的無針對性狀況。P15INK4B基因高度甲基化是較早被證明存在于MDS中的表觀遺傳改變[10],在初發以及疾病進展中均可被檢測到,并且與轉化為白血病高度相關[2,11]。該異常可被DNMT抑制劑所逆轉,在DAC治療后,原本因高度甲基化而靜默的P15INK4B基因重新表達[12]。但是相比DNMT抑制劑的廣泛應用以及對MDS抑癌基因去甲基化的密切關注和研究[13],MDS的去鐵治療尚未得到很大的關注[5]。
研究發現,約80%的MDS患者早期表現為貧血,通過腸道代償性吸收過多的鐵以滿足造血需要,超過40%的患者最終進展為輸血依賴[14]。因此,鐵過載在MDS患者中普遍存在。在MDS的預后評分系統中發現,紅細胞輸注依賴和鐵過載不僅導致器官損害,而且直接損害造血系統功能,對病程產生影響,因此 WHO在國際預后評分系統(IPSS)[15]中增加了貧血和紅細胞輸注依賴指標,形成了WHO預后 評分系統 (WPSS)[16]。Delgado 等[7]研 究 發現,去鐵治療可以提高DNMT抑制劑的療效。
本研究為避開MDS的異質性,選用MDS細胞株SKM-1作為研究對象,參考文獻[17],一方面,用FAC使SK M-1細胞LIP明顯升高,造成鐵過載,誘導ROS明顯升高,同時,抑癌基因P15INK4B的mRNA表達水平明顯下降,SK M-1細胞增殖明顯,凋亡受抑;另一方面,在SK M-1細胞鐵過載的基礎上,用臨床常用的鐵螯合劑DFO進行去鐵,發現LIP明顯下降,ROS也隨之明顯降低,同時,抑癌基因P15INK4B的mRNA表達水平明顯上調,抑制了SK M-1細胞的增殖,促進了其凋亡。提示DFO可誘導鐵過載的SK M-1細胞P15INK4B基因去甲基化,使其重新表達,并可抑制鐵過載的SKM-1細胞增殖,促進其凋亡。臨床上可能與DNMT抑制劑有協同作用。
目前臨床上DNMT抑制劑有2種:5-AZA和DAC,鐵螯合劑有3種:DFO、去鐵酮(deferiprone,DFP)和DFX,在中國批準用于MDS鐵過載治療的是DFO和DFX[18]。表觀遺傳學修飾治療和去鐵治療最近已被納入我國的 MDS治療專家共識[19],正改善著MDS的自然病程和預后。本研究為表觀遺傳學修飾治療和去鐵治療協同應用于MDS治療提供了基礎理論依據。
[1]Esteller M,Cor n PG,Baylin SB,et al.A gene hyper met hylation pr ofile of human cancer[J].Cancer Res,2001,15,61(8):3225-3229.
[2]Tien HF,Tang JH,Tsay W,et al.Met hylation of t he p15(INK4B)gene in myelodysplastic syndrome:it can be detected early at diagnosis or during disease progression and is highly associated wit h leukaemic transfor mation[J].Br J Haematol,2001,112(1):148-154.
[3]Yasaei H,Gil ham E,Pickles JC,et al.Carcinogen-specific mutational and epigenetic alterations in INK4 A,INK4B and p53 tumour-suppressor genes drive induced senescence bypass in nor mal diploid mammalian cells[J].Oncogene,2013,32(2):171-179.
[4]Qian X,Dur kin ME,Wang D,et al.Inactivation of t he Dlc1 gene cooperates with downregulation of p15INK4b and p16Ink4a,leading to neoplastic transfor mation and poor prognosis in hu man cancer[J].Cancer Res,2012,72(22):5900-5911.
[5]肖志堅.重視骨髓增生異常綜合征鐵過載的診斷和治療[J].中華血液學雜志,2011,32(8):505-506.
[6]Gatter mann N,Rach milewitz EA.Iron overload in MDS-pathophysiology,diagnosis,and complications[J].Ann Hematol,2011,90(1):1-10.
[7]Delgado RG,de Miguel D,Bailen A,et al.Multivariate analysis of t he i mpact of pre-treat ment seru m ferritin level on response and overall survival in patients with myelodysplastic syndromes treated wit h azacitidine[J].Blood (ASH Annual Meeting Abstr acts),2012,120:1710.
[8]Nakagawa T, Matozaki S, Murayama T,et al.Establish ment of a leukaemic cell line fr om a patient with acquisition of chr omosomal abnor malities during disease progression in myelodysplastic syndr ome[J].Br J Haematol,1993,85(3):469-476.
[9]Nakagawa T,Matozaki S.The SK M-1 leukemic cell line established fr om a patient wit h pr ogression to myelomonocytic leukemia in myelodysplastic syndr ome(MDS)-contribution to better understanding of MDS[J].Leuk Ly mphoma,1995,17(3-4):335-339.
[10]Uchida T,Kinoshita T,Nagai H,et al.Hyper met hylation of t he p15INK4B gene in myelodysplastic syndr omes[J].Blood,1997,90(4):1403-1409.
[11]Aoki E,Uchida T,Ohashi H,et al.Methylation status of the p15INK4B gene in hematopoietic progenitors and peripheral blood cells in myelodysplastic syndr omes[J].Leukemia,2000,14(4):586-593.
[12]Santos FP,Kantarjian H,Garcia-Manero G,et al.Decitabine in t he treat ment of myelodysplastic syndromes[J].Expert Rev Anticancer Ther,2010,10(1):9-22.
[13]Santini V.Novel therapeutic strategies:hypomethylating agents and beyond[J].Hematol Am Soc Hematol Educ Pr ogr am,2012:65-73.
[14]聶玲,李磷,楊藝紅,等.骨髓增生異常綜合征患者鐵代謝狀況及其對預后的影響[J].中華血液學雜志,2009,30(1):50-53.
[15]Greenberg P,Cox C,LeBeau MM,et al.International scoring system f or evaluating prognosis in myelodysplastic syndr omes[J].Blood,1997,89(6):2079-2088.
[16]Malcovati L,Della Porta MG,Str upp C,et al.Impact of the degree of anemia on t he outcome of patients with myelodysplastic syndrome and its integration into t he WHO classification-based Prognostic Scoring System(WPSS)[J].Haematologica,2011,96(10):1433-1440.
[17]謝芳,趙明峰,李玉明,等.鐵過載誘導物質生成對骨髓造血功能影響的體外實驗研究[J].中華血液學雜志,2011,32(9):606-609.
[18]中華醫學會血液學分會/中國醫師協會血液科醫師分會.鐵過載診斷與治療的中國專家共識[J].中華血液學雜志,2011,32(8):572-574.
[19]中華醫學會血液學分會.骨髓增生異常綜合征診斷與治療專家共識[J].中華血液學雜志,2012,33(4):347-352.

