硫氧還蛋白-2在急性壞死性胰腺炎大鼠肺的表達及意義
趙暉 鐘衛(wèi)一 韋惠琴 黃滟添
硫氧還蛋白-2(thioredoxin-2, Trx-2)是存在于細胞線粒體的一種氧化還原蛋白,研究顯示Trx-2在阻止線粒體氧化應激方面較Trx-1更具重要作用[1]。為此,本研究檢測Trx-2在急性壞死性胰腺炎(ANP)大鼠肺的表達,探討Trx-2在對抗肺氧化應激方面的作用。
一、材料與方法
1.實驗動物及分組:健康雄性SD大鼠48只,清潔級,體質量200~250 g,由廣西醫(yī)科大學實驗動物中心提供。所有大鼠造模前禁食12 h,自由飲水。按完全隨機法分成ANP組和對照組,每組各24只。采用腹腔注射6%左旋精氨酸(Sigma公司)25 ml/kg體質量、每次間隔1 h、共3次的方法制備ANP模型。對照組大鼠則腹腔注射等容積生理鹽水。術后6 、12 、24 h分別處死8只大鼠,留取動脈血、胰腺和肺組織標本待測。
2.胰腺和肺組織病理學檢查:胰腺和肺組織常規(guī)固定、石蠟包埋、切片及HE染色。光鏡下觀察大鼠胰腺病理改變,參考Kusske等[2]的標準進行評分。
3.血清谷胱甘肽(GSH)、丙二醛(MDA)測定:GSH、MDA試劑盒購自南京建成生物工程研究所,按說明書操作。
4.Trx-2表達檢測:采用Elivison二步法檢測肺組織Trx-2表達。兔抗鼠多抗購自北京生物合成及生物技術公司,工作濃度1∶200;生物素化羊抗兔二抗來自即用型免疫組化Elivision plus廣譜試劑盒。以PBS代替一抗作為陰性對照,用已知表達Trx-2的乳腺癌組織作為陽性對照。應用Leica圖像分析系統(tǒng)進行定量灰度掃描,求出給定面積內的灰度值。染色愈深、灰度值愈小,則表示蛋白表達愈強。
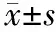
二、結果
1.胰腺及肺組織病理變化:對照組大鼠胰腺肉眼觀無明顯變化;鏡下見胰腺腺泡結構完整,腺小葉清晰,偶見水腫或少量炎性細胞浸潤。ANP組大鼠胰腺外觀呈灰白或暗紫色,腹腔內有淡黃色或血性腹水,可見部分腹腔臟器粘連、脂肪皂化;鏡下見胰腺腺泡水腫,炎性細胞浸潤,組織壞死出血,腺小葉結構消失,偶見灶狀或大片凝固性壞死,并隨時間延長而加重(表1)。
對照組大鼠肺臟肉眼觀無明顯變化;鏡下見肺組織結構完整,偶見水腫或少量炎性細胞浸潤。ANP組大鼠鏡下見肺泡出血、水腫,間質出血、水腫,炎性細胞浸潤,毛細血管淤血,甚至出現(xiàn)灶性或片狀肺不張,并隨時間延長而加重(表1)。
2.血清GSH、MDA水平的變化:ANP組大鼠血清GSH水平隨時間延長而逐漸下降,各時點均較對照組顯著降低,差異有統(tǒng)計學意義;ANP組血清MDA水平隨時間延長而逐漸上升,各時點均較對照組顯著升高,差異有統(tǒng)計學意義(表1)。
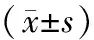
表1 兩組大鼠各指標的比較
3.肺組織Trx-2表達的變化:ANP組6、12 h的肺組織Trx-2表達強度與對照組差異無統(tǒng)計學意義,24 h點表達強度顯著增高,與對照組的差異有統(tǒng)計學意義(表1、圖1) 。
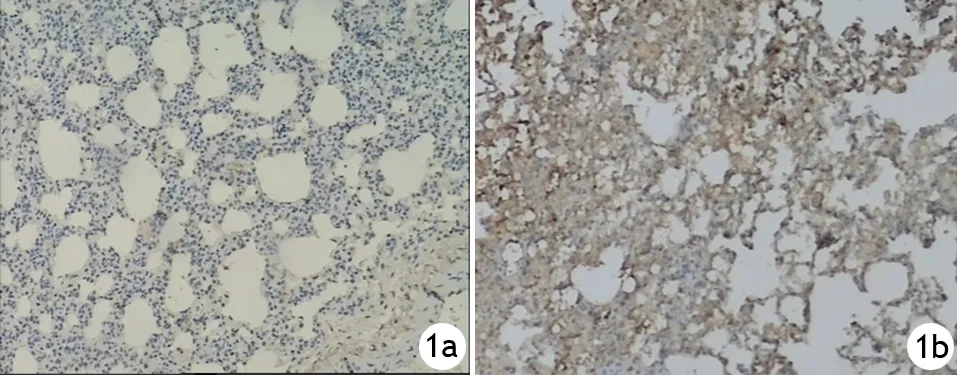
圖1 對照組(1a)、ANP組(1b) 24 h點肺組織Trx-2表達(免疫組化×100)
討論硫氧還蛋白是一個廣泛分布的氧化還原蛋白,通過二硫化物活性中心可逆地催化許多氧化還原反應,參與機體多種生物學活動,目前發(fā)現(xiàn)的Trx有Trx-1、Trx-2、Trx-14和Trx-80。研究表明,Trx-1和Trx-2過量表達協(xié)同阻止多種炎性因子(TNF、ROS、ASK1)誘導的細胞死亡[3]。最近研究揭示,線粒體在細胞凋亡信號轉導中發(fā)揮關鍵作用,而Trx-2在參與線粒體介導的凋亡途徑、阻止線粒體膜的去極化、維持膜電位等方面較Trx-1更有效[1]。它們對氧化應激保護作用的差異可能是與其表達部位不同有關。Trx-2在線粒體中表達,而Trx-1在細胞質中表達,因此,Trx-2可以直接阻止線粒體膜的去極化[4]。Umasuthan等[5]研究表明,Trx-2是一種針對抗菌反應的強效抗氧化劑。
與Trx-1比較,Trx-2的結構存在一個額外的N-末端結構域,它包含兩個高度保守的CXXC( Cys Xaa Xaa Cys)氨基酸序列結構,這兩個CXXC結構緊密協(xié)調一個鋅原子,組成鋅中心,氧化時鋅被釋放,通過釋放鋅引發(fā)主要構象變化,發(fā)揮氧化還原開關的作用[6]。Trx-2鋅結合蛋白的特點是鋅極端的親和力,它遠遠高于已報道的其他鋅結合蛋白的親和常數(shù),因此,這種鋅結合蛋白顯得更加穩(wěn)定[7]。Ritz等[8]研究顯示,體內氧化應激早期時,所有Trx-2的半胱氨酸處于還原狀態(tài),并不反映活性氧的存在。他們認為Trx-2功能可相當于Trx-1 ,在氧化應激條件下可能作為一個備份系統(tǒng)發(fā)揮作用。
本課題組先前的研究結果顯示,在ANP早期肺組織Trx-1表達即顯著升高[9]。本結果顯示Trx-2在肺組織的表達在早期并不升高,而在晚期隨著氧化應激反應的加重(表現(xiàn)為血GSH持續(xù)降低,MDA持續(xù)升高)時才顯著升高,與Ritz等[8]的結果相一致,表明Trx-2可能作為一個備用系統(tǒng)參與肺的氧化應激反應。Trx-2在氧化應激的早期表達不高,除與Trx-2鋅結合蛋白極端親和力的特征外,還可能與Trx-1表達增高,減少氧化應激有關[10]。
參 考 文 獻
[1] Sugano E, Murayama N, Takahashi M, et al. Essential role of thioredoxin 2 in mitigating oxidative stress in retinal epithelial cells[J].J Ophthalmol,2013,185825.
[2] Kusske AM, Rongione AJ, Ashley SW, et al. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice[J]. Surgery, 1996,120(1): 284-288.
[3] Tournier C, Hess P, Yang DD, et al. Requirement of JNK for stress-induced activation of the cytochrome c-mediated death pathway[J]. Science, 2000,288(5467): 870-874.
[4] Sugano E, Isago H, Murayama N,et al.Different anti-oxidant effects of thioredoxin 1 and thioredoxin 2 in retinal epithelial cells[J].Cell Struct Funct, 2013,38(1):81-88.
[5] Umasuthan N, Revathy KS, Lee Y, et al.Mitochondrial thioredoxin-2 from Manila clam (Ruditapes philippinarum) is a potent antioxidant enzyme involved in antibacterial response[J]. Fish Shellfish Immunol, 2012,32(4):513-523.
[6] Collet JF, D′Souza JC, Jakob U, et al. Thioredoxin 2, an oxidative stress-induced protein, contains a high affinity zinc binding site[J].J Biol Chem,2003,278(46):45325-45332.
[7] Hunt JA, Fierke CA. Selection of carbonic anhydrase variants displayed on phage. Aromatic residues in zinc binding site enhance metal affinity and equilibration kinetics[J].J Biol Chem,1997,272(33):20364-20372.
[8] Ritz D, Patel H, Doan B, et al. Thioredoxin 2 is involved in the oxidative stress response in Escherichia coli[J].J Biol Chem, 2000,275(4):2505-512.
[9] 牛桂軍,唐國都,梁志海,等. 硫氧還蛋白-1在急性壞死性胰腺炎大鼠肺組織中的表達褪黑素干預的影響[J].世界華人消化雜志, 2010,18(6):550-556.
[10] Zhang H, Du Y, Zhang X, et al. Glutaredoxin 2 Reduces Both Thioredoxin 2 and Thioredoxin 1 and Protects Cells from Apoptosis Induced by Auranofin and 4-Hydroxynonenal[J]. Antioxid Redox Signal, 2014,21(5):669-681.

