急性髓系白血病患者CXXC5基因表達水平及與預后的相關性
潘志蘭 楊彥 張永梅 張志敏 馮麗倩 邢英杰
·論著·
急性髓系白血病患者CXXC5基因表達水平及與預后的相關性
潘志蘭 楊彥 張永梅 張志敏 馮麗倩 邢英杰
目的研究急性髓系白血病(AML)患者中CXXC5基因的表達水平,并分析其與臨床病理特征的相關性。方法應用EvaGreen實時定量PCR( RQ-PCR) 方法檢測AML 患者中CXXC5基因表達量。結果結果顯示與24例對照相比,94 例AML患者CXXC5轉錄本水平顯著降低 (P<0.01)。44例(45.8%)AML 患者為CXXC5基因低表達,M1/M2/M3亞型患者CXXC5基因的低表達率顯著高于M4/M5/M6 亞型(P<0.01)。CXXC5基因低表達的 AML患者總體生存時間(OS)顯著長于非低表達者(P<0.01)。結論CXXC5低表達常見于AML患者中,且對AML預后具有良性影響。
白血病,髓系,急性;CXXC5;預后;實時定量PCR
急性髓系白血病(AML) 是一種造血系統的髓系原始細胞克隆性惡性增殖疾病,由造血干細胞/髓系祖細胞分化異常以及增生失控而引起[1,2]。該疾病的發生是一個多步驟事件,因多基因異常而使正常的造血干細胞喪失了自我更新能力和分化為多種成熟細胞系的能力,并同時轉化為白血病干細胞而累積在骨髓中[3,4]。研究證實,很多基因包括BAALC、ERG、MN1、EV11和WT1,都在AML中表達失調,并且和AML患者的療效和生存率都具有相關性[5,6]。CXXC5 (CXXC finger protein 5) 是最新鑒定的一種維甲酸敏感基因,它編碼維甲酸誘導的核因子(RINF)。通過基因表達研究和應用基因沉默實驗表明,CXXC5在正常造血功能中發揮著非常重要的作用[7]。該基因定位于染色體5q31.2,它的染色體異常與各種髓系惡性腫瘤疾病均相關,包括低風險5q突變的骨髓增生異常綜合征(MDS)[8]和高風險5q缺失、5q突變的人類AML[9]。本實驗中,我們研究了CXXC5基因在AML患者骨髓中的表達水平,以及該基因的表達與患者臨床病理特征、預后的關系。
1 資料與方法
1.1 一般資料 96例骨髓標本均取自2011年1月至2014年1月期間在河北省石家莊市第一醫院血液科住院的初診AML患者,診斷及分類標準按《血液病診斷及療效標準》[10]。患者臨床病理學特征見表1。對照組骨髓標本24例,其中包括19例缺鐵性貧血(IDA)和5例免疫性血小板減少癥患者。全部患者均于初診時抽取骨髓10 ml,肝素抗凝,用Ficoll密度梯度離心法分離單個核細胞。人類白血病細胞系(HL-60、NB4、THP-1、SHI-1、U937、HEL和K562)購自中國科學院上海細胞生物所。細胞采用RPMI1640培養基(含10%胎牛血清)于CO2培養箱(37℃、5% CO2)靜置培養。當細胞生長狀態良好并且融合度達到80%左右時,用2.5 g/L的胰蛋白酶消化進行細胞傳代。
1.2 總RNA提取和cDNA合成 細胞計數后,按106個/ml在1.5 ml eppendorf管中加入適量TRIzol試劑,提取總RNA。分光光度法測定純度后取2.0 μg,應用隨機引物逆轉錄合成第一鏈cDNA,總體系40 μl,含MMLV逆轉錄酶200 U、dNTP(每種0.5 mmol/L),10 mmol/L DTT,RNAsin 25 μl,37℃逆轉錄1 h,95℃ 5 min滅活,cDNA保存于-20℃備用。
1.3 實時定量PCR(RQ-PCR) 應用EvaGreen染料(Biotium,美國)在7300擴增儀(ABI,美國)上完成RQ-PCR。CXXC5引物序列如下:上游引物,5’-GTGGACCCCTCGGCAGTTG-3’;下游引物,5’-CACACGAGCAGTGACATTGC-3’。PCR反應體系包括:dNTP 0.2 mmol/L,MgCl24 mmol/L,引物0.4 μmol/L,1×ROX,1.0 U Taq DNA聚合酶(MBI,美國),和50 ng cDNA。反應條件:94℃變性30 s,62℃退火30 s,72℃延伸30 s,于84℃30 s記錄熒光量,共40循環,最后72℃延伸7 min。最終的溶解步驟按如下條件完成:95℃ 15 s,60℃ 60 s,95℃ 15 s,60℃ 15 s。采用蒸餾水代替cDNA作為無標本對照(NTC)。標準率按如下公式計算:NCXXC5=(ECXXC5)ΔCT CXXC5(control-sample)÷(EGAPDH)ΔCT GAPDH(control-sample),其中,參數E公式:E=10(-1/slope)(斜率指CT與cDNA作圖所得)。我們選擇一例缺鐵性貧血患者的骨髓標本,檢測得到的最小ΔCT(CXXC5和GAPDH)作為對照。
1.4 統計學分析 應用SPSS 13.0統計軟件,Chi-square分析和Fisher法計算各組間差異。CXXC5基因表達水平和臨床病理特征相關性分析應用Sperman檢測。Kaplan-Meier曲線和Cox regression用來分析CXXC5表達對生存率的影響,P<0.05為差異有統計學意義。
2 結果
2.1 CXXC5基因在對照組中的表達 CXXC5基因在所有對照組病例標本中表達(0.17~1.00,0.49±0.19)。因此,將NCCXC5小于0.05(平均值±1.5標準差)設定為CXXC5基因在AML標本中低表達的閾值。
2.2 CXXC5基因在人類白血病細胞系和AML患者中的表達 在7種人類白血病細胞系中,只有K526和THP-1中有CXXC5的表達,分別為2.84和0.31,其余的5種細胞系都表現為CXXC5的低表達(0.00~0.01)。與對照組相比,CXXC5在96例AML患者中的表達顯著下調(0.00~1.16,平均值0.07,P<0.001)。44例AML患者(45.8%)中CXXC5基因表達下調。見表1。
2.3 CXXC5基因表達與AML患者臨床病理特征的相關性 CXXC5基因表達與FAB分型具有相關性,與M4/M5/M6亞型比較(13.6%),有更多的M1/M2/M3亞型患者中的CXXC5基因低表達(86.4%,P<0.01)。CXXC5基因低表達率在5/5qAML患者和其他核型患者組中差異無統計學意義(P>0.05)。另外,CXXC5的低表達與患者性別、年齡、血常規指標和細胞遺傳學風險均無相關性(P>0.05)。見表1。
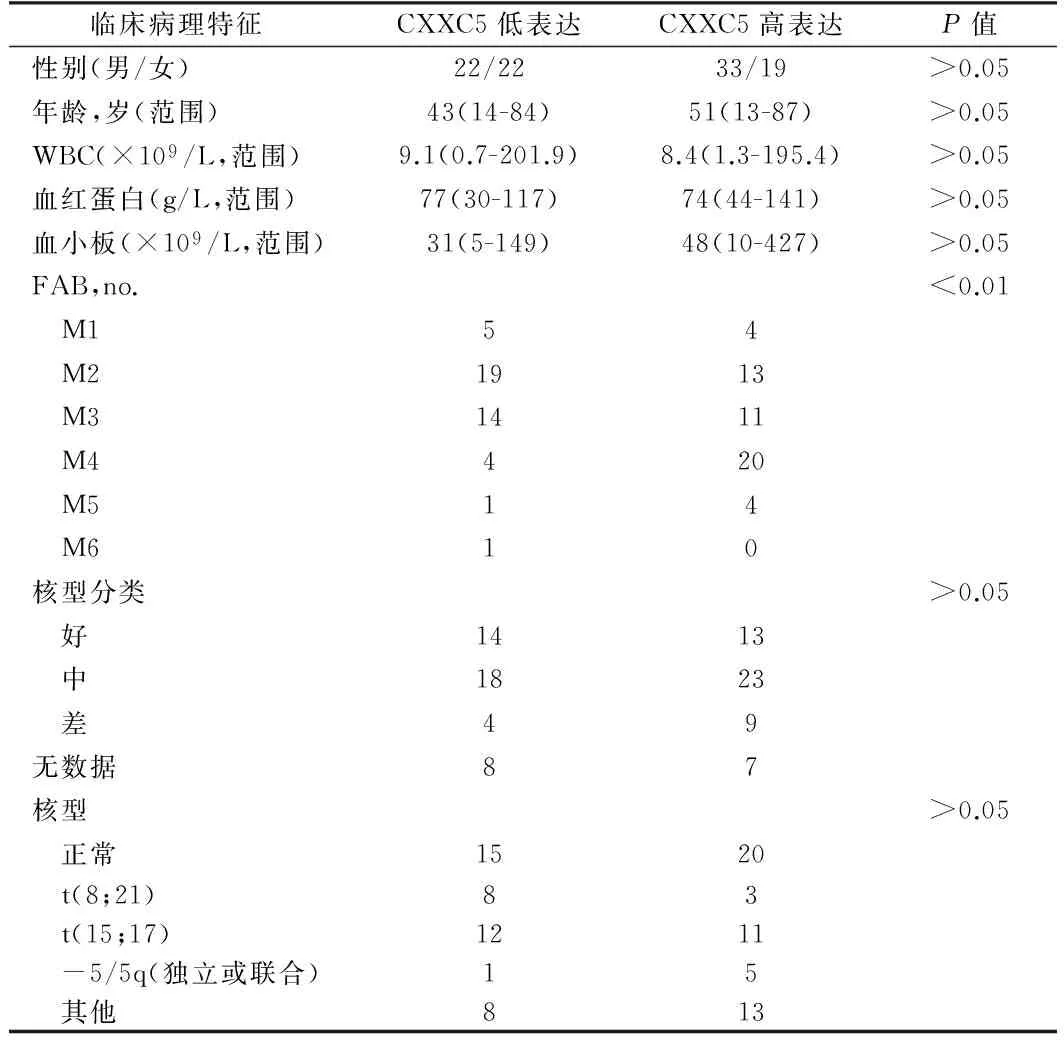
表1 CXXC5基因表達水平與AML患者臨床病理特征的相關性
2.4 CXXC5表達對患者預后的影響 我們對96例AML患者進行了平均11個月的隨訪(1~72個月)。結果有15.4%(8/52) CCXC5高表達的患者生存,而CXXC5低表達的患者有45.5%(20/44)存活。經統計分析,CXXC5低表達的AML患者的總生存期(OS)長于非低表達CXXC5的AML患者(P<0.01)。多變量分析顯示,CXXC5的表達水平、FAB亞型和細胞遺傳學風險都是獨立的預后影響因素。見表2、圖1。
3 討論
CXXC5基因定位于染色體5q31.2,染色體區域缺失可能與AML疾病有關。我們進行本實驗的目的就是為了探討該基因與AML的關系。研究表明,CCXC5基因在AML患者的人類白血病細胞中表達,但沒有發現突變的CCXC5基因編碼區,也沒有檢測到CCXC5 mRNA表達和FLT3-ITD或NPM1突變之間的關聯[10]。CCXC5基因在AML患者循環細胞中相對高水平表達,高CCXC5表達與不良預后和臨床化療敏感性相關。有人觀察了單核細胞分化和CCXC5基因表達之間的關聯,這類似于正常的造血功能中CXXC5表達也依賴于髓系細胞的分化狀態[11]。實驗中發現患者有低水平的不良細胞遺傳學異常,但考慮到非選擇性患者具有很高的中位數年齡,因此結果有待商榷。另外,研究中也沒能在任何患者中檢測到CXXC5基因的突變[11]。

表2 多變量分析影響AML患者總生存率的因素,HR,危險率(CI,可信區間)
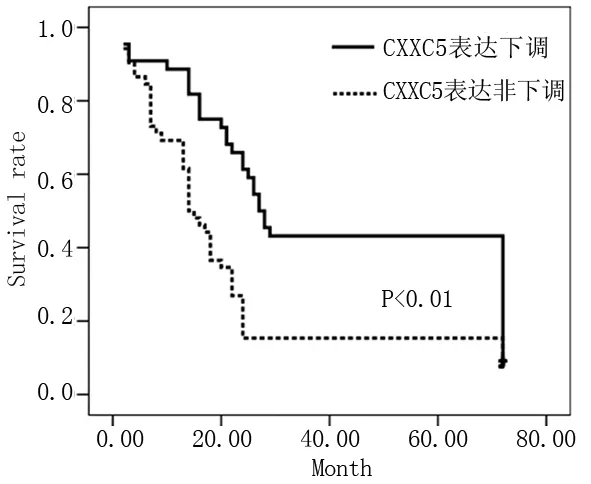
圖1 CXXC5表達與預后的關系
有實驗研究了接受五種不同強化化療的初治AML患者人群中CXXC5基因表達和總生存期之間的關系,對于這些比較年輕的患者,總生存期主要體現在臨床化療敏感性,即原發性耐藥和AML復發的頻率[12]。高CXXC5表達水平和不良預后之間的關聯在下面患者中都可見:(1)未經選擇的患者;(2)患者具有正常的細胞遺傳學特征;(3)基因異常是影響患者預后的核心因素。這些觀察結果都支持CXXC5高表達與不良預后相關的假說,,而類似的高表達與不良預后相關的結果也在乳腺癌患者中被觀察到[13]。
實驗數據顯示CCXC5介導了抗凋亡作用,可以作為治療高危白血病的靶點。用典型AML細胞系,不成熟髓系白血病細胞K562來研究CXXC5表達對化療藥物敏感性的影響。實驗表明,CXXC5基因敲除后增加了化療誘導的細胞凋亡的敏感性。這一結果提示,CXXC5表達是化療耐藥白血病細胞的表型。通過比較高和低CXXC5表達的患者AML細胞體外培養,兩個組表現出預期的自發性體外細胞凋亡。同時,在細胞培養液中加入目前用于白血病治療的藥物來那度胺[14],它常用于治療5q-異常和低CXXC5表達MDS患者[15]。結果證明細胞的存活是由自發的體外凋亡連同藥物誘導的細胞凋亡共同發揮作用的。在低CXXC5表達組中,在體外培養過程中最大量的減少了AML細胞存活率是通過單獨應激誘導凋亡達到的;而在高CXXC5表達組中,凋亡是由自發誘發和藥物誘導聯合引起的。上述結果都支持CXXC5是細胞凋亡重要的調控基因這一假設。
其他實驗模型的研究也表明,藥理學抑制人白血病細胞抗凋亡的細胞內信號傳導,可誘導細胞凋亡或增加化療的促凋亡效應[16],因此CXXC5/RINF的靶向治療可能是一種新的在人類白血病細胞中增加促凋亡活性和敏感性的策略。CXXC5/RINF沉默在AML細胞中的促凋亡活性的分子機制目前還不清楚。在神經細胞和腎臟發育的實驗結果表明,WT1基因通過下調WNT-β-cathenin信號通路誘導CXXC5基因表達[17]。WT1和CXXC5/RINF表達之間的相關性可能表明,在原發性AML細胞中這兩個分子之間發生了串擾。然而,WNT-β-cathenin通路可以在AML細胞中組成性激活,這種激活似乎介導了抗凋亡作用[18]。因此,CXXC5在AML細胞中的抗凋亡作用可能不是通過WNT-β-cathenin途徑,而是通過其他機制激活促凋亡信號而發揮作用。RINF也表達于正常造血細胞,因此血液學毒性是抑制CXXC5治療AML的一種可能性。CXXC5在正常骨髓細胞中表達不排除考慮其用于治療白血病的可能性。一些患者尤其是高危患者表現為較高的白血病細胞水平,另外,生存能力不是由單一因素,而是由促或抗凋亡信號之間的平衡決定的。這種平衡決定了在正常和白血病細胞之間CXXC5基因抑制的后果。另外,結合不同的細胞凋亡調節途徑,包括CXXC5靶向同時結合血液毒性學是一種很有前途的治療癌癥策略。
本實驗中,我們檢測了AML患者骨髓中CXXC5的表達,結果發現CXXC5低表達常見于AML中,并且在幾種AML細胞中也有低表達。CXXC5的低表達是AML預后良好的一種預測指標。但是,有關CXXC5在AML中的作用和機制都有待進一步研究。
1 Estey E,Dohner H.Acute myeloid leukaemia.Lancet,2006,368:1894-907.
2 Lane SW,Scadden DT,Gilliland DG.The leukemia stem cell niche: current concepts and therapeutic opportunities.Blood,2009,114:1150-1157.
3 Huntly BJ,Gilliland DG.Cancer biology: summing up cancer stem cells.Nature,2005,435:1169-1170.
4 Jordan CT,Guzman ML,Noble M.Cancer stem cells.N Engl J Med,2006,355:1253-1261.
5 James M.Foran.New Prognostic Markers in Acute Myeloid Leukemia: Perspective from the Clinic.Hematology,2010.47-55.
6 Scholl S,Fricke HJ,Sayer HG,et al.Clinical implications of molecular genetic aberrations in acute myeloid leukemia.J Cancer Res Clin Oncol,2009,135:491-505.
7 Pendino F,Nguyen E,Jonassen I,et al.Functional involvement of RINF,retinoid-inducible nuclear factor(CXXC5),in normal and tumoral human myelopoiesis.Blood,2009,113:3172-3181.
8 Boultwood J,Pellagatti A,McKenzie AN,et al.Advances in the 5q- syndrome.Blood,2010,116:5803-5811.
9 Dohner H,Estey EH,Amadori S,et al.Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel,on behalf of the European Leukemia Net.Blood,2010,115: 453-474.
10 張之南,沈悌主編.血液病診斷及療效標準.第3版.北京:科學出版社,2007.116-121.
11 Treppendahl MB,Mollgard L,Hellstrom-Lindberg E,et al.Downregulation but lack of promoter hypermethylation or somatic mutations of the potential tumor suppressor CXXC5 in MDS and AML with deletion 5q.Eur J Haematol,2013,90:259-260.
12 Dohner H,Estey EH,Amadori S,et al.Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel,on behalf of the European Leukemia Net.Blood,2010,115:453-474.
13 Knappskog S,Myklebust LM,Busch C,et al.RINF (CXXC5) is overexpressed in solid tumors and is an unfavorable prognostic factor in breast cancer.Ann Oncol,2011,22:2208-2215.
14 Reikvam H,Kittang AO,Melve G,et al.Targeted antileukemic therapy as disease-stabilizing treatment for acute myeloid leukemia relapse after allogeneic stem cell transplantation: Will it be possible to combine these strategies with retransplantation or donor lymphocyte infusions? Curr Cancer Drug Targets,2013,13: 30-47.
15 Durr D,Siciliano RD,Hummel Y,et al.Lenalidomide in 5q minus myelodysplastic syndrome: how long is enough? Ann Hematol,2010,89:105-106.
16 Herrmann H,Blatt K,Shi J,et al.Small-molecule inhibition of BRD4 as a new potent approach to eliminate leukemic stemand progenitor cells in acute myeloid leukemia AML.Oncotarget,2012,3:1588-1599.
17 Kim MS,Yoon SK,Bollig F,et al.A novel Wilms tumor 1 (WT1) target gene negatively regulates the WNT signaling pathway.J Biol Chem,2010,285:14585-14593.
18 Gregory MA,Phang TL,Neviani P,et al.Wnt/Ca2+/NFATsignaling maintains survival of Ph+ leukemia cells upon inhibition of Bcr-Abl.Cancer Cell,2010,18: 74-87.
CorrelationbetweentheexpressionlevelsofCXXC5geneandprognosisofpatientswithacutemyeloidleukemia
PANZhilan,YANGYan,ZHANGYongmei,etal.DepartmentofHematology,TheFirstHospitalofShijiazhuangCity,Shijiazhuang050011,China
ObjectiveTo investigate the expression levels of CXXC5 gene in patients with acute myeloid leukemia (AML),and to explore its correlation with clinical pathological characteristics.MethodsThe expression levels of CXXC5 in 96 patients with AML (AML group) and 19 cases of iron deficiency anemia as well as 5 cases of immune thrombocytopenia (control group) were detected by RQ-PCR.ResultsThe expression levels of CXXC5 gene in AML group were significantly decreased,as compared with those in control group (P<0.01).The low-expression of CXXC5 gene was found in 44 cases of AML (45.8%).The low-expression rate (86.4%) in AML patients with M1/M2/M3 subtype was significantly higher than that of AML patients with M4/M5/M6 subtype (13.6%,P<0.01).The overall survival (OS) time in AML patients with low-expression of CXXC5 was obviously longer than that of AML patients with non low-expression of CXXC5 (P<0.01).ConclusionThe low-expression of CXXC5 is a common and favorable event in patients with AML,which is favorable to prognosis of AML patients.
AML;CXXC5;prognosis;realtime quantitative PCR
10.3969/j.issn.1002-7386.2014.15.004
050011 河北省石家莊市第一醫院血液內科
R 733.712
A
1002-7386(2014)15-2253-04
2014-01-06)

