美金胺對大鼠腦缺血再灌注誘導學習記憶障礙的影響
陳 超,張奉超(江蘇省徐州市兒童醫院麻醉科,江蘇 徐州 221000)
·論著·
美金胺對大鼠腦缺血再灌注誘導學習記憶障礙的影響
陳 超,張奉超
(江蘇省徐州市兒童醫院麻醉科,江蘇 徐州 221000)
目的探討美金胺對大鼠全腦缺血/再灌注(global cerebral ischemia/reperfusion,I/R)誘導學習記憶障礙的影響。方法通過4動脈結扎建立大鼠全腦缺血模型,在缺血后連續5d腹腔注射美金胺,采用Morris水迷宮進行行為學測定,通過焦油紫染色觀察海馬神經元的存活情況。結果與生理鹽水對照組比較,假手術組和美金胺組逃逸潛伏期明顯縮短(P<0.01);I/R組逃逸潛伏期明顯長于假手術組和美金胺組(P<0.01),與生理鹽水對照組差異無統計學意義(P>0.05);與生理鹽水對照組比較,假手術組和美金胺組穿越平臺時間、在原西北象限游泳的百分比和海馬CA1區神經細胞數明顯增多(P<0.01),而I/R組穿越平臺時間、在原象限游泳的百分比和海馬區神經細胞較假手術組和美金胺組明顯減少(P<0.01),但仍與生理鹽水對照組比較差異無統計學意義(P>0.05)。結論美金胺可以改善大鼠全腦缺血再灌注所致的學習記憶障礙,該作用可能通過減輕缺血性神經元損傷實現。
缺血再灌注損傷;大鼠;神經元;記憶障礙
急性缺血性卒中后很多患者遺留學習記憶障礙[1]。腦缺血低氧所致血管性癡呆嚴重危害著人類的生命健康,已經成為現代老年人的重要疾病。美金胺作為改善學習記憶的藥物用于治療老年癡呆已經進入臨床試驗階段,但美金胺對缺血性腦損傷造成的學習記憶障礙的作用尚無報道。本實驗在大鼠全腦缺血/再灌注模型中,觀察了注射美金胺后大鼠學習記憶的改變以及海馬神經元數目的變化,并分析了其可能的作用機制。報告如下。
1 材料與方法
1.1 動物和試劑:健康雄性SD大鼠,每只250~300g,共64只,由中科院上海實驗動物中心提供。行為學檢測每組10只,形態學分析每組6只。美金胺購于美國Sigma公司,生理鹽水購于徐州市中心醫院。
1.2SD大鼠腦缺血模型的建立:除了假手術組之外,其他組大鼠按Pulsinelli為大鼠建立4動脈結扎模型[2]。實驗動物隨機分為假手術(sham)組、缺血再灌注(ishemia-reperfusion,I/R)組、生理鹽水對照(saline)組和美金胺(memantine)組,每組16只。實驗動物使用20%濃度的水合氯醛(300~350mg/kg)腹腔注射使其麻醉,分離雙側頸總動脈并實施椎動脈電凝術。術后12h,在動物處于清醒狀態下,結扎雙側頸總動脈,造成全腦缺血15min,然后復灌5d。以缺血動物體征及表現作為判斷依據,評價SD大鼠腦缺血模型的可靠性。假手術組16只處理同實驗組,但雙側頸總動脈不結扎。
1.3 給藥:美金胺溶解于生理鹽水中,I/R組缺血后以10mg/kg的劑量立刻腹腔注射美金胺,1次/d,共5d。Saline組腹腔注射相同體積的生理鹽水。Sham組不給藥,只給生理鹽水。
1.4 大鼠行為學檢測:于晚上注射完美金胺或者生理鹽水第2天進行行為學檢測。Morris水迷宮的主體部分是一個內含站臺的圓形主水池,水池高55cm,直徑1m。圓形主水池分為西北(northwest,NW)、東北(northeast,NE)、東南(southeast,SE)、西南(southwest,SW)4個象限,在NW象限正中放置一個直徑為10cm、高38cm的圓形透明平臺,平臺距離水池壁20cm,在主水池中注入清水,使水面高于透明平臺2cm,往水池中加入墨水,直至透明平臺不可見為止。將圓形主池置于光照良好的實驗室內,保持水溫在(23.0±0.5)℃,保持訓練期間水迷宮外的參考物不變。實驗分為定位航行實驗和空間探索實驗。定位航行實驗為實驗前1d下午將大鼠放入水中自由游泳2min,以熟悉實驗環境。歷時4d,每天在不同象限各訓練1次(Trial),每次訓練的入水點隨機選擇,但是所有大鼠需要在同一個入水點入水,且放入大鼠時需將老鼠面向水池壁,記錄大鼠找到平臺的時間,該時間即為逃逸潛伏期。如大鼠超過120s仍找不到平臺,即引導其爬上平臺,并將該次實驗的逃逸潛伏期記為120s。每次實驗中無論是自主爬上平臺的還是被引導登上平臺的大鼠,均讓其在平臺上休息60s。將每只大鼠4次/d逃逸潛伏期的算術平均值作為該大鼠這一天的學習成績記錄下來。空間探索實驗為訓練完畢第2天拆臺,記錄原平臺象限即NW象限探索實踐占總時間(120s)的百分比和120s內大鼠穿過原平臺的次數。
1.5 組織學方法:于復灌第5天,先注射水合氯醛將大鼠麻醉,然后開左胸暴露心臟,針頭插入主動脈需自心尖穿過左心室,用生理鹽水和4%多聚甲醛進行刑事灌注。將灌注后的大鼠斷頭取腦,對取出的腦組織用4%的多聚甲醛固定12h左右。使用梯度乙醇對腦塊進行脫水,并于二甲苯中透明,浸蠟后包埋。包臘后腦塊切片,厚5μm,經脫蠟,脫二甲苯,于0.1%焦油紫染色。梯度酒精脫水,二甲苯透明,中性樹脂封片后,光鏡觀察。
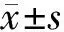
2 結 果
2.1 美金胺對腦缺血再灌注大鼠學習記憶的影響:行為學測定前1d下午,將各組大鼠放入水中自由游泳2min,使其熟悉實驗環境并觀察其游泳姿勢。所有大鼠在圓形主水池中積極探索,游泳姿勢無異常。與Saline組比較,假手術組和美金胺組逃逸潛伏期明顯縮短(P<0.01);I/R組逃逸潛伏期明顯長于假手術組和美金胺組(P<0.01),與Saline組差異已無統計學意義(P>0.05);與Saline組比較,假手術組和美金胺組在穿越平臺時間、原NW象限游泳的百分比和海馬CA1區神經細胞數明顯增多(P<0.01),而I/R組穿越平臺時間、在原象限游泳的百分比和海馬區神經細胞較假手術組和美金胺組明顯減少(P<0.01),與Saline組差異已無統計學意義(P>0.05)。見表1。


GroupsEscapelatency(s)Timeofcrossingplatform(s)PercentageofswimminginNW(%)NumberofneuronalcellinhippocamalCA1region(n)Saline110.28±10.245.42±1.7518.62±4.7645.42±6.76Sham70.35±9.21?15.36±1.98?56.37±5.28?238.69±10.35?Memantine88.64±8.15?9.45±1.69?42.56±3.70?#178.25±8.98?#I/R117.38±7.75#△5.96±1.26#△19.32±3.36#△56.91±8.26#△ F58.83373.164327.3231177.259 P0.0000.0000.0000.000
*P<0.01vssaline group #P<0.01vssham group △P<0.01vsmemantine group byqtest
2.2 形態學觀察:假手術組椎體細胞3~4層,排列整齊緊密,細胞核大而圓,核仁清晰,尼氏體染色濃密規則(圖1A);I/R組椎體細胞排列雜亂、部分缺失,大多數椎體細胞變性,胞核固縮,呈三角形,結構不清,尼氏體減少,染色變淡,胞漿嗜酸性變(圖1B);美金胺組椎體細胞2~3層,排列較整齊緊密,細胞核較大而圓,核仁清晰,尼氏體染色較濃密規則,僅有少量細胞出現胞核固縮,呈三角形,尼氏體減少,染色變淡,胞漿嗜酸性變( 圖1C);Saline組椎體細胞改變與I/R組相似,細胞排列雜亂、部分缺失,大多數椎體細胞變性,胞核固縮,呈三角形,結構不清,尼氏體減少,染色變淡,胞漿嗜酸性變(圖1D)。

圖1 美金胺對缺血/再灌注神經元的保護作用(×400)
A.假手術組;B.I/R組;C.美金胺組;D.生理鹽水對照組
Figure 2 Neuroprotective effect of on cerebral ischemia/ reperfusion(×400)
A.Sham group;B.I/R group;C.Memantine group;D.Saline group
3 討 論
海馬是邊緣系統的重要組成部分,其神經元作為感覺整合中樞可以接收和處理大量信息,并通過與其他腦區以往已有的儲存信息核對后形成記憶。急性缺血性卒中后很多患者遺留學習記憶障礙[1]。有實驗研究[2-3]表明,腦缺血再灌注可導致成年大鼠的學習和記憶能力受損,其機制可能與損傷所致的海馬神經元丟失有關。Morris水迷宮是用來測定大鼠的定位航行和空間搜索能力的測量精度較好的方法,可用來研究大鼠的學習記憶能力[4-5]。本實驗結果發現腦缺血/再灌注后,大鼠的學習記憶能力受到損害,同時焦油紫染色顯示海馬CA1區神經元的丟失程度與學習記憶的下降一致。表明海馬CA1區神經元的丟失在腦缺血/再灌注模型大鼠認知功能下降中發揮重要作用。
腦缺血/再灌注過程中,谷氨酸興奮毒性發揮著重要的作用,缺血/再灌注引起的神經元凋亡及死亡主要是由谷氨酸受體中的N-甲基-D-天冬氨酸受體(N-methyl-D-aspartic acid receptor,NMDA)的過度激活介導的[6]。谷氨酸是中樞神經系統的主要興奮性神經遞質之一,生理條件下,作為正常的神經遞質,在神經元之間信息傳遞中發揮重要作用,所以,NMDA受體發揮著生理和病理的作用,既有利于神經元正常功能的發揮,而過度激活時又會導致神經元的病理改變。腦缺血會導致海馬神經元受損,出現不同程度神經元損傷:缺血狀態下海馬CA1區椎體細胞層出現排列紊亂,細胞體積縮小、胞漿皺縮;嗜酸性增強、胞核固縮,核染色呈藍紫色致密球狀,嚴重固縮呈嗜酸性深紫色神經元。研究發現,在獲得新信息方面海馬結構完整性對于學習記憶至關重要,CA1區遲發性神經元死亡會引起嚴重學習記憶障礙。
美金胺是一種中等親和力、開放性、非競爭性的通道阻滯劑。一定濃度的美金胺,可以優先抑制NMDA受體的過度活化,卻不影響正常的受體活性[7]。當受體離子通道過度開放時,美金胺雖然優先進入通道,但是由于解離速率快,不會持續積聚在通道上而對突觸的正常傳遞產生干擾,所以相對安全[8]。同時,體外培養幼鼠大腦皮層神經元中,美金胺拮抗NMDA所引起的神經元損傷作用[9]。本實驗結果也顯示美金胺明顯減少了再灌注5d后海馬CA1區神經元的死亡,改善了腦缺血/再灌注誘導的學習和認知功能障礙。但美金胺改善腦缺血誘導的學習認知功能是否與保護了缺血性神經元有關,以及保護神經元損傷的具體機制還有待于進一步研究。
[1] WOLLENWEBER FA,ZIETEMANN V,ROMINGER A,et al.The Determinants of Dementia After Stroke(DEDEMAS) Study:protocol and pilot data[J].Int J Stroke,2014,9(11):387-392.
[3] ZHAO Y,YU B,XIANG YH,et al.Changes in retinal morphology,electroretinogram and visual behavior after transient global ischemia in adult rats[J].PLoS One,2013,8(6):e65555.
[3] LI M,PENG J,WANG MD,et al.Passive movement improves the learning and memory function of rats with cerebralinfarction by inhibiting neuron cell apoptosis[J].Mol Neurobiol,2014,49(1):216-221.
[4] WU YY,WU WY,GONG HL,et al.Astragalosides attenuate learning and memory impairment in rats following ischemia?reperfusion injury[J].Mol Med Rep,2014,9(4):1319-1324.
[5] LIN Y,YAO J,CHEN Y,et al.Hippocampal neurochemical changes in senescent mice induced with chronic injection of D-galactose and NaNO2:an in vitro high-resolution NMR spectroscopy study at 9.4T[J].PLoS One,2014,9(2):e88562.
[6] BORGENS RB,LIU-SNYDER P.Understanding secondary injury[J].Q Rev Biol,2012,87(2):89-127.
[7] KUTAING MK,LUO V,FIRESTEIN BL.Protection from glutamate-induced excitotoxicity by memantine[J].Ann Biomed Eng,2012,40(5):1170-1181.
[8] KAROLCZAK D,SAWICKA E,DORSZEWSKA J,et al.Memantine-neuroprotective drug in aging brain[J].Pol J Pathol,2013,64(3):196-203.
[9] LOPES JP,TAROZZO G,REGGIANI A,et al.Galantamine potentiates the neuroprotective effect of memantine against NMDA-induced excitotoxicity[J].Brain Behav,2013,3(2):67-74.
(本文編輯:許卓文)
EFFECTOFMEMANTINEONLEARNINGANDMEMORYDISORDERINDUCEDBYCEREBRALISCHEMIA/REPERFUSIONINJURYOFRATS
CHENChao,ZHANGFengchao
(DepartmentofAnesthesiology,XuzhouChildren′sHospital,JiangsuProvince,Xuzhou221000,China)
ObjectiveToinvestigatetheeffectofmemantineonlearningandmemorydisorderinducedbycerebralischemia/reperfusion(I/R)ofrats.MethodsModelofcerebralischemiawasestablishedbythefour-vesselocclusionmethod.Memantinewasintraperitoneallyinjectedforfivedaysaftertheischemia.CresylvioletstainingwasusedtoobservethesurvivalneuronsinpyramidalcelllayerofthehippocamalCA1regionandMorriswatermazetestwasperformed.ResultsComparedwiththoseofsalinecontrolgroup,theescapelatencyoftheorientationnavigationexperimentinshamgroupandmemantinegroupwassignificantlyshortened(P<0.01);theescapelatencyofI/Rgroupwassignificantlylongerthanthatofshamgroupandmemantinegroup(P<0.01),buttheescapelatencyofI/Rgrouphadnosignificantdifferencecomparedwiththatsalinecontrolgroup(P>0.05);Comparedwiththoseofcontrolgroup,thecrossingplatformtime,timepercentofswimminginnorthwestandneuronalcelllossinhippocamalCA1regioninshamgroupandmemantinegroupsignificantlyraised(P<0.01),butthethreeitemsofI/Rgroupsignificantlyreducedincomparisonwiththeabovetwogroups(P<0.01),whiletheystillhadnosignificantdifferencescomparedwiththoseofsalinegroup(P>0.05).ConclusionMemantinecanimprovethelearningandmemorydisorderinducedbycerebralischemia/reperfusioninratsthroughdecreasingneuronalcelldeath.
reperfusioninjury;rats;neurons;memorydisordes
2014-01-08;
2014-03-12
陳超(1962-),男,江蘇徐州人,江蘇省徐州市兒童醫院主任醫師,醫學學士,從事臨床麻醉學研究。
R619.9
A
1007-3205(2014)10-1296-04
10.3969/j.issn.1007-3205.2014.11.016

