彌漫性大B細胞淋巴瘤組織中NF-κB p65、P-gp、CYP3A4表達變化及意義
朱 斌,潘韶英,趙 紅,丁志勇
(上海市第六人民醫院南院奉賢區中心醫院,上海 201499)
彌漫性大B細胞淋巴瘤(DLBCL)是一種最常見的非霍奇金淋巴瘤(NHL),其侵襲性強,病理特征具有高度異質性[1,2]。據統計,約 40%的 DLBCL患者可通過聯合化療實現完全緩解,但仍有>50%的患者對化療反應較差,尤其是因多藥耐藥(MDR)導致復發轉移或進展,預后不佳[3]。MDR發生機制較為復雜,學者認為其主要與腫瘤細胞過度表達核轉錄因子-κB(NF-κB)、P-糖蛋白(P-gp)、細胞色素P4503A4(CYP3A4)等耐藥相關基因及蛋白有關[4]。本研究觀察了 DLBCL 組織中 NF-κB p65、P-gp、CYP3A4的表達變化,并探討其臨床意義。
1 資料與方法
1.1 臨床資料 選擇上海市奉賢區中心醫院病理科2007年1月~2011年12月86例結內病變的DLBCL組織樣本,臨床資料齊全,獲得隨訪。患者均經手術及組織病理學確診,術前均未接受任何放射治療或化學治療。其中男49例,女37例;年齡25~76歲,中位年齡57歲。組織分型:中心母細胞變異型37例、免疫母細胞變異型29例,間變型20例。按照Ann Arbor分期標準,Ⅰ、Ⅱ期53例,Ⅲ、Ⅳ期33例。預后相關的淋巴瘤國際預后指數(IPI)[5]低危(0~2)49例,高危(3~5)37 例。選擇同期我院手術切除的性別、年齡相匹配的30例反應增生性淋巴結患者的組織標本作為對照。
1.2 方法
1.2.1 檢測方法 采用免疫組化SP法。將標本用10%甲醛固定、石蠟包埋,制成4 μm厚切片;常規脫蠟、水化、0.01 mol/L枸櫞酸鹽緩沖液(pH 6.0)抗原熱修復。兔抗人NF-κB p65單克隆抗體、鼠抗人CYP3A4單克隆抗體、鼠抗人P-gp單克隆抗體及SP免疫組化試劑盒均購自福州邁新生物科技有限公司,采用試劑盒已知陽性組織作為陽性對照,以PBS代替一抗體作為陰性對照。NF-κB p65、P-gp、CYP3A4的判定標準:隨機選擇10個高倍鏡視野(×400)計數1000個腫瘤細胞,腫瘤細胞胞質內呈棕黃色顆粒為陽性細胞。采用許良中等[6]的計分方法對陽性細胞百分數及染色程度進行計分,兩項積分乘積≥2為陽性。
1.2.2 隨訪方法 對所有患者通過門診或電話形式進行隨訪,隨訪日期從患者出院日期截至2013年12月30日或至患者死亡。隨訪內容包括患者的一般狀況、生活質量及近期復查情況。
1.2.3 統計學方法 采用 SAS8.2統計軟件。計數資料比較采用χ2檢驗,采用Spearman秩相關進行相關性分析。P≤0.05為差異有統計學意義。
2 結果
2.1 NF-κB p65、P-gp、CYP3A4 表達比較 DLBCL組織中 NF-κB p65、P-gp、CYP3A4陽性表達率分別為 62.8%、57.0%、33.7%,淋巴增生組織中分別為23.3%、20.0%、13.3%,P 均 <0.05。
2.2 DLBCL 組織中 NF-κB p65、P-gp、CYP3A4 表達與臨床病理參數的關系 DLBCL組織中NF-κB p65表達與IPI、臨床分期有關(P均<0.05),P-gp表達與結外病灶數、臨床分期有關(P均 <0.05),CYP3A4表達與IPI、臨床分期有關(P均<0.05)。見表1。
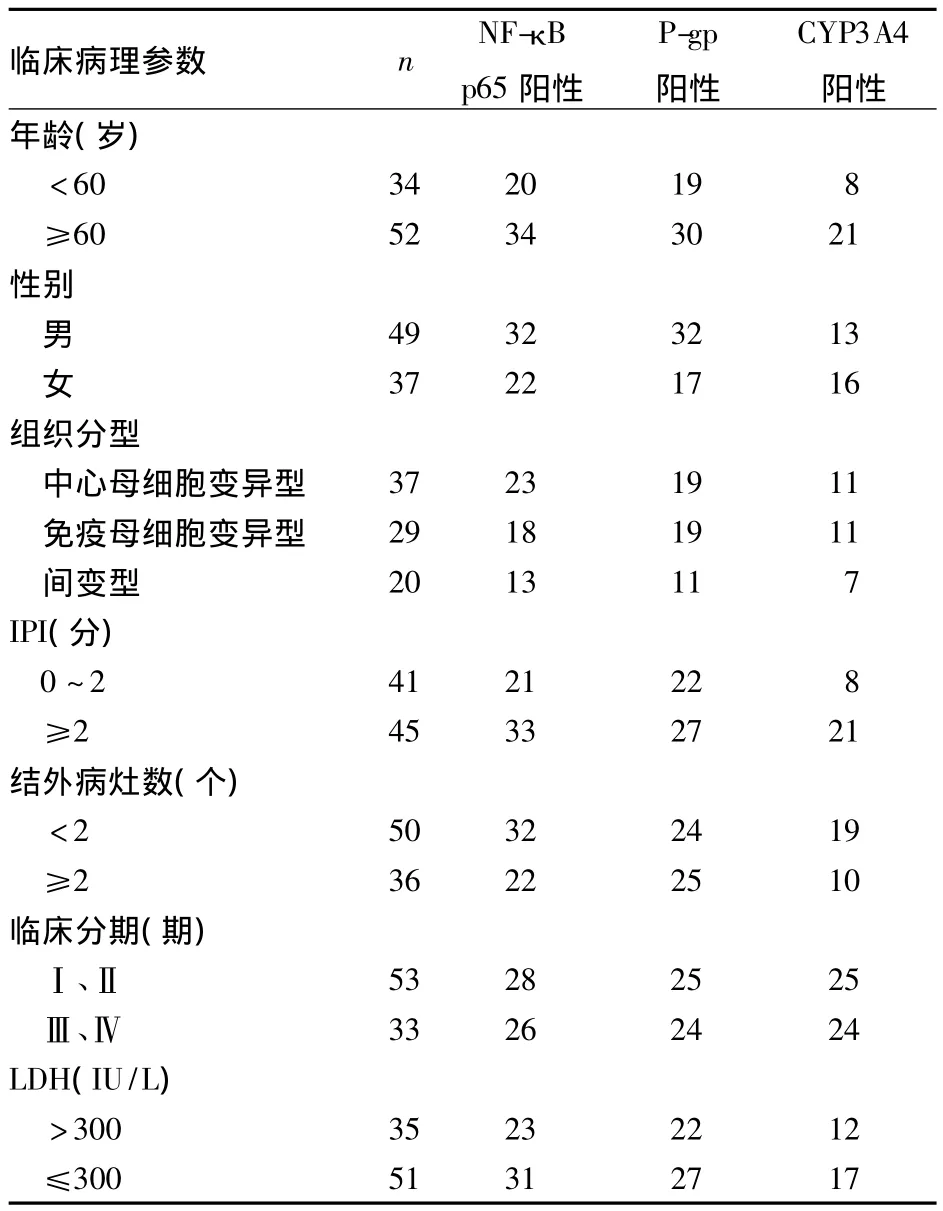
表1 DLBCL 組織中 NF-κB p65、P-gp、CYP3A4 表達與臨床病理參數的關系(例)
2.3 DLBCL 組織中 NF-κB p65、P-gp、CYP3A4 表達的關系 DLBCL組織中 NF-κB p65與 P-gp、CYP3A4 表達呈顯著正相關(r=0.593、0.452,P 均<0.05),P-gp、CYP3A4 表達之間無顯著相關性(r=0.155,P >0.05)。
2.4 NF-κB p65、P-gp、CYP3A4 表達與患者生存時間的關系 隨訪20~60個月,平均40個月。NF-κB p65、P-gp、CYP3A4陽性表達者2年總生存率分別為25.0%、36.7%、31.0%,均顯著低于陰性表達者的68.8%、64.9%、68.4%,P 均 <0.05。
3 討論
目前,DLBCL的發病機制尚不完全清楚,但普遍認為DLBCL的發生、發展是多步驟、異質性的過程,涉及多種遺傳信息的異常,從而誘發各種信號通路的失活或異常激活,引起細胞周期、增殖、分化及凋亡的異常,最終促進DLBCL的發生與發展[7]。現已明確,誘導腫瘤細胞凋亡而發揮作用是抗癌藥物的重要機制,而NF-κB是目前認為與細胞凋亡密切相關的生物因子,其中活化的NF-κB是腫瘤細胞發生、進展及耐藥的關鍵因素[8,9]。但多種基因、信號途徑和調控機制的參與使得單一基因或分子無法準確反映腫瘤細胞的異質性[10]。
本研究結果顯示,DLBCL組織中NF-κB p65、P-gp及CYP3A4陽性表達率均高于淋巴增生組織,且其陽性率隨DLBCL臨床分期的增高而增高,提示這3個指標對于判斷DLBCL的惡性程度、浸潤及轉移具有一定價值。本研究未發現NF-κB p65與結外病灶數相關,可能與DLBCL的異質性有關,也可能與本研究樣本量較少有關。相關分析發現,DLBCL組織NF-κB p65、P-gp表達呈正相關,說明二者存在一定協同作用,共同參與腫瘤耐藥的產生。Bentires-Alj等[11]研究指出,NF-κB 作為一種重要的 NF,調控MDR1等諸多基因的表達;抑制人結直腸腺癌HCT-15細胞中NF-κB的表達,可有效減少MDR1 mRNA、P-gP 表達。本研究中,NF-κB p65、CYP3A4表達呈正相關。大量研究證實,P-gp與CYP3A4存在廣泛底物重疊,現已發現皮質醇、秋水仙堿、環孢素、尼卡地平、維拉帕米、依托泊苷、紫杉醇等均為P-gp和CYP3A4的共同底物。當藥物排出減少時,細胞內藥物蓄積引起CYP3A4酶的競爭性抑制,或P-gp抑制劑本身即為CYP3A4抑制劑。本研究未發現 P-gp與 CYP3A4的表達相關,與 Masahiko等[12]研究結果一致,可能與樣本量較少有關。
目前認為,DLBCL預后與諸多因素有關,IPI被視為指導臨床治療及預后評估的重要參考指標,但因其所能反映的并非疾病的本質,且由于DLBCL是一種高度異質性的疾病,不同的病理亞型、發病機制也不相同,導致即使IPI相同的患者亦可造成截然不同的結局。因此,在IPI的基礎上,與一些分子預后指標相結合,探索并建立一個高效的預后評價模式,為個體化治療提供更多的理論基礎,對于指導DLBCL治療有極高的價值。隨訪發現,NF-κB p65、P-gp、CYP3A4陽性表達者2年總生存率均顯著低于陰性表達者,說明三者陽性表達對DLBCL疾病過程具有負面作用,反之,陰性者具有生存優勢。
綜上所述,DLBCL組織中 NF-κB p65、P-gp和CYP3A4高表達,其一定程度上反映了DLBCL的生物學異質性、臨床分期及對治療的反應,可能成為抑制DLBCL生長、轉移的生物靶點。
[1]Rossi D,Gaidano G.Molecular heterogeneity of diffuse large B-cell lymphoma:implications for disease management and prognosis[J].Hematology,2002,7(4):239-252.
[2]Seerdlow SH,Campo E,Harris NL,et al.World health organization classification of tumors.WHO classification of tumors of hematopoietic and lymphoid tissues[M].Lyon:IARC Press,2008:112-134.
[3]Ding ZY,Yang L,Xie XD,et al.Expression and significance of hypoxia-inducible factor-1 alpha and MDR1/P-glycoprotein in human colon carcinoma tissue and cells[J].J Cancer Res Clin Oncol,2010,136(11):1697-1707.
[4]Valera ET,Scrideli CA,Queiroz RGP,et al.MDR-1,MRP,LRP expression in childhood acute lymphomablasticleukemia[J].Sao Paulo Med J,2004,122(4):166-171.
[5]Finn WG,Kroft SH.New classifications for non-Hodgkin's lymphoma[J].Cancer Treat Res,1999(99):1-26.
[6]許良中,楊文濤.免疫組化反應結果的判定[J].中國癌癥雜志,1996,6(4):229-231.
[7]青曉艷,姚文秀,徐義全.彌漫大B細胞淋巴瘤的研究現狀及展望[J].中華臨床醫師雜志(電子版),2012,6(4):983-985.
[8]Karin M,Cao Y,Greten FR,et al.NF-kappa B in cancer:from innocent bystander to major culprit[J].Nat Rev Cancer,2002,2(4):301-310.
[9]郭琰,顧康生.侵襲性T細胞非霍奇金淋巴瘤的耐藥機制[J].國際腫瘤學雜志,2011,38(9):707-709.
[10]Baud V,Karin M.Is NF-κB a good target for cancer therapy Hopes and pitfalls[J].Nat Rev Drug Discov,2009,8(1):33-40.
[11]Bentires-Alj M,Barbu V,Fillet M,et al.NF-kappa B transcription factor induces drug resistance through MDR1 expression in cancer cells[J].Oncogene,2003,22(1):90-97.
[12]Masahiko O,Yoshihiro I,Hiroko F,et al.Immunohistochemical expression of multidrug resistance proteins as a predictor of poor response to chemotherapy and prognosis in patients with nodal diffuse large B-cell lymphoma[J].Oncology,2005,68(4-6):422.

