重組大腸桿菌E.coli his 3.1乙酸代謝分析
劉曉莉LIU Xiao-li
(延安大學化學與化工學院,延安716000)
0 引言
膠原蛋白是哺乳動物中含量十分豐富的一種蛋白,它的類型、質量以及分布的改變直接影響著動物體正常的機能,具有非常重要的生物學機能,也是非常重要的蛋白質。
膠原蛋白由于其良好的生物相容性和弱抗原性而可廣泛使用于醫藥、醫用材料及美容化妝品行業[1]。目前所用的動物源膠原蛋白具有病毒隱患及理化性能差的缺點。本文主要研究如何將人源性膠原蛋白的mRNA逆轉錄生成cDNA,再經過酶切并修飾后進行特定序列重復,轉導于大腸桿菌內,經過高密度發酵,使外源基因大量表達,從而得到水溶性的類人膠原蛋白(human-like collagen)。類人膠原蛋白不僅具有膠原蛋白原有的功效,而且經修飾后的三重復螺旋結構賦予其在分子量不變的條件下優于天然膠原蛋白的獨特的化學結構和更新的功能,如可逆成膠性、無病毒隱患、可加工性、低免疫排異性、水溶性等性質,消除了從動物身上提取的膠原蛋白的缺陷,大大拓展了其用途。
利用重組大腸桿菌E.coli his 3.1表達重組蛋白質,代謝副產物乙酸積累的量對菌體生長、目標產物的表達都有較大的影響。隨著乙酸積累達到一定程度,菌體的生長和產物合成會逐漸停止。乙酸對細胞生長代謝的抑制機理現在比較公認的為:乙酸在中性pH環境中以離子化(CH3COO-)和質子化(CH3COOH)兩種形式存在,質子化的乙酸具有弱的親脂性,可以穿過細胞質膜進入胞內,在胞內(pH 7.5)解離成CH3COO-和H+,這樣就降低了膜內pH值,使膜內外pH差減小,減弱了質子推動力,產生的能量大大減少,擾亂了細胞的正常代謝和生理活性[5]。
乙酸的產生與細胞中的電子傳遞鏈和三羧酸循環有關。已知的大腸桿菌產生乙酸途徑有兩條,一是在丙酮酸氧化酶的作用下由丙酮酸直接生成乙酸。二是在乙酸激酶(ACK)和磷酸轉乙酰基酶(PTA)作用下由乙酰CoA生成乙酸。前者由于丙酮酸氧化酶在大腸桿菌中活性較低,不足以產生大量乙酸,因此后一條途徑就成為乙酸產生的主要途徑[4]。
當碳氮比過高時,就會造成碳代謝流在糖酵解途徑中的過量,細胞為了平衡碳代謝流,就要釋放出部分代謝副產物,而乙酸就是其中的主要副產物。
在低水平溶氧條件下,細胞由于攝氧量不足以滿足其好氧呼吸而轉向厭氧代謝,產生乙酸等小分子有機酸。
另外,在比生長速率過高條件下,大腸桿菌通過氧化代謝作用產生的能量不足以滿足合成和異化的需求,必須通過乙酸生成途徑獲得ATP和NADPH2。細胞在生成一分子乙酸同時,也會生成一分子ATP,這就成了乙酸產生的優勢所在。
本實驗主要研究大腸桿菌生產類人膠原蛋白在補料—分批培養下乙酸的產生規律以及乙酸對類人膠原蛋白產量的影響,并對其進行優化。
1 實驗部分
1.1 材料與方法
1.1.1 菌株與質粒 基因工程菌E.coli his 3.1,卡那抗性,溫度誘導,質粒pNWCP31。
1.1.2 種子培養基 種子培養基用固體LB培養基和液體LB培養基。從LB平板上分別刮取兩個單菌落,分別置于兩個盛有50mL種子培養基的300mL的搖瓶中,在溫度為32°C,轉速為200rpm的搖床中培養10~12h,然后將此種子轉接于八個盛有50mL種子培養基的300mL的搖瓶中,在相同的條件下培養10~12h。
1.1.3 分批-補料培養 將已經培養好的種子接種到裝有6L發酵培養基的12.8L發酵罐中,控制溫度在34°C。在分批-補料培養階段,通過調節空氣流量、提高攪拌轉速和罐壓控制DO在20%空氣飽和度,用25%氨水(w/w)自動調節pH值為6.8。當發酵罐中的葡萄糖耗盡時,采用近指數補料法控制比生長速率[7]。當OD600達到90~100時,升溫至42°C開始誘導,兩小時后降溫至39°C,繼續誘導6~8h。
發酵培養基和補料培養基成分見表1。
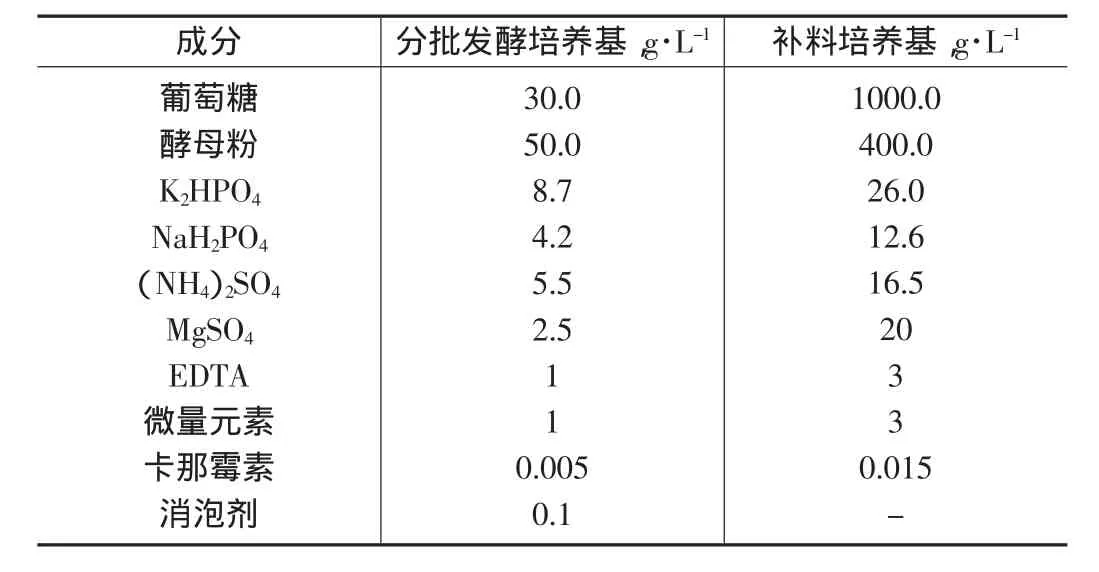
表1 培養基的組成
1.1.4 主要試劑 酵母提取物為Oxoid公司生產;卡納霉素為Siga公司生產;其它為國產分析純試劑。
1.2 分析方法
1.2.1 乙酸含量(HPLC法)
1.2.1.1 HPLC系統 高效液相色譜儀Shim-pack VP-ODS,色譜柱(150mm×4.6mm),紫外檢測波長 210nm,流速1ml/min,進樣5μl,流動相,乙腈:磷酸鹽緩沖液(pH2.6)=3.5:96.5,A相為超純水,B相為色譜純的甲醇。
1.2.1.2 流動相的選擇依據 決定流動相的pH值的主要成分是被分離的有機酸pKa值乙酸的解離常數是4.76,柱子的pH值的最小下限是2,在流動相是酸性環境中,如果允許乙酸有1%的離子狀態存在,則可預測流動相的pH值:
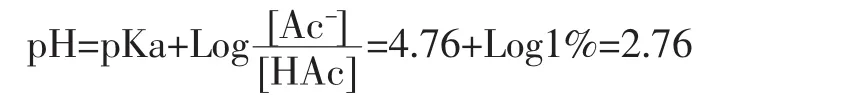
即流動相的pH值應該是pH2~2.76之間,我們選定pH值為2.6,用磷酸鹽作為緩沖液。
1.2.1.3 流動相的配制
①溶液A:用磷酸鹽緩沖液(H3PO4+KH2PO4)將超純水調節pH至2.6。
②流動相:乙腈:溶液A=3.5:96.5。
③將配好的流動相置于溶劑過濾器中過濾,然后在超聲波清洗器下進行超氣。
1.2.1.4 樣品預處理
①取1ml發酵液10,000r/min離心5min;
②取上清 0.5ml,加入 0.3gNaCl,0.10mL 2.3mol/L H2SO4,2.50mL 乙醚,在振蕩器上混合 1mim,5,000r/min 離心3min;
③取乙醚相1.00mL,加0.20mL 0.1mol/LNaCl混合1min,5,000r/min離心3min,吸去上層乙醚,用試紙測試pH>9(在酸性條件下,用乙醚萃取,將有機酸以分子形式萃取到乙醚相中,再在pH>9的條件下反萃取到水相中,可大大去除其他物質的干擾),開蓋揮發乙醚相后,置干燥器內干燥;
④加入0.40mL 0.05mol/L(NH4)H2PO4(pH2.6)溶解,10,000r/min 離心 10min;
⑤取5μl進樣分析。
1.2.1.5 保留時間的確定 選取發酵液中可能產生的有機酸如甲酸,琥珀酸,乙酸,檸檬酸,酒石酸,各取2%標準溶液進樣分析,測定各有機酸的保留時間分別為:甲酸1.99min,琥珀酸 2.215min,乙酸 2.880min,檸檬酸 3.011min,酒石酸 3.751min。
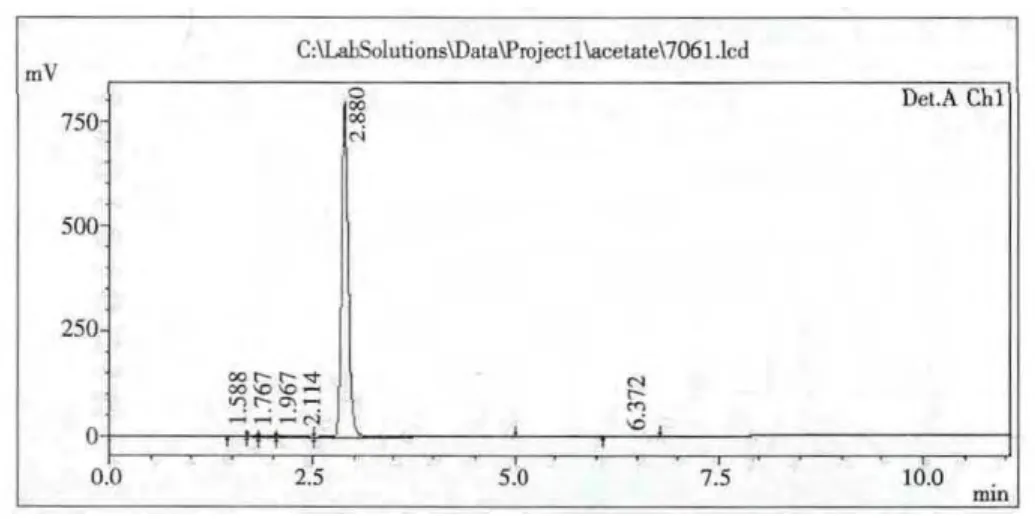
圖1 標準乙酸色譜圖
1.2.1.6 乙酸標準曲線的繪制 精確量取分析純的冰醋酸配制成含有 0g/L,0.2g/L,0.4g/L,0.6g/L,1.0g/Lm1.4g/L,2.0g/L不同濃度的標準乙酸溶液,分別取5μl進樣分析。
用乙酸濃度(X)對峰高(Y)做線性回歸分析,
得到線性方程 Y=463.8X
線性相關系數 R2=0.9633
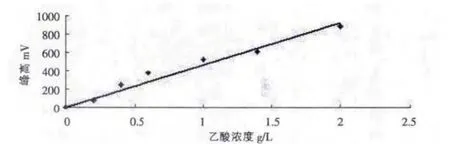
圖2 乙酸標準曲線
1.2.1.7 進樣分析 取 0、2、4、6、8、10、12、14、16、18、20、22h時段的培養液,按樣品處理方法進行樣品處理后,進行HPLC測定,得到培養過程中乙酸隨發酵過程的變化曲線。
1.2.2 產物表達量的測定(雙縮脲法)
1.2.2.1 試劑 雙縮脲試劑:1.75g(CuSO4·5H2O)溶于150mL蒸餾水,加入300mL的濃氨水、300mL的冰蒸餾水及200mL的飽和NaOH搖勻,置于室溫1~2小時。用蒸餾水定容至1000mL。標準蛋白質溶液:10mg·mL-1牛血清白蛋白溶液。
1.2.2.2 蛋白質標準曲線的制定 取10支試管,按表2-3順序操作,在分光光度計(540nm)上測定吸收度。

其中,Y為標準曲線查得蛋白質的濃度(mg·mL-1),N為稀釋倍數,V為樣品所取的體積(mL)。

表2 雙縮脲標準曲線制作
2 結果與分析
2.1 乙酸對細胞生長的影響
2.1.1 乙酸隨發酵過程的曲線圖
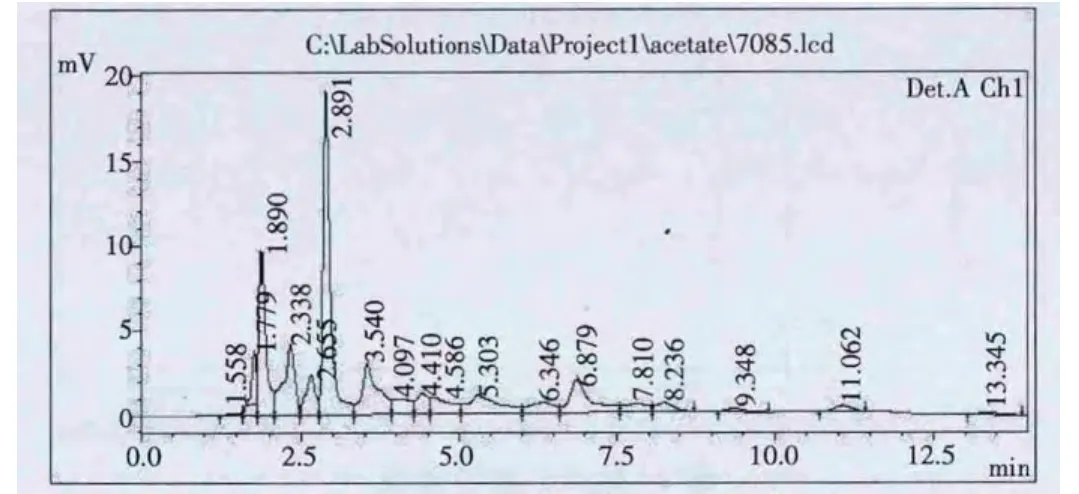
圖3 樣品乙酸色譜圖
在發酵過程中乙酸的含量(HPLC測得的峰高表示)及糖含量如表3所示。

表3
由表3經換算可得乙酸的含量,制得乙酸隨發酵由成圖(圖4)。
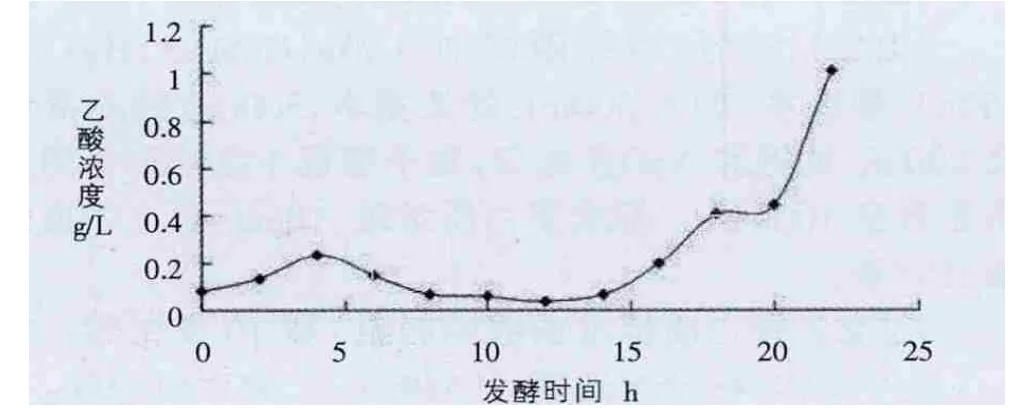
圖4 乙酸隨發酵由成圖
大腸桿菌在發酵過程中,碳源供給量高于細胞所同化的速度,因此當生長速率過大的時候,就會使得供氧不足,導致代謝副產物乙酸的形成。尤其發酵條件在高密度的時候,問題更加突出。在進行培養基中葡萄糖的濃度過于影響著細菌的代謝方式,隨著葡萄糖濃度的降低,大腸桿菌將乙酸作為碳源,發酵液中的乙酸濃度降低;隨著葡萄糖濃度的增加,發酵液中的乙酸濃度迅速增加,pH值迅速下降,從而導致對大腸桿菌繁殖和膠原蛋白表達的抑制。
2.1.2 乙酸對細胞生長的影響
由圖5可以發現在發酵初期,乙酸含量低,不會對細胞的生長產生抑制,比生長速率大;隨著細胞的生長,細胞利用葡萄糖作為碳源進行代謝,產生大量乙酸,比生長速率有下降的趨勢;隨著葡萄糖的消耗,此時補糖尚未開始,菌體利用乙酸作為碳源進行代謝,乙酸含量降低,比生長速率保持平穩;從第10小時開始補糖,隨著發酵地進行,乙酸逐漸積累,濃度升高,菌體的比生長速率降低;在發酵進行到第14個小時的時候,進行溫度誘導,比生長速率增加,乙酸積累,濃度增加;隨著發酵地進行,菌體已經進入衰亡期,最后葡萄糖用盡,發酵停止。

圖5 乙酸與細胞生長的關系
2.2 乙酸對類人膠原蛋白合成的影響
由圖6、7可以看出,當乙酸含量低時,不會對類人膠原蛋白的產量有影響,隨著乙酸積累,會對產量產生影響,當乙酸含量達到一定程度,產物合成會逐漸停止。
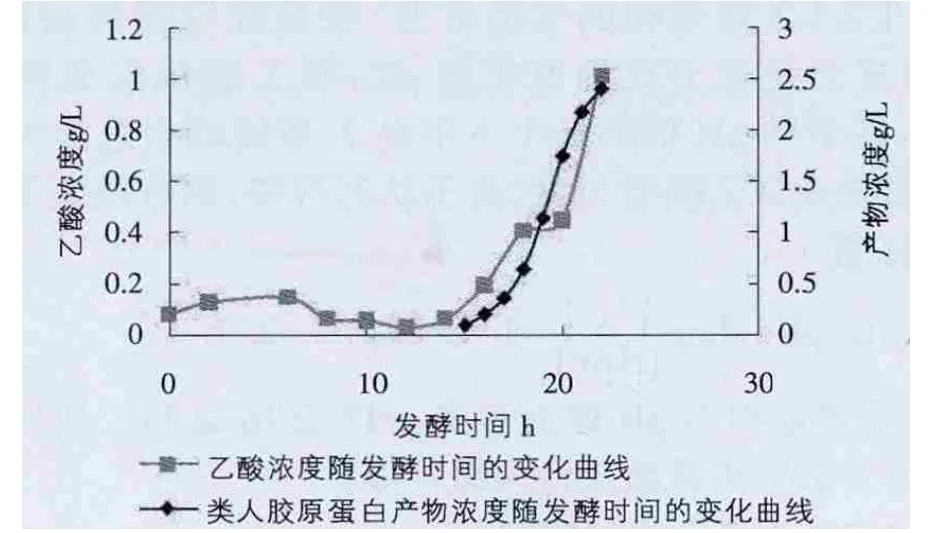
圖6 乙酸對產量的影響1
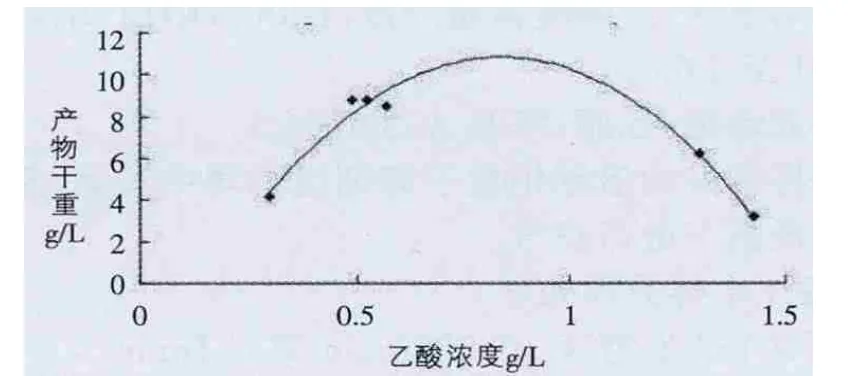
圖7 乙酸對產量的影響2
所以應該考察在不同碳氮比,不同細胞比生長速率,不同溶氧下條件下乙酸產生的量和其對目標蛋白表達量的影響,以確定生產類人膠原蛋白的優化條件。
3 小結
本文主要是對人類膠原蛋白基因工程菌E.coli his 3.1高密度發酵過程中乙酸的產生量和產物表達量之間的關系進行討論研究。我們可以看出,溶解氧控制在30~40%飽和度、比生長速率控制在0.1~0.2h-1、碳氮比控制在100:1到100:20左右的時候,有利于細胞生長和產物的表達,這樣能夠與降低乙酸等有害代謝副產物的積累有著直接的關系,可使最終表達量為9g/L,占總蛋白的30.5%。
[1]關靜,武繼民.膠原蛋白的醫療應用[J].軍事醫學科學院院刊,1997,21(4):305-308.
[2]張龍翔.生物化學實驗方法和技術[M].北京:高等教育出版社,1981:253-254.
[3]Knapp,T.,Luck,E.,Daniels,J.,et al.,Behavior of solubilized collagen as a bioimplast.J Surg Res,23(1977):96-100.
[4]Suarez,D.C.,Kilikian,B.V.,Acetic acid accumulation in aerobic growth of recombinant Escherichia coli. Process Biochemistry[J].35(2000):1051-1055.
[5]張玉娥.肺組織膠原蛋白測定方法的研究[J].中獸醫醫藥雜志,1997,4:13-14.
[6]張惟材,朱厚礎.重組大腸桿菌的發酵與代謝工程[J].微生物學通報,1999,26(4):289-293.
[7]李民,陳常慶.重組大腸桿菌的高密度發酵研究進展[J].生物工程進展,2000,20(2):26-31.

