大豆球蛋白的紅外和Raman光譜分析
龍國徽,紀(jì) 媛,潘洪斌,孫澤威,王錦欣,秦貴信
(1.吉林農(nóng)業(yè)大學(xué)生命科學(xué)學(xué)院,長春 130118;2.吉林大學(xué)物理學(xué)院,長春 130012;3.云南農(nóng)業(yè)大學(xué)云南省動物營養(yǎng)與飼料重點實驗室,昆明 650201;4.吉林農(nóng)業(yè)大學(xué)動物科學(xué)技術(shù)學(xué)院,長春 130118)
大豆球蛋白的紅外和Raman光譜分析
龍國徽1,紀(jì) 媛2,潘洪斌3,4,孫澤威4,王錦欣1,秦貴信4
(1.吉林農(nóng)業(yè)大學(xué)生命科學(xué)學(xué)院,長春 130118;2.吉林大學(xué)物理學(xué)院,長春 130012;3.云南農(nóng)業(yè)大學(xué)云南省動物營養(yǎng)與飼料重點實驗室,昆明 650201;4.吉林農(nóng)業(yè)大學(xué)動物科學(xué)技術(shù)學(xué)院,長春 130118)
利用Fourier變換紅外光譜(FTIR)和激光Raman光譜研究大豆球蛋白的結(jié)構(gòu),并對大豆球蛋白的紅外光譜和Raman光譜的特征峰進行指認(rèn),計算Raman費米共振I850/830的比值.結(jié)果表明:紅外光譜和Raman光譜的酰胺Ⅰ帶去卷積和曲線擬合獲得二級結(jié)構(gòu),其中β-折疊結(jié)果差異較小,α-螺旋、β-轉(zhuǎn)角和無規(guī)卷曲結(jié)果差異較大(p<0.05);紅外光譜在1 618,1 682cm-1處的吸收峰歸屬于大豆球蛋白的分子間和分子內(nèi)聚集,擬合峰面積百分?jǐn)?shù)分別為11.1%和9.5%;包埋和外露的酪氨酸殘基占酪氨酸殘基總量的14%和86%.
紅外光譜;Raman光譜;大豆球蛋白;分子結(jié)構(gòu)
Fourier變換紅外(FTIR)光譜和Raman光譜同屬分子振動光譜.目前利用FTIR光譜研究大豆球蛋白結(jié)構(gòu)的報道較多[8-10],而利用Raman光譜對大豆球蛋白結(jié)構(gòu)的研究較少[11-12].FTIR光譜由偶極距變化引起,Raman光譜由分子振動的極化率變化引起.FTIR光譜對C—O,N—H和O—H等極性基團伸縮振動檢測靈敏,Raman光譜對C—C,C—C和S—S等非極性基團檢測靈敏,因此二者可以相互補充提供分子結(jié)構(gòu)線索[13].利用計算機輔助解析方法(如去卷積、二階導(dǎo)數(shù)和曲線擬合)可定量分析蛋白質(zhì)的二級結(jié)構(gòu)[14-15].本文利用FTIR光譜和Raman光譜研究大豆球蛋白的結(jié)構(gòu).
1 實 驗
1.1 試劑與儀器
大豆品種為豐交7607(吉林農(nóng)業(yè)大學(xué)春雨種業(yè)有限公司);正己烷、硫酸銨、β-巰基乙醇、三羥甲基氨基甲烷、丙烯酰胺、甲叉雙丙烯酰胺和BCA蛋白檢測試劑盒(北京鼎國試劑公司);瓊脂糖凝膠Sephrose CL-6B(英國Amersham Pharmacia Biotech AB公司);其他試劑均為國產(chǎn)分析純.
低溫高速離心機(美國Sigma公司);110cm×4.5cm層析柱(上海精科實業(yè)有限公司);1-4LD型冷凍干燥機(德國Alpha公司);Nicolet 360Fourier變換紅外光譜儀(美國Nicolet公司);JY-HR800型顯微共聚焦激光Raman光譜儀(法國Jobin Yvon公司);JEOL-6480LV掃描電鏡(日本電子株式會社).
1.2 實驗過程
1.2.1 大豆球蛋白的制備 參照文獻[16]方法:大豆粉用正己烷常溫脫脂,脫脂豆粉用pH=8.0的Tris-HCl緩沖液(含10mmol/L 2-ME)抽提,m(料)∶V(液)=1∶15,攪拌2h后于4℃以9 000r/min離心30min,所得上清液用1mol/L HCl調(diào)至pH=6.4,以9 000r/min離心30min.所得沉淀物溶解于pH=7.6的磷酸鹽緩沖溶液中,靜止過夜,6 500r/min離心20min.上清液加入固體硫酸銨調(diào)至質(zhì)量分?jǐn)?shù)為51%的飽和狀態(tài),離心后棄去沉淀,上清液繼續(xù)調(diào)至質(zhì)量分?jǐn)?shù)為66%的硫酸銨飽和狀態(tài),離心所得沉淀溶于磷酸鹽緩沖液(pH=7.6)中.瓊脂糖凝膠CL-6B裝柱(110cm× 4.5cm),充分平衡后上樣,先用磷酸鹽緩沖液(pH=7.6)洗脫,再用紫外-可見分光光度計在280nm處檢測,分別收集洗脫液組分.洗脫液于4℃蒸餾水中透析,凍干后得到純化的大豆球蛋白,用BCA蛋白檢測試劑盒檢測蛋白質(zhì)含量,樣品于-20℃冷藏備用.
1.2.2 SDS-PAGE電泳和Native-PAGE電泳 參照文獻[17]方法:在不連續(xù)的緩沖體系中進行電泳,采用質(zhì)量分?jǐn)?shù)為12%的分離膠和質(zhì)量分?jǐn)?shù)為4%的濃縮膠,將蛋白樣品溶于含有SDS-PAGE的Tris-HCl緩沖液(pH=8.0),含質(zhì)量分?jǐn)?shù)為1%的SDS、體積分?jǐn)?shù)為2%的巰基乙醇、體積分?jǐn)?shù)為5%的甘油和質(zhì)量分?jǐn)?shù)為0.025%的溴酚藍中,電泳前煮沸5min.上樣量為10μL,凝膠電泳于恒流模式下進行,在濃縮膠中電流為40mA,進入分離膠后增至80mA.凝膠染色液采用質(zhì)量分?jǐn)?shù)為0.25%的考馬斯亮藍(R-250)溶液,用高甲醇的醋酸溶液脫色,V(甲醇)∶V(冰乙酸)∶V(去離子水)=1∶1∶8.Native-PAGE的條件與SDS-PAGE類似,但Tris-HCl中不含SDS和巰基乙醇,且樣品不需加熱處理.
1.2.3 FTIR光譜的測定 參照文獻[18]方法:將凍干大豆球蛋白樣品置于干燥器內(nèi)用P2O5充分干燥,稱取2mg干燥的樣品,加入200mg的KBr,研磨混合均勻后壓片,恒溫箱中平衡溫度5min后進行紅外光譜掃描,掃描波段4 000~1 000cm-1,掃描次數(shù)32,分辨率4cm-1.圖譜處理采用OMNIC 8.0數(shù)據(jù)處理軟件,原譜進行基線校正,所有蛋白樣品的紅外光譜與不含蛋白質(zhì)樣品的KBr圖譜做差譜,去卷積參數(shù)控制半峰寬為30和增強因子為4.0得到去卷積譜.結(jié)合去卷積圖譜,利用Origin 7.5軟件對酰胺Ⅰ帶進行Gauss曲線擬合,多次擬合使殘差最小,使重疊在一起的不同譜帶可完全分辨開.
1.2.4 激光Raman光譜的測定 采用JY-HR800型顯微共聚焦激光Raman光譜儀,激發(fā)光源為氬離子激光器,波長為514.5nm,功率為40mW.狹縫寬度50μm,光柵為1 800刻線,分辨率1cm-1.顯微鏡頭為50倍常規(guī)鏡頭,通過5倍物鏡背向散射,積分時間為30s.先將干燥處理的大豆球蛋白置于凹面載玻片上,再將凹面載玻片置于Raman顯微鏡下,Raman位移范圍400~2 000cm-1,重復(fù)掃描10次,計算機自動累加平均.Raman圖譜基線校正,歸一化處理以苯丙氨酸的1 004cm-1為內(nèi)標(biāo),Raman譜圖歸屬采用Labspec 5.0,由OMNIC 8.0處理得到酰胺Ⅰ帶去卷積譜,利用Origin 7.5軟件進行曲線擬合.
1.2.5 數(shù)據(jù)分析 采用SPSS 12.0軟件包進行數(shù)據(jù)統(tǒng)計分析,實驗數(shù)據(jù)為3次測定取平均值,蛋白質(zhì)二級結(jié)構(gòu)含量采用LSD方差分析,比較平均值之間的差異顯著性.
2 結(jié)果與討論
2.1 SDS-PAGE和Native-PAGE電泳分析
制備的大豆球蛋白SDS-PAGE電泳圖譜具有典型的酸性和堿性亞基,如圖1(A)所示.其對應(yīng)分子量分別為35 000~40 000和18 000.提純的大豆蛋白各亞基分子量與理論值相符,經(jīng)電泳鑒定的大豆球蛋白質(zhì)量分?jǐn)?shù)大于90%,與文獻[19]結(jié)果相符.Native-PAGE電泳圖譜(圖1(B))中的3個泳道顯示出大豆球蛋白單體、三聚體和六聚體3種形態(tài),不同類型的聚集體表明大豆球蛋白在分離純化過程中發(fā)生部分解聚或聚合.
2.2 大豆球蛋白的FTIR圖譜分析
圖2為大豆球蛋白的FTIR譜,表1列出了其紅外譜特征吸收峰對應(yīng)的峰位和峰強及歸屬.由圖2和表1可見,3 303cm-1處的峰位歸屬于O—H伸縮振動和N—H伸縮振動,反映了大豆球蛋白中形成分子內(nèi)的C—O…H—N氫鍵和分子間的H—O…N—H氫鍵水平,氫鍵強弱反映了水分子的 O—H 伸縮振動或吸附水量的大小[20].2 888cm-1處的峰位歸屬于大豆球蛋白分子飽和結(jié)構(gòu)中CH3和CH2基團的C—H伸縮振動,反映了大豆球蛋白中脂肪族氨基酸側(cè)鏈中C—H對稱與非對稱伸縮振動,該峰位變化可評定脂肪族氨基酸側(cè)鏈結(jié)構(gòu)在大豆球蛋白中的變化[21].
大豆球蛋白的紅外光譜1 800~1 000cm-1是指紋圖譜區(qū)域:1 652cm-1峰位的酰胺Ⅰ帶歸屬于80%的C O伸縮振動和20%的C—N伸縮振動;1 540cm-1峰位的酰胺Ⅱ帶歸屬于60%的N—H變形振動、30%的C—N伸縮振動和10%的C—C伸縮振動;1 280,1 240cm-1峰位的酰胺Ⅲ帶歸屬于C—N伸縮振動和N—H面外彎曲振動[22];位于1 342cm-1處的吸收峰由CH3基團對稱變形振動產(chǎn)生,位于1 467cm-1處的吸收峰由CH3基團不對稱變形振動和CH2基團變形振動產(chǎn)生,位于1 342,1 467cm-1處的吸收峰多數(shù)來自大豆球蛋白中脂肪族氨基酸的側(cè)鏈結(jié)構(gòu)[22];1 403cm-1峰位歸屬于COOH中的C—OH伸縮振動[23];位于1 149cm-1處的吸收峰歸屬于大豆球蛋白中環(huán)狀結(jié)構(gòu)C—C振動或C—O—O糖苷鍵振動[24].

圖1 大豆球蛋白的SDS-聚丙烯酰胺(A)和非還原聚丙烯酰胺(B)凝膠電泳圖譜Fig.1 SDS-PAGE profiles(A)and native-PAGE profiles(B)of glycinin
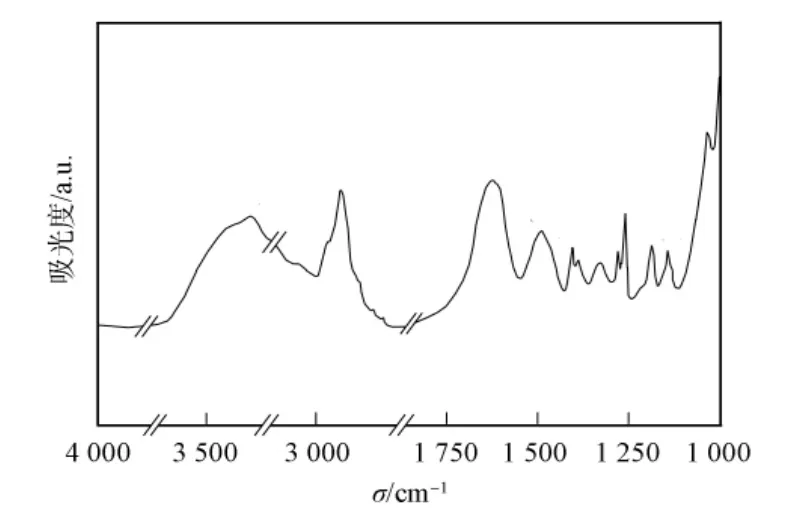
圖2 大豆球蛋白的紅外光譜Fig.2 FTIR spectrum of glycinin

表1 大豆球蛋白的紅外光譜峰值及歸屬Table 1 Characteristic absorption peaks in FTIR spectrum of glycinin
大豆球蛋白的紅外光譜酰胺Ⅰ帶1 700~1 600cm-1是二級結(jié)構(gòu)的敏感區(qū)域,是計算蛋白二級結(jié)構(gòu)的主要譜帶.酰胺Ⅰ帶1 600~1 700cm-1進行去卷積獲得10個單一峰,如圖3(A)所示,F(xiàn)TIR酰胺Ⅰ帶特征峰1 618,1 627,1 634,1 674cm-1歸屬為β-折疊;1 658cm-1歸屬于為α-螺旋;1 664,1 682,1 692cm-1歸屬為β-轉(zhuǎn)角;1 646cm-1歸屬為無規(guī)卷曲[11],見表2.1 606cm-1峰位歸屬于酪氨酸殘基的振動或與精氨酸殘基相關(guān)[24].圖3(B)為結(jié)合去卷積峰位對紅外光譜的酰胺Ⅰ帶進行曲線擬合,大豆球蛋白二級結(jié)構(gòu)β-折疊、α-螺旋、β-轉(zhuǎn)角和無規(guī)卷曲的百分?jǐn)?shù)分別為(40.67±1.40)%,(15.72±0.44)%,(28.33±1.38)%和(15.27±0.40)%(表2).FTIR酰胺Ⅰ帶中1 618,1 682cm-1峰位可定量反映大豆球蛋白分子內(nèi)聚集和分子間聚集[20],其曲線擬合積累面積的百分?jǐn)?shù)分別為11.1%和9.5%(表2).

圖3 大豆球蛋白的紅外光譜酰胺Ⅰ帶(1 600~1 700cm-1)去卷積譜(A)和曲線擬合譜(B)Fig.3 Deconvoluted spectrum(1 600~1 700cm-1)region(A)and the curve-fitted individual component bands(B)of amideⅠin glycinin FTIR spectrum

表2 大豆球蛋白的紅外光譜和Raman光譜酰胺Ⅰ帶曲線擬合結(jié)果Table 2 Results of amideⅠcurve-fitting obtained in FTIR spectrum and Raman spectrum for glycinin
2.3 大豆球蛋白的Raman譜分析
圖4為大豆球蛋白Raman光譜400~2 000cm-1的特征吸收峰,大豆球蛋白的Raman光譜峰值及歸屬列于表3.由圖4和表3可見,1 667cm-1峰位為酰胺Ⅰ帶,1 242cm-1峰位為酰胺Ⅲ帶.酰胺Ⅰ帶和酰胺Ⅲ帶常用于蛋白質(zhì)主鏈骨架分析和定量計算二級結(jié)構(gòu).酰胺Ⅰ帶中80%為C=O鍵伸縮振動,20%為C—N伸縮振動和N—H彎曲振動[25].酰胺Ⅲ譜帶中40%為肽鍵的C—N伸縮振動,30%為N—H彎曲振動,由于酰胺Ⅲ譜帶常混雜其他振動能帶,因此很少單獨用于判斷蛋白質(zhì)的二級結(jié)構(gòu)[21].酰胺Ⅰ帶1 640~1 690cm-1去卷積產(chǎn)生19個單 一 峰, 如 圖 5(A)所 示, 其 特 征 峰 1 665~1 680cm-1歸屬為β-折疊,1 645~1 660cm-1歸屬為α-螺旋,1 640~1 645cm-1和1 680~1 690cm-1歸屬為β-轉(zhuǎn)角,1 660~1 670cm-1歸屬為無規(guī)卷曲[13](表2).圖5(B)結(jié)合去卷積峰位對酰胺Ⅰ帶進行曲線擬合,獲得的二級結(jié)構(gòu)結(jié)果中β-折疊的百分?jǐn)?shù)為(41.61±1.29)%,比紅外光譜得到的結(jié)果高0.31%,差異不顯著[12];而α-螺旋、β-轉(zhuǎn)角和無規(guī)卷曲的百分?jǐn)?shù)分別為(21.52±1.04)%,(24.72±1.07)%和(12.13±0.89)%,與紅外光譜得到的結(jié)果相比,分別產(chǎn)生36.89%,-12.72%和-20.54%的顯著差異性變化(p<0.05)(表2).Raman光譜不易得到適合做曲線擬合的理想蛋白質(zhì)二級結(jié)構(gòu),去卷積提高光譜分辨率時也會增加噪聲.由于噪音峰的隨機性和信號峰穩(wěn)定不變,因此通過多次掃描累加平均可消減噪聲信號峰的影響.
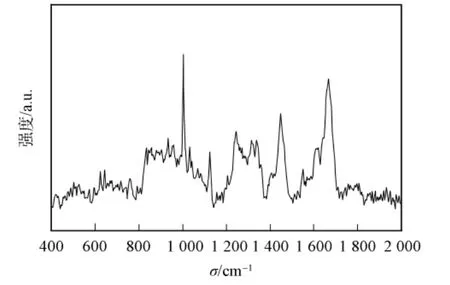
圖4 大豆球蛋白Raman光譜Fig.4 Raman spectrum of glycinin
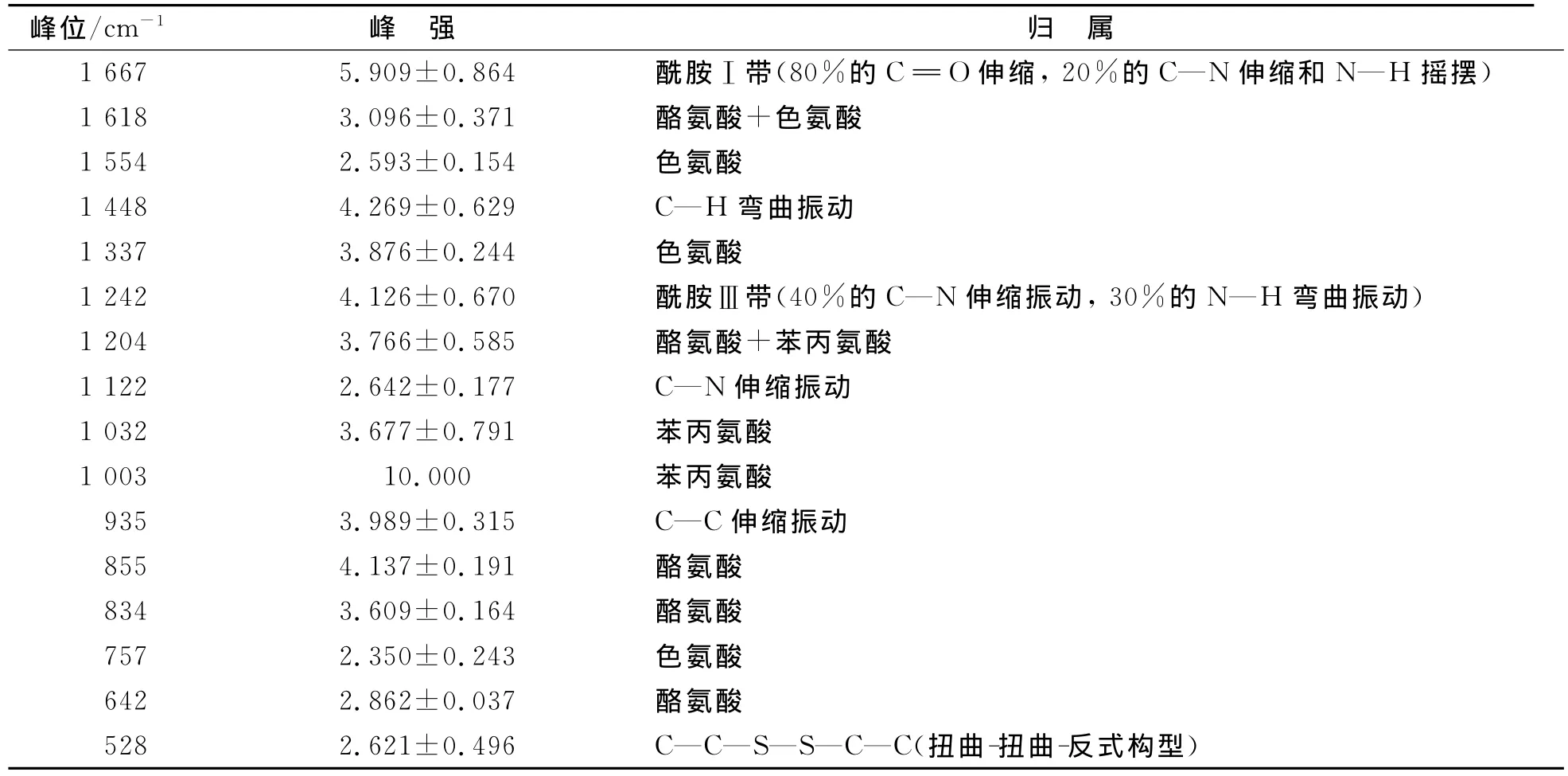
表3 大豆球蛋白的Raman光譜峰值及歸屬Table 3 Assigmnenst of Raman shift of glycinin
2.4 大豆球蛋白的側(cè)鏈構(gòu)象
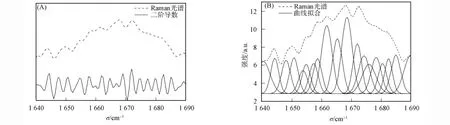
圖5 Raman光譜酰胺Ⅰ帶(1 640~1 690cm-1)去卷積譜(A)和曲線擬合譜(B)Fig.5 Deconvoluted spectrum(1 640~1 690cm-1)region(A)and the curve-fitted individual component bands(B)of amideⅠin glycinin Raman spectrum
855,834cm-1為酪氨酸殘基的苯環(huán)呼吸振動和面外彎曲振動產(chǎn)生的費米共振雙峰,可反映蛋白質(zhì)中酪氨酸所處的環(huán)境.當(dāng)I850/I830=1.25~1.40時,表明酪氨酸殘基完全暴露于分子表面;當(dāng)I850/I830=0.3~0.5時,酪氨酸殘基完全埋藏于分子內(nèi)部;當(dāng)I850/I830=0.7時,酪氨酸殘基為電離狀態(tài)[26].本文中大豆球蛋白的I850/I830=1.146,“包埋”和“外露”的酪氨酸殘基占酪氨酸殘基總量的14%和86%.通過500~550cm-1處C—C—S—S—C—C鍵的特征譜帶可判斷二硫鍵的構(gòu)型.500~510cm-1譜帶屬于扭曲-扭曲-扭曲式構(gòu)型(g-g-g),515~525cm-1譜帶屬于扭曲-扭曲-反式構(gòu)型(g-g-t),535~545cm-1譜帶屬于反式-扭曲-反式構(gòu)型(t-g-t)[26].500~550cm-1多峰擬合結(jié)果表明,大豆球蛋白的二硫鍵構(gòu)型中g(shù)-g-g,g-g-t和t-g-t構(gòu)型的百分?jǐn)?shù)分別為34.9%,32.0%和33.1%.大豆球蛋白中芳香族氨基酸苯丙氨酸、色氨酸和酪氨酸能提供重要的側(cè)鏈信息.苯丙氨酸的特征譜峰主要位于622,1 003,1 032,1 204cm-1處,其中1 003cm-1處尖銳的振動峰為苯環(huán)的呼吸振動峰,其強度不受蛋白構(gòu)象變化的影響,通常用作歸一化因子;1 032cm-1峰位歸屬于苯丙氨酸的C—H面內(nèi)彎曲振動.大豆球蛋白中色氨酸的吲哚環(huán)Raman譜峰位于757,1 337,1 554cm-1處,其中757cm-1峰位對色氨酸吲哚環(huán)的水化環(huán)境敏感[27],1 337cm-1處的譜線較強,表明大豆球蛋白中的色氨酸趨向于埋藏.642,834,855,1 204cm-1峰位歸屬于酪氨酸側(cè)鏈的譜峰[28],I850/I830表明酪氨酸側(cè)鏈主要趨向于暴露.大豆球蛋白的側(cè)鏈構(gòu)象分析能夠反映大豆球蛋白的三級結(jié)構(gòu)和四級結(jié)構(gòu).
綜上所述,本文利用FTIR光譜對大豆球蛋白進行了分子內(nèi)聚集和分子間聚集的定量分析,與FTIR光譜比較,Raman光譜指紋區(qū)數(shù)據(jù)顯示了更高的分辨率,能提供更多的結(jié)構(gòu)信息.
[1] Hojilla-Evangelista M P,Sessa D J,Mohamed A,et al.Functional Properties of Soybean Lupin Protein Concentrates Produced by Ultrafiltration-Diafiltration[J].J Am Oil Chem Soc,2004,81(12):1153-1157.
[2] Preeti L,Anil N N.Thermal and Mechanical Properties of Environment-Friendly‘Green’Plastics from Stearic Acid Modified-Soy ProteinIsolate[J].Industrial Crops and Products,2005,21(1):49-64.
[3] Staswick P E,Hermodson M A,Nielson N C,et al.Identification of the Acidic and Basic Subunit Complexes of Glycinin[J].J Biol Chem,1981,256(16):8752-8755.
[4] Adachi M,Kanamori J,Masuda T,et al.Crystal Structure of Soybean 11SGlobulin:Glycinin A3B4 Homohexamer[J].Proc Natl Acad Sci USA,2003,100(12):7395-7400.
[5] Thygesen L G,Lokke M M,Micklander E,et al.Vibrational Microspectroscopy of Food Raman vs FT-IR[J].Trends in Food Science &Technology,2003,14(1):50-57.
[6] Mills E N,Huang L,Noel T R,et al.Formation of Thermally Induced Aggregates of the Soya Globulin β-Conglycinin[J].Biochem Bioph Acta,2001,1547(2):339-350.
[7] Huson M G,Strourina E V,Kealley C S,et al.Effects of Thermal Denaturation on the Solid-State Structure and Molecular Mobility of Glycinin[J].Biomacromolecules,2011,12(6):2092-2102.
[8] Abbott T P,Nabetani H,Sessa D J,et al.Effects of Bound Water on FTIR Spectra of Glycinin[J].J Agric Food Chem,1996,44(8):2220-2224.
[9] Subirade M,Kelly I,Gueguen J,et al.Molecular Basis of Film Formation from a Soybean Protein:Comparison between the Conformation of Glycinin in Aqueous Solution and in Films[J].Int J Biol Macromol,1998,23(4):241-249.
[10] L’Hocine L,Boye J I,Jouve S.Ionic Strength and pH-Induced Changes in the Immunoreactivity of Purified Soybean Glycinin and Its Relation to Protein Molecular Structure[J].J Agric Food Chem,2007, 55(14):5819-5826.
[11] ZHAO Xiaoyan,CHEN Fusheng,XUE Wentong,et al.FTIR Spectra Studies on the Secondary Structures of Soybean 7Sand 11SGlobulins Using AOT Reverse Micellar Extraction[J].Food Hydrocolloids,2008,22(4):568-575.
[12] ZHAO Xiaoyan,QIANG Ao,CHEN Fusheng,et al.Effect of Reverse Micelle on Conformation of Soy Globulins:A Raman Study[J].Food Chemistry,2009,116(1):176-182.
[13] Lakemond C M,Jongh H H,de,Hessing M,et al.Soy Glycinin:Influence of pH and Ionic Strength on Solubility and Molecular Structure at Ambient Temperatures[J].J Agric Food Chem,2000,48(6):1985-1990.
[14] Byler D M,Brouillette J N,Susi H,et al.Quantitative Studies of Protein Structure by FT-IR Spectral Deconvolution and Curve Fitting[J].Spectroscopy,1986,1:29-32.
[15] 王斌,王靖,余江,等.FT-Raman光譜對蛋白質(zhì)二級結(jié)構(gòu)的定量分析[J].光譜學(xué)與光譜分析,1999,19(5):674-676.(WANG Bin,WANG Jing,YU Jiang,et al.A Quantitative Study on Secondary Structure of Proteins by FT-Raman Spectroscopy[J].Spectroscopy and Spectral Analysis,1999,19(5):674-676.)
[16] Nagano T,Hirotsuka M,Mori H,et al.Dynamic Viscoelastic Study on the Gelation of 7SGlobulin from Soybeans[J].J Agric Food Chem,1992,40(6):941-944.
[17] Laemmli U K.Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4[J].Nature,1970,227:680-685.
[18] Souillac P O,Middaugh C R,Rytting J H.Investigation of Protein/Carbohydrate Interactions in the Dried State Diffuse Reflectance FTIR Studies[J].Inter J Pharmaceut,2002,235(1/2):207-218.
[19] Tsutomu S,Mitsutaka K,Kazunobu T.Novel Method Using Phytase for Separating Soybeanβ-Conglycinin and Glycinin[J].Biosci Biotechnol Biochem,2001,65(4):884-887.
[20] Mahler H C,F(xiàn)riess W,Grauschopf U,et al.Protein Aggregation:Pathways,Induction Factors and Analysis[J].Journal of Pharmaceutical Sciences,2009,98(1):2909-2934.
[21] Ramirez F J,Luque P,Heredia A,et al.Fourier Transform IR Study of Enzymatically Isolated Tomato Fruit Cuticular Membrane[J].Biopolymers,1992,32(11):1425-1429.
[22] Sivakumar S,Sivasubramanian J,Raja B.Aluminium Induced Structural,Metabolic Alterations and Protective Effects of Desferrioxamine in the Brain Tissue of Mice:An FTIR Study[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2012,99:252-258.
[23] Kaddour A A T,Mondet M,Cuq B,et al.Description of Chemical Changes Implied during Bread Dough Mixing by FTTR Mid-infrared Spectroscopy[J].Cereal Chemistry,2008,85(5):673-678.
[24] Robertson G H,Gregorski K S,Cao T K,et al.Changes in Secondary Protein Structures during Mixing Development of High Absorption(90%)Flour and Water Mixtures[J].Cereal Chem,2006,83:136-142.
[25] Catalina D,Cristiano D,Elo?se L,et al.Raman and IR Spectroscopy of Manganese Superoxide Dismutase,a Pathology Biomarker[J].Vibrational Spectroscopy,2012,62:50-58.
[26] Hartwig S,Malgorzata B.Identification and Quantification of Valuable Plant Substances by IR and Raman Spectroscopy[J].Vib Spectrosc,2007,43(1):13-25.
[27] Susi H,Byler D M.Fourier Transform Infrared Spectroscopy in Protein Conformation Studies[M].Champaign:American Oil Chemists’Society,1988:235-250.
[28] Ellepola S W,Choi S M,Phillips D L,et al.Raman Spectroscopic Study of Rice Globulin[J].Journal of Cereal Science,2006,43(1):85-93.
(責(zé)任編輯:單 凝)
Analysis of Soy Glycinin by FTIR and Raman Spectroscopy
LONG Guohui1,JI Yuan2,PAN Hongbin3,4,SUN Zewei4,WANG Jinxin1,QIN Guixin4
(1.College of Life Science,Jilin Agricultural University,Changchun130118,China;2.College of Physics,Jilin University,Changchun130012,China;3.Key Laboratory of Animal Nutrition and Feed of Yunnan Province,Yunan Agricultural University,Kunming650201,China;4.College of Animal Science and Technology,Jilin Agricultural University,Changchun130118,China)
The molecular structure of glycinin was investigated by FTIR and Raman spectroscopy.The frequency and signal intensity of IR and Raman bands were assigned.The data suggest that FTIR and Raman spectra reflect a large amount of structural information.The secondary structure of glycinin was assessed by the deconvolution amideⅠband and curve-fitting.Quantitative analysis of secondary structure reveals that the results of the folded glycininβ-sheet had no significant difference,while the glycininα-h(huán)elix,turning angle,random coil had significant difference(p<0.05).The IR bands at 1 618cm-1and 1 682cm-1were considered to reflect the formation of intermolecular aggregates(11.1%)and intramolecular aggregates(9.5%).The I850/830intensity ratio of Raman tyrosine doublet suggests that the contents of the buried tyrosine residue and exposed tyrosine residue were 14%and 86%in glycinin.
FTIR;Raman spectroscopy;glycinin;molecular structure
Q512
Q
1671-5489(2014)04-0840-07
蛋白質(zhì)是生命體中最基本的物質(zhì),各種蛋白質(zhì)的生物學(xué)功能與其特有的各級結(jié)構(gòu)密切相關(guān)[1-2].大豆球蛋白約占大豆蛋白總量的40%,相對分子質(zhì)量為300 000~380 000,由2個三聚體堆疊成為六聚體,6種酸性多肽(A1a,A1b,A2,A3,A4,A5)和5種堿性多肽(B1a,B1b,B2,B3,B4)組成5個單體A1bB2,A2B1a,A1aB1b,A5A4B3和A3B4,每個單體均由1個酸性亞基(約35 000)和1個堿性亞基(約20 000)構(gòu)成,并通過1個二硫鍵連接[3-4].大豆球蛋白的分子結(jié)構(gòu)緊密,亞基之間高度聚集和壓縮,大量酶切位點包藏于蛋白質(zhì)分子內(nèi)部,具有較強的抗蛋白酶消化能力[5].大豆球蛋白聚集方式對食物的流變和質(zhì)構(gòu)等功能性質(zhì)影響較大[6].天然大豆球蛋白具有典型的二級結(jié)構(gòu)、三級結(jié)構(gòu)及四級結(jié)構(gòu),同時其亞基有規(guī)律的空間排布形成了部分晶態(tài)結(jié)構(gòu),是研究蛋白質(zhì)生物聚合物較好的模式蛋白[7].
10.13413/j.cnki.jdxblxb.2014.04.41
2013-10-15.
龍國徽(1971—),男,漢族,碩士,講師,從事生物化學(xué)與分子生物學(xué)的研究,E-mail:longguohui@jlau.edu.cn.通信作者:秦貴信(1956—),男,漢族,博士,教授,從事大豆抗?fàn)I養(yǎng)因子的研究,E-mail:qgx2013@sohu.com.
國家自然科學(xué)基金(批準(zhǔn)號:11274138).

