皮膚病理性瘢痕及瘢痕癌組織中Smad mRNA和蛋白檢測及基因突變
李明華 劉進輝 白曉龍 李宏偉 呂東亮 郭京麗 劉冬梅 宋 斌
(吉林省人民醫院燒傷整形外科,吉林 長春 130021)
皮膚瘢痕的產生是機體對創傷修復正常的、必然的生理反應,也是創傷愈合過程的必然結果。瘢痕不具備正常皮膚組織結構及生理功能,是一種失去正常組織活力的、異常的、不健全的組織。病理性皮膚瘢痕又稱為異常疤痕,是增生性瘢痕(HS)和瘢痕疙瘩(K)的統稱,是以膠原等大量結締組織基質過度產生和沉積的皮膚纖維化疾病。有研究表明病理性瘢痕的發生率波動于8%~16%,部分病理性瘢痕具有增殖性,呈現持續生長亢奮表現,不但影響患者的美觀、生理功能,且在長期受壓、持重、牽拉、摩擦、抓癢等不良刺激影響下有癌變可能〔1~3〕。絲/蘇氨酸激酶受體(Smad)是TGF-β信號轉導途徑重要標志性因子,介導了TGF-β的胞內信號轉導,而TGF-β信號傳導通路廣泛參與細胞及組織的生理病理過程,且尤與細胞基質沉淀以及纖維化密切相關,是傷口愈合及瘢痕形成的主要生物信號途徑之一。本文通過觀察不同瘢痕組織的smad因子擬揭示瘢痕癌及其他纖維化疾病、癌癥的發病機制。
1 資料與方法
1.1一般資料 標本來源于本院2009年1月至2013年2月病理科。20份病理性瘢痕組織標本設為觀察A組,男11例,女9例,年齡29~81〔平均(42±5.32)〕歲,來源部位:頭面部9例,上肢6例,下肢5例,均有疤痕形成史。20份瘢痕癌組織標本設為觀察B組,男10例,女10例,年齡30~81〔平均(42±7.11)〕歲,來源部位:頭面部8例,上肢7例,下肢4例,臀部1例,疤痕形成原因:火燒傷11例,電擊2例,油燙傷7例。20份正常皮膚組織設為對照組,男11例,女9例,年齡31~82〔平均(43±6.91)〕歲,部位:頭面部7例,上肢8例,下肢3例,臀部2例。三組標本年齡、性別、來源部位等一般情況無統計學差異(P>0.05),具有可比性。
1.2檢測方法
1.2.1免疫組化 采用免疫組化(SP)進行檢測,抗體使用兔抗人Smad單克隆抗體(Abcam生物公司),操作按照說明書進行。結果判定:Smad陽性表達是細胞質出現棕色顆粒;每張切片隨機選擇5個視野,統計著色細胞與未著色細胞的比值(陽性率)。根據陽性率×染色強度計分的乘積將免疫組化陽性等級分為4個等級:陰性:積分<2分;弱陽性:積分2~3分;陽性:積分4~6分;強陽性:積分>6分〔4〕。
1.2.2實時熒光(Real-time)PCR dNTP、Pfu酶均購于上海生工生物工程有限公司;PCR產物純化試劑盒及質粒提取試劑盒均購自上海生工生物工程公司,基因組DNA提取試劑盒購自Promega公司。三組組織的標本各100 mg加入500 μl的Trizol試劑( Invtrogene公司)和100 μl的氯仿,均勻混合后置于離心機14 000 r/min離心10 min,將上層水相置于新的EP管后加入同等體積將RNA沉淀,干燥后加入10 μl用DEPC處理去離子水溶解的RNA沉淀,置于-80℃保存。針對國內Smad的基因片段保守區域,根據GenBank收錄的Smad基因序列設計引物,Smad正義:5′-CGCTTGATCCAAAGTGGAAT-3′,反義:5′-GGTTGATGGCATTGGAAAGA-3 ′;GAPDH正義:5′-ACTTAGTT-GCGTTACACCCTTTCT-3′,反義:5′-TTCATACATCTCAAGTTGGGGGAC-3′。由廈門鷺隆生物技術有限公司合成并標記。Real-Time PCR操作方法按照試劑盒說明書,使用GAPDH作為內部參照,反應條件:預變性95℃ 15 min;變性95℃ 40 s,退火62℃,延伸72℃ 60 s,共35個循環,PCR產物為800 bp。擴增Ct值利用lightcycler熒光定量PCR儀配備軟件進行分析。以對照組ΔCt值作為校正,根據2-ΔΔCT數值計算得出檢測指標基因濃度。
1.3統計學處理 采用SPSS18.0軟件,組間比較采用t檢驗;計數資料用等級相關(Spearman)分析及χ2檢驗。
2 結 果
2.1免疫組化結果 Smad陽性染色部位以細胞質為主,觀察B組陽性表達率為57.34%,高于觀察A組和對照組(分別為11.77%、11.69%)(P<0.05),觀察A組和對照組之間無統計學差異(P>0.05)。見圖1。
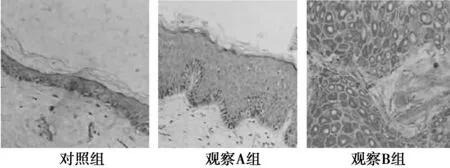
圖1 三組Smad蛋白表達情況
2.2Real-Time PCR結果 觀察B組Smad基因表達水平(2.99±1.09)高于觀察A組(1.39±0.78)和對照組(設為1)(P<0.05),觀察A組和對照組之間無統計學差異(P>0.05)。
2.3Smad與Smad mRNA相關性分析 瘢痕癌標本中Smad蛋白與Smad mRNA的表達有正相關關系(r=0.752,P=0.001)。
2.4Smad基因突變分析 PCR擴增后在40例無任何血緣關系的標本樣品中擴增出200 bp的Smad基因6例,其中病理性瘢痕及瘢痕癌各3例(圖2);致病性與非致病性突變位點未在測序時發現。
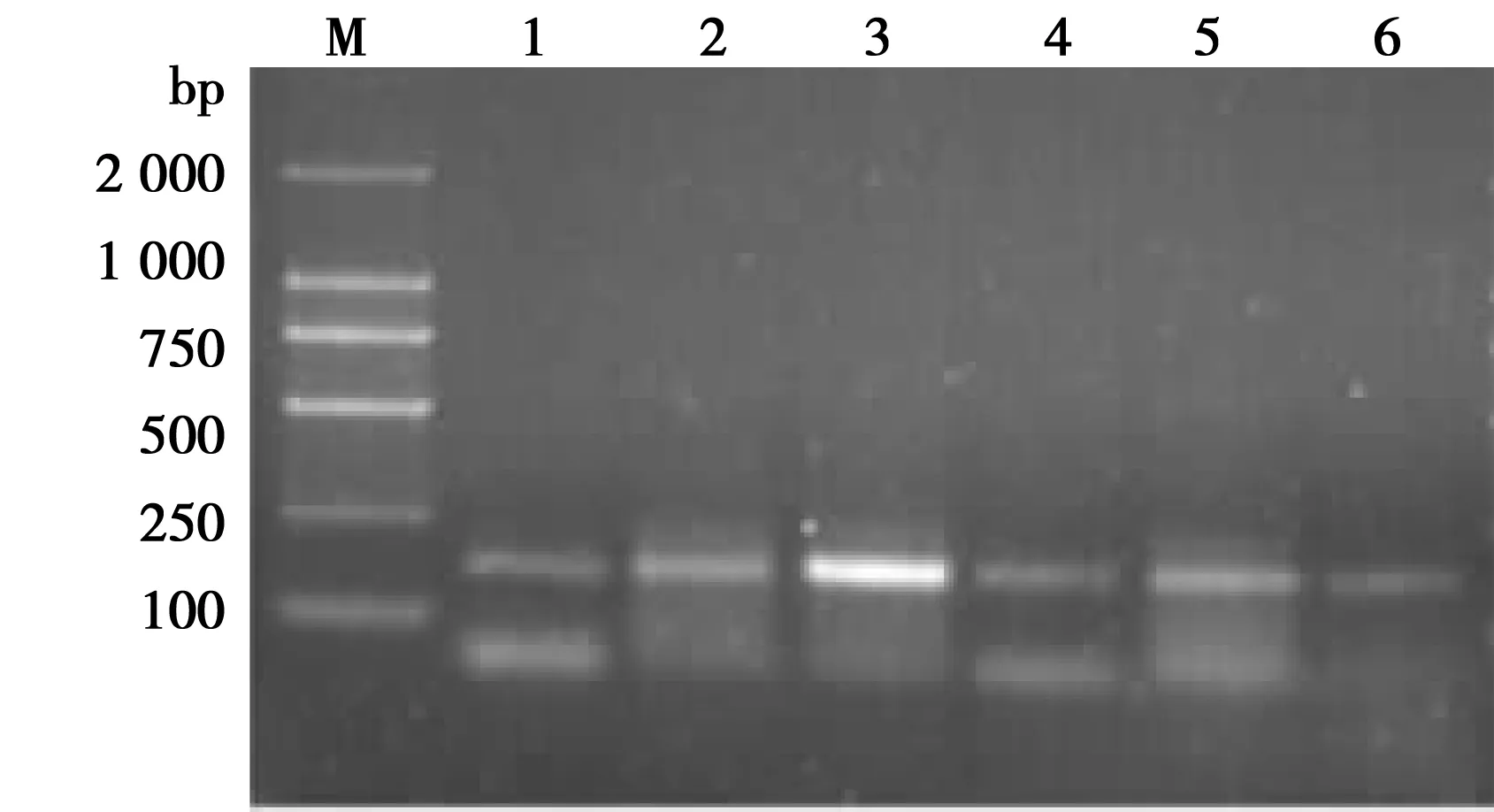
1~3:病理性瘢痕;4~6:瘢痕癌
3 討 論
創傷傷口愈合經過上皮化環節后,TGF-β信號轉導通路在成纖維細胞內被激活,使體內合成和分泌更多的TGF-β受體,靶基因被持續性啟動;又由于TGF-β信號傳導通路與細胞基質沉淀以及纖維化密切相關,通路被過度激活后導致細胞外基質被過度沉淀,最終形成疤痕。Smad是TGF-β信號轉導通路的標志性蛋白,Smads家族蛋白在將TGF-β信號從細胞表面受體傳導至細胞核的過程中起到關鍵性作用,TGF-β1對細胞進行刺激后,TGF-β1型受體被磷酸化,與下游的Smad2/Smad3相互識別編碼后被活化,與此同時與Smad4結合成由異源寡聚體形成的復合體,繼而發生核轉移,從細胞質轉移到細胞核后啟動靶基因,促進靶基因的啟動和轉錄。Smad7在Smad家族中發揮抑制TGF-β1的作用,通過負反饋的效能降低TGF-β1的強度和活性時間,同時抑制TGF-β/Smad信號通路激活〔5~9〕。
Smad蛋白能夠抑制和分化角質細胞,角質細胞分泌的角質細胞生長因子對組織損傷具有明顯的促進修復和保護作用,Smad在一定程度上削弱了角質細胞修復組織的作用,Annes等〔9〕發現Smad3基因敲除小鼠體內角質細胞分裂更快,燒傷創面感染率下降,傷口愈合恢復更迅速,這一結果提示TGF-β信號通路通過Smad蛋白抑制角質細胞的增殖而影響傷口組織愈合。本研究結果提示瘢痕癌中Smad的高表達可能與癌變相關,Smad蛋白可能是瘢痕上皮癌變的危險信號。故筆者認為抑制Smad蛋白的活性和濃度,可加速上皮細胞的增殖分化,下調沉淀基質的數量,減少創口肉芽組織形成,減少瘢痕傷口在不良刺激作用下發生癌變的風險。
Smad基因突變或者缺失會影響細胞正常分化,出現蛋白功能異常〔10,11〕。本研究擴增突變基因檢測結果顯示6條目的條帶均未見致病性與非致病性突變位點,筆者認為出現這一結果不排除與本次研究標本量較少有關。
總之,Smad表達升高可能與瘢痕癌相關,下調Smads基因表達和抑制Smad蛋白活性將可能成為治療瘢痕癌的藥物靶方向,從Smad角度研究病理性疤痕皮膚和疤痕癌之間發生發展時間關系是可行的。
4 參考文獻
1Zhang Y,Chang C,Gehling DJ,etal.Regulation of Smad degraduation and activity by Smurf2,an E3 ubiquitin ligase〔J〕.Proc Natl Acad Sci USA,2011;98(3):974-9.
2Shi Y,Massague J.Mechanisms of TGF-beta signaling from cell membrane to the nucleus〔J〕.Cell,2011;113(6):685-700.
3Renzoni EA,Abraham DJ,Howat S,etal.Gene expression profilingreveals novel TGFbeta targetsin adultlung fibroblasts〔J〕.RespirRes,2004;5:24.
4Cai Y,Shen XZ,Zhou CH,etal.Abnormal expression of Smurf2 during the process of rat liver fibrosis〔J〕.Chin J Dig Dis,2010;7(4):237-45.
5楊 力.Smad蛋白家族與TGF-β信號轉導〔J〕.中國美容醫學,2011;10(6):547-9.
6趙自然,劉鶴松,路來金.轉化生長因子-β與瘢痕形成和創傷愈合〔J〕.深圳中西醫結合雜志,2010;14(1):53-5.
7王振宜,章 云,李 斌.Tgf-β在創面愈合及瘢痕形成中作用的研究進展〔J〕.中國中西醫結合外科雜志,2011;10(6):463-4.
8夏 煒,郭樹忠.增生性瘢痕不同時期tgfβ1及其受體的表達〔J〕.第四軍醫大學學報,2009;20(11):934-6.
9李 欣,戴立里.轉化生長因子β1/Smads信號轉導途徑及其與肝纖維化的關系〔J〕.重慶醫學,2007;36(18):1887-9.
10Annes JP,Munger JS,Rifkin DB.Making sense of latent TGF beta activation〔J〕.J Cell Sci,2009;116(Pt 2):217-24.
11陳 琛,葉冬梅,邵淑娟.轉化生長因子-β/Smad信號通路研究進展〔J〕.醫學分子生物學雜志,2011;3(2):126-8,32.

