谷胱甘肽與阿霉素聯(lián)用對肺癌A549細胞增殖的影響
陸何林 吳科鋒 呂應年 朱建紅 李 立
(廣東醫(yī)學院藥學院,廣東 湛江 524023)
阿霉素已被廣泛用于急性白血病、乳腺癌、卵巢癌及肺癌的治療〔1〕。但是,由于會產生劑量依賴的心臟毒性,阿霉素臨床應用受到限制〔1〕。造成阿霉素這種毒副作用的機制雖然尚無定論,但氧化應激及細胞凋亡是最可能的原因,這是因為阿霉素可誘導心肌細胞產生活性氧(ROS)/活性氮并觸發(fā)細胞凋亡信號從而導致心肌細胞死亡〔2~6〕。因此,許多研究以抑制阿霉素誘導的活性氧(ROS)/活性氮及細胞凋亡為目的并以此阻止心臟毒性的發(fā)生〔7~11〕。但是,目前還沒有一個藥物被證明能夠有效、安全地預防阿霉素的此類毒副作用。還原型谷胱甘肽(GSH)為非酶性抗氧化劑,通過其巰基氧化-還原態(tài)的轉換,作為可逆的供氫體,在細胞內發(fā)揮抗氧化作用。GSH(泰特)目前已被臨床用于預防藥物毒性,但關于其可否作為阿霉素化學保護劑的探討還未見報道,本研究就此初步探討。
1 資料與方法
1.1試劑及儀器 RPMI-1640培養(yǎng)基干粉、MTT(Sigma公司);新生牛血清(Hyclone公司);胰蛋白酶(Amresco公司);注射用阿霉素(海正藥業(yè));GSH、活性氧檢測試劑盒、Annexin V-FITC細胞凋亡檢測試劑盒(碧云天);蛋白提取試劑盒、BCA 蛋白定量試劑盒、GAPDH單克隆抗體、ECL化學發(fā)光試劑盒、PVDF膜(凱基);p53單克隆抗體(博士德);辣根過氧化物酶標記抗鼠抗體(Santa公司);YJ-875醫(yī)用凈化工作臺(蘇州凈化設備公司);CO2恒溫培養(yǎng)箱(Precision 公司);ELx800 酶標儀(BIO-TEK 公司);流式細胞儀(EPICS XL公司);垂直電泳儀(Bio-rad公司)。
1.2細胞培養(yǎng) A549為非小細胞肺癌細胞系,由本實驗室液氮冷凍保存。A549細胞于含10%新生牛血清的RMPI 1640培養(yǎng)液內,在37℃、含5% CO2的飽和濕度空氣中培養(yǎng)。
1.3MTT法檢測癌細胞存活率 接種A549細胞于96孔培養(yǎng)板,確定每孔含細胞2 000個。細胞貼壁后換液,并設下列實驗組:對照組、GSH 100、300、900 μg/ml、阿霉素1.5 μg/ml、GSH 100 μg/ml+阿霉素1.5 μg/ml、GSH 300 μg/ml+阿霉素1.5 μg/ml、GSH 900 μg/ml+阿霉素1.5 μg/ml。實驗組每個劑量設8個平行孔,陰性對照組同樣設8孔。經24、48、72 h培養(yǎng)后,加MTT染液(MTT終濃度為0.5 mg/ml)繼續(xù)培養(yǎng)4 h,棄上清,每孔加DMSO 100 μl,震蕩5 min后以酶標儀檢測波長570 nm處吸光度,計算腫瘤細胞存活率。
1.4采用血球計數板檢測癌細胞存活率 由于高濃度GSH可以使MTT還原為水不溶性的藍紫色結晶甲臜(Formazan)造成假陽性,因此當按下列方法處理細胞時采用血球計數板檢測癌細胞存活率:陰性對照組、GSH 1 000、3 000、9 000 μg/ml、阿霉素1.5 μg/ml、1 000 μg/ml+ 阿霉素1.5 μg/ml、3 000 μg/ml+阿霉素1.5 μg/ml、GSH 9 000 μg/ml+阿霉素1.5 μg/ml。經30 h培養(yǎng)后,檢測細胞存活情況。
1.5流式細胞儀檢測細胞內ROS、細胞凋亡 接種細胞于6孔細胞培養(yǎng)板,細胞貼壁后按下述方法處理:陰性對照、GSH 9 000 μg/ml、阿霉素1.5 μg/ml、GSH 9 000 μg/ml + 阿霉素1.5 μg/ml。24 h培養(yǎng)后,按試劑盒說明書檢測細胞內ROS生成及細胞凋亡水平。
1.6Western印跡檢測 接種細胞于6孔細胞培養(yǎng)板,細胞貼壁后按下述方法處理:陰性對照、GSH 9 000 μg/ml、阿霉素1.5 μg/ml、GSH 9 000 μg/ml + 阿霉素1.5 μg/ml。24 h培養(yǎng)后收集細胞,并按照蛋白提取試劑盒所附操作指南提取細胞蛋白,以蛋白定量試劑盒測定所提蛋白濃度,分裝后冷凍保存。SDS-PAGE電泳,轉膜,封閉1 h 后加一抗,4℃孵育過夜;洗膜后加二抗,室溫孵育1 h;洗膜、曝光顯影。
1.7統(tǒng)計學方法 采用SPSS12.0軟件進行單因素方差分析。
2 結 果
2.1100、300、900 μg/ml的GSH單獨或聯(lián)合阿霉素對A549增殖活性的影響 100、300、900 μg/ml的GSH單獨或聯(lián)合阿霉素處理24 h、48 h及72 h,對A549增殖活性均無顯著性影響(表1)。

表1 各劑量GSH單獨或聯(lián)合阿霉素處理對A549細胞活性的影響±s,%,n=8)
2.21 000、3 000、9 000 μg/ml的GSH單獨或聯(lián)合阿霉素對A549增殖活性的影響 1 000、3 000、9 000 μg/ml的GSH單獨處理30 h細胞活性為(74.5±7.6、76.7±6.7、78.6±6.3),與對照組(100±5.6)相比,可顯著抑制A549的增殖活性(P<0.05);1 000、3 000、9 000 μg/ml的GSH與阿霉素聯(lián)用30 h(46.8±2.4、49.22±3.2、46.9±1.9),并不能顯著改變阿霉素(39.2±2.5)對A549細胞的殺滅效果。
2.39 000 μg/ml的GSH單獨或聯(lián)合阿霉素對A549內ROS生成的影響 阿霉素處理24 h,有ROS生成的A549 細胞比例(9.7±0.9)與對照組(0.8±0.3)相比顯著升高,而單用9 000 μg/ml GSH(0.6±0.2)及與阿霉素聯(lián)用(5.0±0.6),可顯著降低有ROS生成的A549細胞比例。
2.49 000 μg/ml的GSH單獨或聯(lián)合阿霉素對A549細胞凋亡的影響 與對照組(82.7± 5.8)%相比阿霉素可顯著降低活的A549細胞百分比(57.8±7.7)%,即可顯著提高壞死、死亡、晚期凋亡及早期凋亡細胞的百分比;9 000 μg/ml GSH(65.8±5.7)%與阿霉素聯(lián)用(73.5±6.6)%并不能改變阿霉素所造成的活的A549細胞百分比的降低。
2.59 000 μg/ml的GSH單獨或聯(lián)合阿霉素對A549細胞內p53表達的影響 GSH、阿霉素單獨或聯(lián)用對p53蛋白表達均無影響(圖1)。
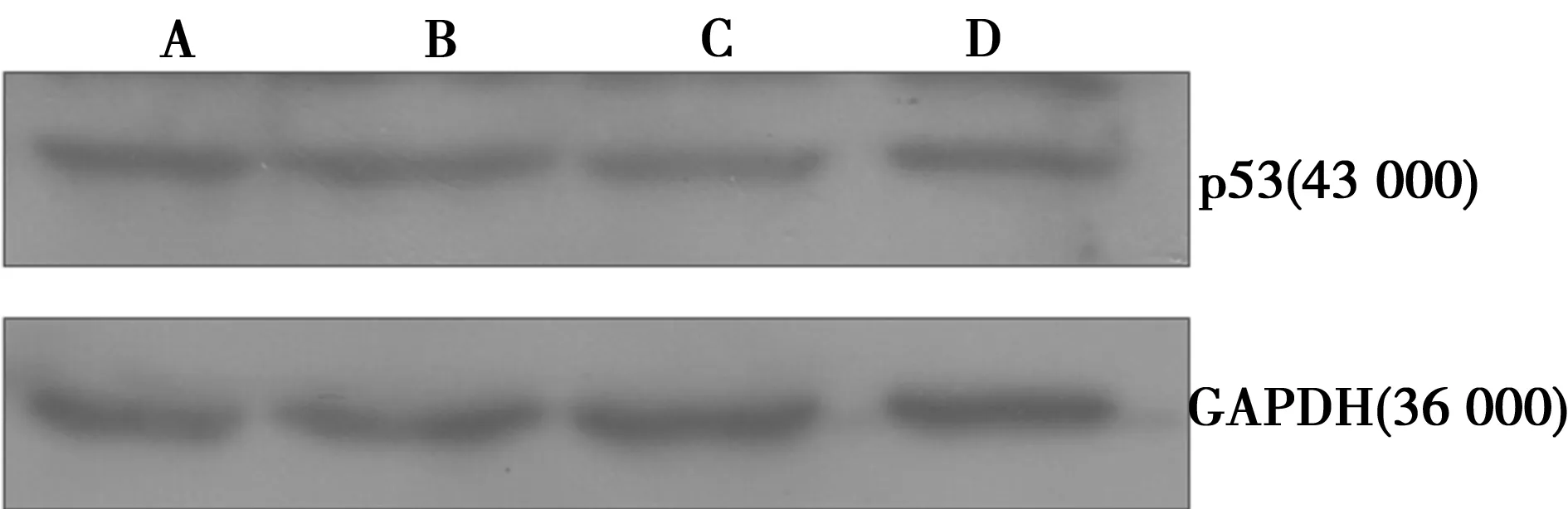
A.對照組;B.GSH 9 000 μg/ml;C.阿霉素1.5 μg/ml;D.GSH 9 000 μg/ml+阿霉素1.5 μg/ml
3 討 論
一個理想的阿霉素化學保護劑,除了可以減少心臟毒性等毒副作用外,還需不影響阿霉素的抗癌作用。在本研究中,包括極高濃度在內的各濃度的GSH與阿霉素聯(lián)用,均不影響阿霉素對肺癌細胞的殺滅效果。3個極高濃度的GSH單獨處理均可顯著抑制肺癌細胞的增殖活性。ROS過度生成被發(fā)現在幾乎所有癌細胞內,并通過調控與增殖有關的相關基因促進癌細胞的存活〔12,13〕。因此存在這種可能,GSH通過降低癌細胞內ROS水平,間接地抑制了促進癌細胞增殖、存活的基因的表達,從而實現了其抑制癌細胞增殖活性的效果。
本研究提示GSH具有較佳的抗氧化作用。為了進一步探討GSH與阿霉素聯(lián)用可能對肺癌細胞的影響,本研究采用流式細胞術分析了極高濃度GSH對A549細胞凋亡的影響。結果表明,GSH與阿霉素聯(lián)用與阿霉素單獨處理相比較,活的肺癌細胞百分率并沒有顯著差異,從而從另一個角度證明了GSH不影響阿霉素對肺癌細胞的殺滅效果。此外,有研究表明,阿霉素可活化肺癌細胞p53蛋白〔14〕,但是在本研究中,GSH、阿霉素單獨或聯(lián)用對p53蛋白表達均無顯著影響。
本研究結果表明阿霉素對腫瘤細胞的細胞毒性幾乎與其誘導的ROS生成無關,該毒性應該主要是通過嵌入迅速增殖的腫瘤細胞堿基對并阻止DNA復制而實現的〔8〕。
綜上所述,GSH具有較佳的抗氧化作用,GSH即使在極高濃度的情況下也不影響阿霉素對體外肺癌細胞的殺滅效果,提示GSH作為阿霉素化學保護劑的潛在可能性。進一步的研究還需在體內驗證上述結果,并檢測GSH對外心肌細胞的保護作用。
4 參考文獻
1Hande KR.Clinical applications of anticancer drugs targeted to topoisomerase Ⅱ〔J〕.Biochim Biophys Acta,1998;1400(1-3):173-84.
2Reeve JL,Szegezdi E,Logue SE,etal.Distinct mechanisms of cardiomyocyte apoptosis induced by doxorubicin and hypoxia converge on mitochondria and are inhibited by Bcl-xL〔J〕.J Cell Mol Med,2007;11(3):509-20.
3Chaiswing L,Cole MP,St Clair DK,etal.Oxidative damage precedes nitrative damage in adriamycin-induced cardiac mitochondrial injury〔J〕.Toxicol Pathol,2004;32(5):536-47.
4Aldieri E,Bergandi L,Riganti C,etal.Doxorubicin induces an increase of nitric oxide synthesis in rat cardiac cells that is inhibited by iron supplementation〔J〕.Toxicol Appl Pharmacol,2002;185(2):85-90.
5Singal PK,Li T,Kumar D,etal.Adriamycin-induced heart failure:mechanism and modulation〔J〕.Mol Cell Biochem,2000;207(1-2):77-86.
6Singal PK,Iliskovic N.Doxorubicin-induced cardiomyopathy〔J〕.N Engl J Med,1998;339(13):900-5.
7Wang WC,Uen YH,Chang ML,etal.Protective effect of guggulsterone against cardiomyocyte injury induced by doxorubicin in vitro〔J〕.BMC Complement Altern Med,2012;12(1):138.
8Lai HC,Yeh YC,Wang LC,etal.Propofol ameliorates doxorubicin-induced oxidative stress and cellular apoptosis in rat cardiomyocytes〔J〕.Toxicol Appl Pharmacol,2011;257(3):437-48.
9Kang JY,Costyn LJ,Nagy T,etal.The antioxidant phenylaminoethyl selenide reduces doxorubicin-induced cardiotoxicity in a xenograft model of human prostate cancer〔J〕.Arch Biochem Biophys,2011;515(1-2):112-9.
10Chang WT,Li J,Haung HH,etal.Baicalein protects against doxorubicin-induced cardiotoxicity by attenuation of mitochondrial oxidant injury and JNK activation〔J〕.J Cell Biochem,2011;112(10):2873-81.
11Zheng J,Lee HC,Bin Sattar MM,etal.Cardioprotective effects of epigallocatechin-3-gallate against doxorubicin-induced cardiomyocyte injury〔J〕.Eur J Pharmacol,2011;652(1-3):82-8.
12Liou GY,Storz P.Reactive oxygen species in cancer〔J〕.Free Radic Res,2010;44(5):479-96.
13Fang J,Seki T,Maeda H.Therapeutic strategies by modulating oxygen stress in cancer and inflammation〔J〕.Adv Drug Deliv Rev,2009;61(4):290-302.
14Kawakami K,Nishida H,Tatewaki N,etal.Persimmon leaf extract inhibits the ATM activity during DNA damage response induced by Doxorubicin in A549 lung adenocarcinoma cells〔J〕.Biosci Biotechnol Biochem,2011;75(4):650-5.

