胃癌中 TGFβ1 ,Smad3,Smad7蛋白的表達及意義
張德利 馬 艷 李春輝
(承德醫學院附屬醫院,河北 承德 067000)
胃癌的發生是一個多因素、多步驟的過程,涉及多方面機制。研究表明轉化生長因子(TGFβ)/Smads信號通路中任何一個環節出現異常都可能導致信號轉導的紊亂,從而導致胃癌的發生與發展。本研究分析TGFβ1、Smad3、Smad7表達與胃癌分化程度、淋巴結轉移的關系。
1 材料與方法
1.1研究對象 收集我院2011年12月至2012年9月手術治療后經病理證實的組織標本60例,正常胃組織20例(距離腫瘤10 cm以上認為正常胃組織)。60例胃癌患者中,男38例,女22例,年齡43~77〔平均(54.8±9.7)〕歲;其中低分化32例,高中分化28例;有淋巴結轉移35例,無淋巴結轉移25例。
1.2TGFβ1、Smad3、Smad7蛋白檢測 兔抗人TGFβ1、Smad3和Smad7 多克隆抗體購自武漢博士德公司,即用型快捷免疫組化MaxVision試劑盒羊抗鼠/兔購自福州邁新生物技術開發有限公司(KIT-5010),免疫組化操作步驟嚴格按照試劑盒說明書進行以磷酸鹽緩沖液(PBS)代替一抗作陰性對照,已知陽性切片作陽性對照。
1.3判定方法 光鏡下觀察切片中TGFβ1、Smad3和Smad7的表達和分布情況,每張切片選取5個高倍視野。TGFβ1 蛋白主要分布于細胞的胞質、呈棕黃色。Smad3和Smad7蛋白分布于細胞的胞質,胞核, 呈棕黃色顆粒。采用二級計分法判定結果:按染色強度分級,淡黃為1 分,黃或深黃2 分,褐或棕黃3分;陽性細胞計數<10%為0分,10%~25%為1分,25%~50%為2分,50%~75 %為3分,> 75 %為4分; 兩者相加<2分為陰性(-);2~3分陽性(+);4~5分中等陽性();6~7分強陽性()。結果判定由兩名病理醫師經雙盲法獨立評分。
1.4統計學方法 應用SPSS11.5軟件進行分析,等級資料采用秩和檢驗。
2 結 果
見圖1,表1。在胃癌組織中,TGFβ1、Smad7的表達明顯高于正常胃組織對照組(P<0.05),Smad3的表達明顯低于正常胃組織對照組(P<0.05)。TGFβ1、Smad3、Smad7的表達與胃癌的分化程度、有無淋巴結轉移有關。

TGFβ1,正常胃組織

TGFβ1,低分化胃癌組織
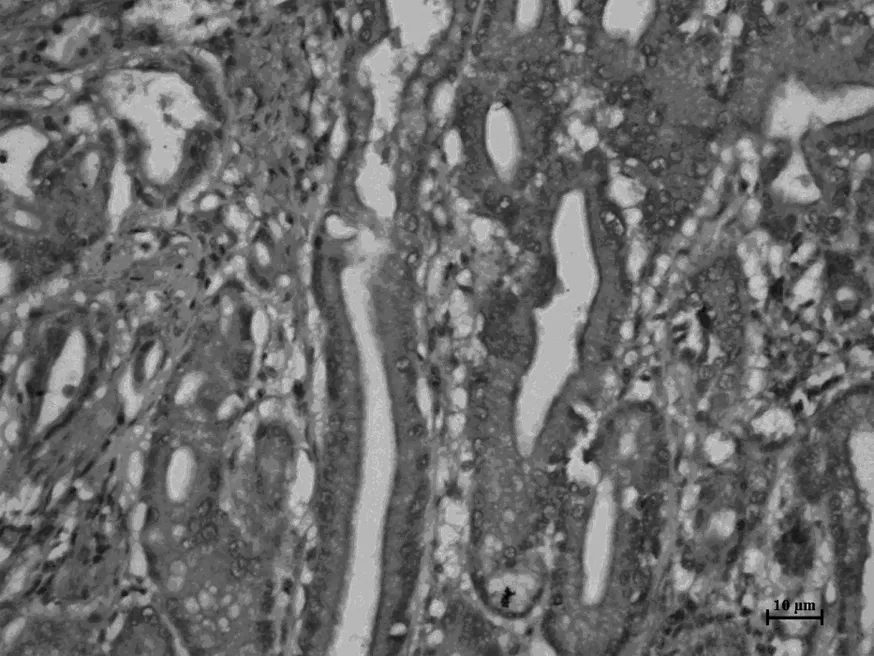
Smad3,正常胃組織

Smad3,高中分化胃癌組織

Smad3,低分化胃癌組織
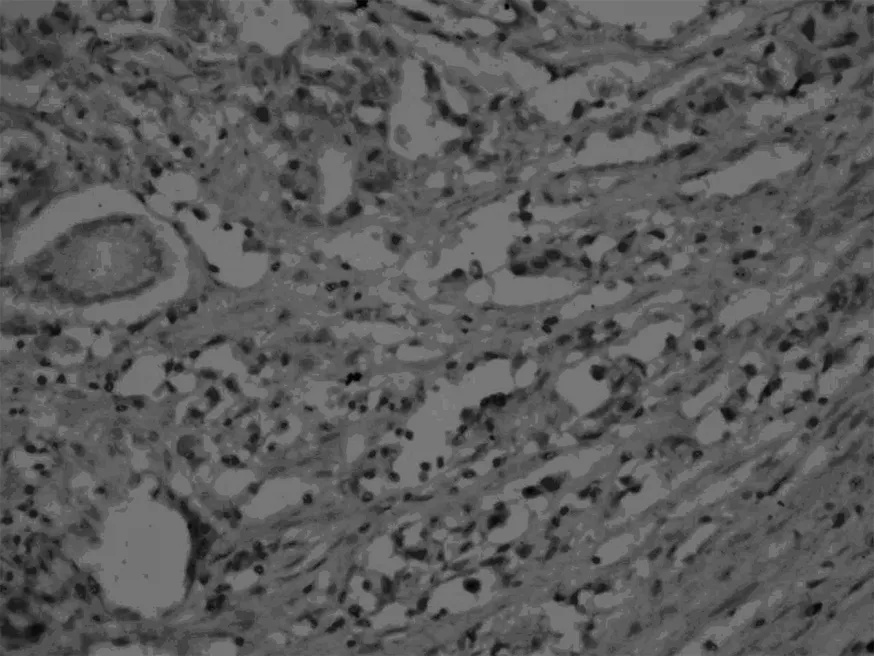
Smad7,正常胃組織
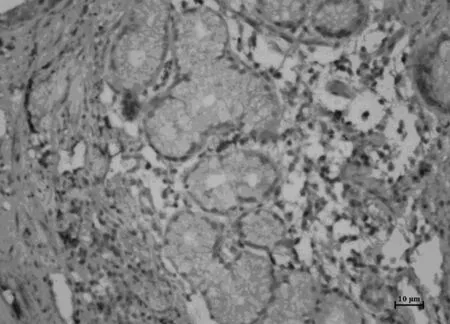
Smad7,高中分化胃癌組織
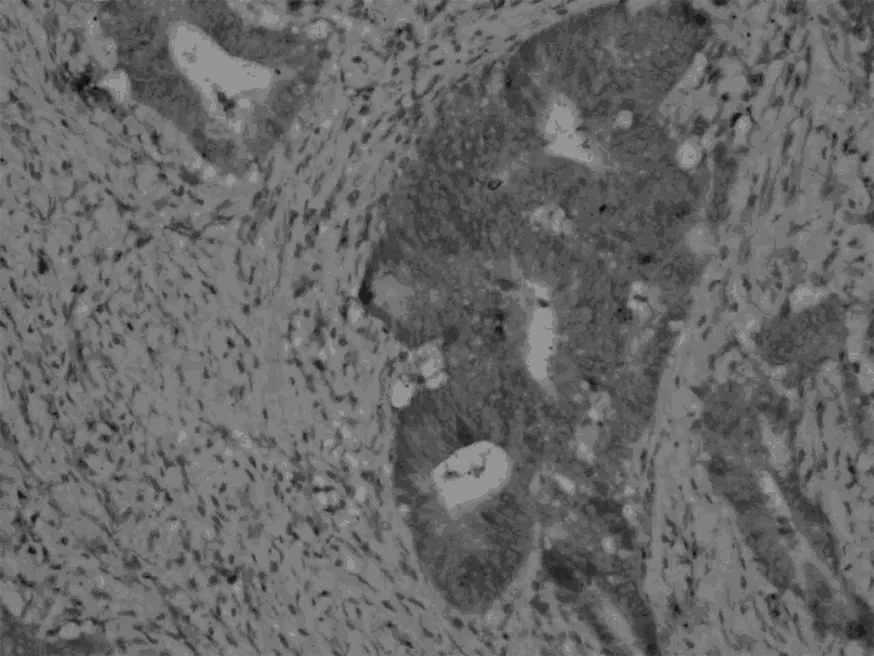
Smad7,低分化胃癌組織
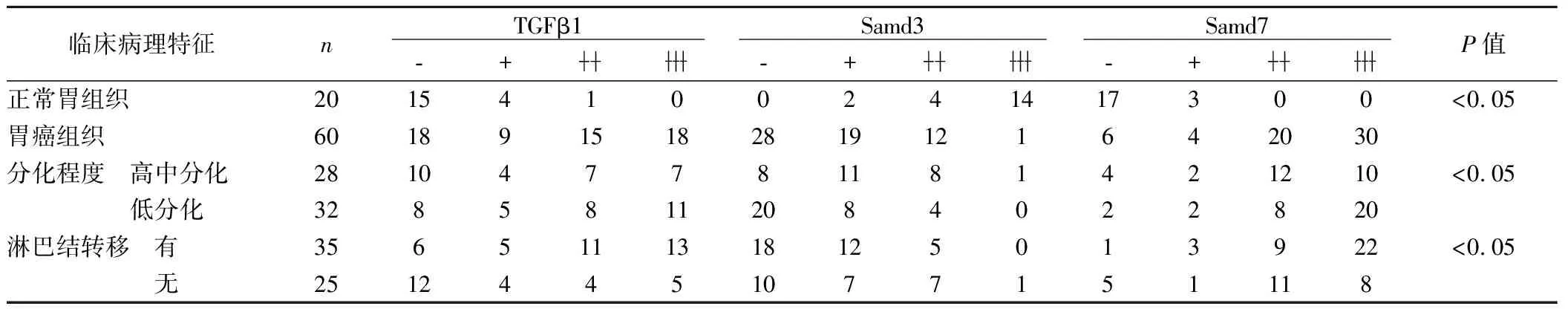
表1 TGFβ1、Smad3、Smad7的陽性表達在不同臨床病理特征中的關系
3 討 論
TGFβ是細胞生長的有效調節因子。在腫瘤發生的早期階段,轉化的細胞部分甚至完全抵抗TGFβ的生長抑制作用,導致腫瘤的發生。在腫瘤發展的晚期階段,TGFβ促進腫瘤細胞生長、浸潤、轉移。有研究報道,在乳腺癌的發展進程中, TGFβ可從抑癌因子轉變為促進癌轉移的因子;Smad2/3表達降低,雖然促進了腫瘤的形成,同時也抑制了腫瘤的轉移,提示Smads信號在腫瘤轉移中的作用〔1,2〕。
TGFβ1是TGFβ家族的主要成員,是調節正常細胞生長以及各種生物學功能的主要細胞因子,文獻報道 TGFβ1在乳腺癌、結腸癌、前列腺癌等惡性腫瘤中呈過度表達,其過度表達在腫瘤轉化、進展中起重要作用,與預后相關〔3,4〕。
本實驗研究發現胃癌組織TGFβ1呈過表達狀態,隨著胃癌臨床病理分期的進展以及淋巴結轉移,TGFβ1表達逐漸加強,提示TGFβ1有可能促進胃癌的進展。這與Naef等〔5〕的研究結果一致。另外TGFβ1在腫瘤中高表達的原因還可能由于胃癌組織細胞失去了對TGFβ1的敏感性,導致TGFβ1的反饋性表達升高。
TGFβ/Smads信號傳導途徑調節細胞生長的基本過程: TGFβ配體→TGFβ受體→Smads 蛋白→轉錄因子→DNA 表達。傳導途徑中任一部分的變化都可能引起信號轉導的紊亂,最終導致腫瘤發生。Smads蛋白是TGFβ/Smads信號途徑的關鍵分子,Smads具有核轉位功能和轉錄活性。Smad3是通路特異性Smad 蛋白,與Ⅰ型受體識別,使之磷酸化,能夠被TGFβ1受體識別,生成復合物,由胞質轉移至胞核,調節基因轉錄〔6〕。盡管在人類惡性疾病中未找到Smad3的突變,但Smad3抑制子對Smad3表達調節的紊亂將有助于Smad3的功能性滅活,一旦Smad3活性受到抑制,就為腫瘤細胞提供了一個選擇性生長優勢。因此,有人認為Smad3在TGFβ信號通路中有抑癌基因的作用。
Smad7是抑制性蛋白,與TGFβⅠ型受體結合,與通路特異性Smad3 蛋白競爭結合位點,從而對該通路進行負向調節,阻止受體Smads(R-smads)磷酸化,未磷酸化的R-smads不能同通用Smad(Smad4)結合形成異源復合物,進而不能轉位到細胞核調控靶基因的轉錄。研究結果顯示,Smad7也可通過抑制Smad3的活化、Smad3/Smad4異源復合物的形成及核轉位,從而拮抗TGFβ對細胞的生長抑制效應。原因在于Smad3功能受高表達Smad7抑制,不能有效啟動介導生長終止基因的轉錄,使細胞生長發生紊亂,從而有可能向惡性化發展〔7,8〕。
近來的報道顯示,Smad7基因擴增與胃癌、結腸癌患者的預后不良有著密切的關系。表明TGFβ信號轉導抑制因子Smad7過表達是腫瘤細胞抵抗TGFβ生長抑制作用的機制之一〔9,10〕,有研究〔11〕顯示胰腺癌中Smad7表達上調,并且轉染了Smad7基因的胰腺癌細胞惡性程度增高,裸鼠成瘤能力增強,提示Smad7表達上調有助于惡性腫瘤的發生。
綜上所述,Smad7蛋白在胃癌組織中表達上調,Smad3蛋白在胃癌組織中表達下調,且與胃癌分化程度密切相關。同時也表明Smad3、Smad7對維護TGFβ1/Smads信號通路的平衡至關重要。
4 參考文獻
1Tang B, Vu M, Booker T,etal.TGF-β switches from tumor suppressor to prometastatic factor in a model of breast cancer progression〔J〕.J Clin Invest,2003;112(7):1116-24.
2Tian F, DaCosta-Byfield S, Parks WT,etal.Reduction in Smad2/3 signaling enhances tumorigenesis but suppresses metastasis of breast cancer cell lines〔J 〕 .Cancer Res,2003;63(23):8284-92.
3Wikstrom P,Damber J,Bergh A.Role of transforming growth factor-beta1 in prostate cancer〔J〕. Microsc Res Tech,2001;52(4):411-9.
4Ghellal A,Li C,Hayes M,etal. Prognostic significance of TGF beta 1 and TGF beta 3 in human breast carcinoma〔J〕. Anticancer Res,2000;20(6B):4413-8.
5Naef M,Ishiwata T,Friess H,etal.Differential localization of TGF beta isoforms in human gastric mucosa and overexpression in gastric carcinoma〔J〕.Int J Cancer,1997;71(2):131-7.
6申漫里, 馮永東, 高 純,等.細胞周期蛋白β1在腫瘤細胞中的非時相性表達〔J〕.中華腫瘤雜志,2002;24(2):215.
7Flanders KC.Smad3 as a mediator of the fibrotic response 〔J〕.Int J Exp Pathol,2004;85(2):47-64.
8Monteleone G,Kumberova A,Croft NM,etal.Blocking Smad7 restores TGF-beta1 signaling in chronic inflammatory bowel disease 〔J〕.J Clin Invest,2003;108(4):601-9.
9Kim YH,Lee HS,Lee HJ,etal.Prognostic significance of the expression of smad4 and smad7 in human gastric carcinomas〔J〕.Ann Oncol,2004;15(4):574-80.
10Boulay JL,Mild G,Lowy A,etal.Smad7 is a prognostic marker in patients with colorectal cancer〔J〕.Int J Cancer,203;104(4):446-9.
11Piek E,Westernmark U,Kastemar M,etal.Expression of TGF-beta recptors and Smad proteins in glioblastoma cell lines with distinct responses to TGF-beta1 〔J〕.Cancer,1999;80(5):756-63.

