牙齦卟啉單胞菌脂多糖和白細胞介素-10對高脂血癥兔肺巨噬細胞SR-A表達的影響
劉崇武, 吳春芳, 駱 凱, 李艷芬, 閆福華
牙周病是最常見的口腔疾病之一,菌斑微生物是造成牙周組織病理變化的始動因子,且其本身及其釋放的代謝產物如內毒素等又可以通過多種途徑播散到宿主全身其他器官,作為一些疾病的獨立或高危因子而受到多學科的廣泛關注。近年來學者們陸續在冠心病患者的心血管壁上找到了與牙周致病菌相關的DNA蹤跡及一些主要致病物質,如慢性牙周炎的主要致病菌牙齦卟啉單胞菌(Porphyromonas gingivalis,Pg)可以沉積于動脈粥樣硬化(atherosclerosis, AS)粥樣斑塊中,促進低密度脂蛋白的氧化和聚集,加快泡沫細胞形成[1-3]。2005年,Brodala等通過動物實驗證實Pg引起的菌血癥可以誘導正常和高膽固醇水平豬冠狀動脈血栓和AS的形成[4]。
肺泡巨噬細胞(alveolar macrophages,AM)是AS發生、發展過程中機體行使免疫防御和炎癥反應的主要介質,幾乎參與粥樣斑塊形成的整個病理過程[5-6]。AM表面的清道夫受體-A(SR-A)是結合和降解AS形成過程中氧化低密度脂蛋白(oxidized low density lipoprotein cholesterol,oxLDL)的重要受體,與脂質代謝、脂多糖(lipopolysaccharide,LPS)的清除等密切相關[7]。白細胞介素-10(interleukins-10,IL-10)是近年來研究最為廣泛的一種抗炎因子,具有抑制粥樣斑塊形成、穩定斑塊的作用[8-9]。
本實驗通過比較健康和高脂血癥兔肺來源AM在牙齦Pg-LPS作用下膜表面SR-A的表達變化以及IL-10對其的調控作用,以期為研究牙周病與AM的相關性提供細胞學證據。
1 材料與方法
1.1動物 健康成年新西蘭兔12只[中科院上海研究所實驗動物中心,許可證號:SCXK(滬)2007-0007],2.0~2.5 kg,3~4月齡,雌雄不限,喂養于中國人民解放軍南京軍區福州總醫院比較醫學科。
1.2試劑與儀器 RPMI 1640粉(美國Gibco公司),胎牛血清(美國Hyclone公司),肝素鈉(上海信宜制藥),IL-10(英國Pepro Tech公司),Pg-LPS及Real-time PCR反應體系中各試劑(美國Invitrogen公司)。CO2培養箱(BB16)及臺式離心機(Labofuge 400R)(德國Heraeus公司),QPCR儀(7500 fast,美國Applied Biosystems公司)。
1.3方法
1.3.1高脂血癥新西蘭兔模型的建立 新西蘭兔12只單個分籠飼養于25 ℃、70%濕度的環境中,保持室內自動通風,適應1周后隨機編號分為對照組和高脂模型組,分別予基礎飼料和高脂飼料喂養。參照文獻[10],飼料配方為基礎飼料+1%膽固醇+5%豬油+15%鮮蛋黃,每只100~120 g/d,自由飲水,喂飼6周后空腹抽取兔耳緣靜脈血,檢測血脂各項指標,包括血清總膽固醇、甘油三酯、高密度脂蛋白膽固醇和低密度脂蛋白膽固醇,證實高脂血癥新西蘭兔模型已成功建立。
1.3.2細胞的分離與培養 將2組實驗兔通過耳緣靜脈注射空氣處死,提起氣管無菌分離出肺,生理鹽水沖洗表面去除血污,無菌紗布吸去多余水分后,注射器沿氣管緩慢注入4 ℃預冷的灌洗液40 mL(生理鹽水+10 U/mL肝素鈉),輕柔晃動兔肺5 min,回收灌洗液于50 mL離心管,并重復灌洗1次,2次所得細胞灌洗液4 ℃離心,沉淀用RPMI 1640洗滌離心2次,1 500 r/min,10 min。收集的細胞沉淀用RPMI 1640+20% FBS培養液重懸,37 ℃、體積分數0.05的CO2培養箱中培養2~4 h,AM貼壁后,換RPMI 1640+10% FBS培養液進行常規培養。
1.3.3分組與細胞準備 將所得的6只健康和6只高脂兔AM分別消化并接種于六孔板,每孔1×106,對照組、1 μg/mL Pg-LPS組、1 μg/mL Pg-LPS+0.1 μg/mL IL-10組均重復3孔,培養24 h,換RPMI 1640+1% FBS培養液使其饑餓同步化2 h。隨后參照文獻[11-13],根據實驗分組,先加入IL-10,使其終濃度為0.1 μg/mL,2 h后于相應實驗組加入Pg-LPS,終濃度為1 μg/mL,作用24 h后按照試劑盒說明使用TRIZOL試劑裂解細胞,用1.5 mL無菌Eppendorf管分裝,冷凍保存于-70 ℃冰箱備用。
1.3.4實時熒光定量PCR(Real-time PCR) 按照試劑盒說明書操作進行RNA抽提和反轉錄,合成第一鏈cDNA,隨后進行熒光定量PCR檢測。采用Primer Premier 5.0軟件設計引物序列:
目的基因:
SR-A-F:5′-GGTCCTCCTGGACCCCCAGGA-3′
SR-A-R:5′-CAGGATGCTTCCACTGCCT-3′
管家基因:
rabbit-actin(737 bp):5′-TGGACTTCGAGCAGGAGA
TG-3′
rabbit-actin(943 bp):5′-GGATGTCCACGTCGCACT
T-3′
片段大小206 bp,由上海生工生物工程有限公司合成。PCR循環條件:95 ℃預變性2 min,40個循環(95 ℃ 10 s→60 ℃ 30 s→70 ℃ 45 s),70 ℃延伸10 min。
1.4統計學處理 分別對各樣品目的基因和管家基因進行Realtime PCR反應。機器根據繪制的梯度稀釋DNA標準曲線,直接生成各樣品目的基因和管家基因的濃度。計算基因的相對表達量:
F=2—△△Ct
△△Ct=(待測樣品目的基因的Ct平均值-待測樣本看家基因的Ct平均值)-(對照樣品目的基因的Ct平均值-對照樣本看家基因的Ct平均值)
2 結 果
2.1培養的AM細胞 倒置相差顯微鏡下觀察,AM呈圓形或卵圓形,不易增殖,體外可培養7~10 d,貼壁不牢固,換液可使部分細胞浮起。健康兔AM周邊或兩極可見細小偽足(圖1A)。而高脂血癥兔AM部分細胞胞質內可見空泡,偽足更為細長,呈成纖維樣生長(圖1B)。
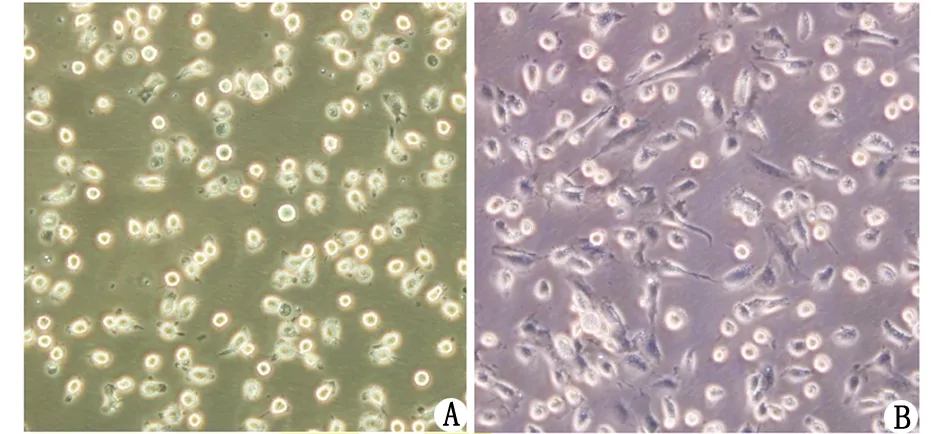
A:健康兔肺泡巨噬細胞周邊或兩極可見細小偽足;B:高脂兔肺巨噬細胞部分細胞胞質內可見空泡,偽足更為細長,呈成纖維樣生長.
2.2SR-A的基因表達 根據Real-time PCR結果,分別計算健康和高脂兔各實驗組SR-A基因的相對表達量(表1)。統計分析表明,各高脂組SR-A基因的表達量均高于健康組(P<0.05);健康及高脂血癥Pg-LPS組SR-A的表達均較對照組明顯升高(P<0.05),且高脂Pg-LPS組較健康Pg-LPS組升高更為顯著;在增加IL-10后,健康組SR-A的表達高于單純Pg-LPS組(P<0.05),高脂組SR-A的表達則低于單純Pg-LPS組(P<0.05)。

表1 SR-A基因表達水平
3 討 論
牙周病和AS心血管疾病都是與機體免疫調控功能失衡有關的慢性炎癥性疾病[14-15],在人群中分布廣泛。感染和炎癥是兩者共同的危險因素,已有的研究表明牙周感染可使機體的脂代謝紊亂,導致血脂水平升高,進而增加冠心病發生的風險[16]。
學者們普遍認可AS是脂質和炎癥共同作用的結果[17]。AS病損早期,血液中膽固醇增高、脂質代謝紊亂,LDL大量被氧化修飾成oxLDL,oxLDL逐漸向受損動脈血管內膜中沉積;隨后,機體募集血液中的單核細胞遷移入內膜,使其激活并分化為AM;AM協同血管內皮細胞和平滑肌細胞通過表面受體SR-A識別并攝入oxLDL,引發一系列免疫防御和慢性炎癥反應,促進了AS發生和發展[18]。oxLDL與SR-A的結合是AM成為泡沫細胞的前提,被認為是AS病理進程中的關鍵步驟[19]。實驗結果顯示,在沒有脂多糖等參與下,高脂兔對照組SR-A的表達顯著高于健康對照組。
SR-A是廣泛分布于AM等非特異性免疫細胞表面的一類模式識別受體,其配體具有廣泛性,如oxLDL、LPS、磷壁酸、多聚核苷酸等。一方面,SR-A可以結合、內移、清除LPS,使AM起到抗炎和防御性免疫作用[20]。本實驗中,健康兔AM在Pg-LPS的作用下,SR-A的表達明顯升高,與文獻報道一致[21]。另一方面,在AS病理過程中,AM上的SR-A可以不受胞內脂質的負反饋調節無限制地攝入oxLDL,從而導致細胞內膽固醇堆積并逐漸分化為AM源性泡沫細胞[22]。實驗中,高脂狀態下兔AM受Pg-LPS刺激SR-A的表達是高脂空白組的3.5倍,是健康兔Pg-LPS組的7倍。因而推測,牙周致病菌Pg-LPS可以通過刺激AM升高SR-A的表達,從而促進AS的形成。
此外,實驗中加入IL-10后,健康組SR-A的表達明顯高于單純Pg-LPS組,高脂組SR-A的表達則明顯低于單純Pg-LPS組,符合文獻報道的IL-10具有廣泛的抗炎和抗脂質代謝的作用[8-9]。
因此,牙周致病菌Pg-LPS誘導的AM膜受體SR-A表達的升高可能是牙周炎促進AS形成的一條重要細胞學途徑,其作用機理尚有待進一步研究。
參考文獻:
[1] Kuramitsu H K, Qi M, Kang I C,etal. Role for periodontal bacteria in cardiovascular diseases[J].AnnPeriodontol, 2001,6(1):41-47.
[2] Qj M, Miyakawa H, Kuramitsu H K. Porphyromonas gingivalis induces murine macrophage foam cell formation[J].MicrobPathog, 2003,35(6):259-267.
[3] Giacona M B, Papapanou P N, Lamster I B,etal. Porphyromonas gingivalis induces its uptake by human macrophages and promotes foam cell formationinvitro[J].FEMSMicrobiolLett, 2004,241(1):95-101.
[4] Brodala N, Merricks E P, Bellinger D A,etal. Porphyromonas gingivalis bacteremia induces coronary and aortic atherosclerosis in normocholesterolemic and hypercholesterolemic pigs[J].ArteriosclerThrombVascBio1, 2005,25(7):1446-1451.
[5] Wilcox J N, Nelken N A, Coughlin S R,etal. Local expression of inflammatory cytokines in human at herosclerotic plaques[J].JAtherosclerThromb, 1994,1 (Suppl 1):10-13.
[6] Ross R. Atherosclerosis -an inflammatory disease[J].NEnglJMed, 1999,340(2):115-126.
[7] Jozefowski S. The role of the class A scavenger receptors, SR-A and MARCO, in the immune system[J].PostepyHigMedDosw(Online), 2012,66:104-131.
[8] Rubic T, Lorenz R L. Downregulated CD36 and oxLDL uptake and stimulated ABCA1/G1 and cholesterol efflux as anti-atherosclerotic mechanisms of interleukin-10[J].CardiovascRes, 2006,69:527-535.
[9] 周悠嵐, 桂慶軍. 白細胞介素-10及其基因多態性與冠心病的相關研究[J]. 中國現代醫藥雜志, 2011,l3(12):116-118.
[10] 吳春芳, 閆福華. 牙周致病菌Pg-LPS對組織特異性單核/巨噬細胞膜表面受體表達影響的研究[D]. 福建醫科大學, 2011.
[11] Zhang D, Chen L, Li S,etal. Lipopolysaccharide (LPS) of Porphyromonas gingivalis induces IL-1, TNF-α and IL-6 production by THP-1 cells in a way different from that of Escherichia coli- LPS[J].InnateImmunity, 2008,14(2):99-107.
[12] Cazalis J, Bodet C, Gagnon G,etal. Doxycycline reduces lipopolysaccharide-induced inflammatory mediator secretion inmacrophage andexvivohuman whole blood models[J].JPeriodontol, 2008,79(9):1762-1768.
[13] 單佑安, 秦文利, 蔣建新, 等. IL-10對小鼠肺泡巨噬細胞清道夫受體及CD14表達的影響[J].基礎醫學與臨床, 2003,23(1):44-47.
[14] Libby P. Inflammation in atherosclerosis[J].Nature, 2002,420(6917):868-874.
[15] 戴曉瑋, 鐘良軍. 慢性牙周炎伴冠心病患者動脈粥樣硬化斑塊中牙齦卟啉單胞菌牙齦素基因片段與牙周臨床指標的相關性[J]. 新疆醫科大學學報, 2013,36(5):644-647.
[16] Culter C W, Shinedling E A, Nunn M,etal. Association between periodontitis and hyperlipidemia: cause or effect[J]?JPeriodontol, 1999,70(12):1429-1434.
[17] Steinberg D. Atherogenesis in perspective: hypereholesterolemia and inflammation as partners in crime[J].NatMed, 2002,8(11):1211-l217.
[18] Tedgui A, Mallat Z. Cytokines in athemsclemsis:pathogenic and regulatory pathways[J].PhysiolRev, 2006,86(2):515-581.
[19] Kujathoor W, Febbraio M, Podrez E A,etal. Scavenger receptors class A-I/II and CD36 are the principal receptors responsible for the uptake of modified low density lipoprotein leading to lipid loading in macrophages[J].JBiolChem, 2002,277(51):49982-49988.
[20] Cotena A, Gordon S, Platt N. The class A macmphage scavenger receptor attenuates CXC chemokine production and the early infiltration of neutmphils in sterile peritonitis[J].JImmunol, 2004,173(10):6427-6432.
[21] 王 飛, 戴亞蕾, 徐 婷, 等. LPS和IL-10對低密度脂蛋白誘導泡沫細胞形成的影響[J]. 同濟大學學報:醫學版, 2007,28(1):1-5.
[22] Lam M C, Tan K C, Lam K S. Glycoxidized low-density lipopmtein regulates the expression of scavenger receptors in THP-1 macrophages[J].Atherosclerosis, 2004,177(2):313-320.

