應用里氏木霉發酵制備纖維素酶固體曲的研究
張 寧,蔣劍春,楊 靜,衛 民,趙 劍 ,童婭娟
(中國林業科學研究院林產化學工業研究所;生物質化學利用國家工程實驗室;國家林業局林產化學工程重點開放性實驗室;江蘇省生物質能源與材料重點實驗室,江蘇 南京 210042)
纖維素酶是一種多組分的復合酶,現在己經確定纖維素酶含有3種主要組分,即內切葡萄糖苷酶(EC3.2.1.4 EG)、外切葡萄糖苷酶(EC3.2.1.91CBH)和纖維二糖酶(EC3.2.1.21 BG)。在纖維素水解過程中首先由內切葡萄糖苷酶在纖維素鏈內部水解,降低其聚合度,然后由外切葡萄糖苷酶作用于非還原性末端釋放出纖維二糖;最后由纖維二糖酶將纖維二糖水解為葡萄糖[1]。有多種微生物能夠產生纖維素酶,例如好氧絲狀真菌,好氧放線菌,厭氧嗜熱細菌和厭氧真菌等[2]。迄今為止,產纖維素酶能力最強的常用的微生物是里氏木霉[3-4],其纖維素酶產量高,所產的纖維素酶是胞外酶,易與菌體分離純化而得到所需的酶,里氏木霉及其代謝產物安全無毒,不會影響生產人員和環境。利用纖維素酶轉化纖維素原料制糖,進而轉化為燃料乙醇、燃氣等能源物質已成為當今世界的研究熱點[5-6]。
固態發酵是一種具有節水、節能、產率高、排放低等獨特優勢的清潔生產技術,采用固態發酵技術生產纖維素酶比液體深層發酵具有較多優勢[7]:發酵環境更接近于自然狀態下的木霉生長習性,產生的酶系更全,有利于降解天然纖維素;固態發酵消耗能源少,設備投資相對減少;酶產品收率高,后續提取過程較液態發酵好處理[8]。故纖維素酶的工業化生產一般采用固態發酵法。
本文作者應用實驗室誘變篩選得到的纖維素酶高產突變株T.reesei150-1-1[9]發酵制備纖維素霉固體曲,研究固態發酵條件對產酶的影響并對其進行優化,從而為發酵制備纖維素酶固體曲提供技術依據。
1 實驗
1.1 菌種
纖維素酶高產菌株里氏木霉T.reesei150-1-1,本實驗室篩選獲得[9]。
1.2 固體培養基
馬鈴薯葡萄糖瓊脂(PDA)培養基。
1.3 固態發酵培養基
按不同質量比稱取原料麩皮和秸稈粉共10 g,添加不同體積的營養溶液,其組成為:硫酸銨1%,磷酸二氫鉀0.3%,硫酸鎂0.05%,并用檸檬酸緩沖液調節培養基至不同pH值,于121℃滅菌60 min,冷卻備用。
1.4 固態發酵產酶條件的確定
將用固體培養基培養得到的種子接入固態發酵培養基中進行固態發酵,依次考察麩皮與秸稈粉的配比、料液比、發酵時間、溫度和初始pH值對產酶的影響,并用其優化值逐個替代初始工藝中相應值,初步確定固態發酵條件。發酵結束后提取纖維素酶,并測定固體曲纖維素酶活力。每項試驗做3個平行樣,取平均值。然后通過3因素3水平正交試驗確定最佳產酶條件。
1.5 分析方法
1.5.1 粗酶的提取 取培養適當的纖維素酶固體曲5.0 g,加pH值為4.8的醋酸-醋酸鈉(HAC-NaAC)緩沖液45 mL,酶液浸提方法為:搖床上30℃浸提1 h,搖床轉數為95 r/min。之后用中速定性濾紙及真空泵抽濾,濾液即為用于測定的酶液。
1.5.2 纖維素酶活力的測定 還原糖法測定固體曲酶活力[10]。固體曲酶活力單位(U)定義為每小時產生1 μmoL還原糖(以葡萄糖計)所需酶量,樣品的酶活力用每克濕曲所含的酶活力單位數(U/g)表示。
2 結果與分析
2.1 纖維素酶固體曲發酵培養基組成的研究
2.1.1 麩皮與秸桿粉用量對產酶的影響 麩皮與秸稈粉用量對固體曲酶活力的影響實驗結果見圖1。結果表明固體曲纖維素酶活力隨著麩皮用量的增加、秸稈粉用量的減少先增加后略有降低,在麩皮與秸稈粉的比例為4∶1時酶活力達到最大值,與文獻[11]報道結果一致。這可能是由于麩皮中富含淀粉、纖維素、半纖維素、有機氮及生長因子,這些營養物質可促進菌絲的生長,其中纖維素和半纖維素對酶的合成具有誘導作用,而加入適量的秸稈粉增加了培養基中纖維素和半纖維素的含量,進一步誘導了纖維素酶的合成和分泌[12]。
2.1.2 培養基料液比對產酶的影響 不同料液比(質量比)對產酶影響的實驗結果見圖2,由圖2可知,培養基中的水分對固態發酵產酶有較大影響。水分少,菌絲體前期長勢良好,但后期生長所需水分和營養供應不足,纖維素酶活力下降;水分太多使得菌絲體前期陡長,形成孢子時間較長,同時透氣性下降,氧供給不足,影響菌體生長,也導致纖維素酶活力下降。在本研究中適宜T.reesei150-1-1產酶的料液比為 1∶2.5。

圖1 麩皮和秸桿粉用量對酶活力的影響Fig.1 Effect of ratio between wheat bran and straw powder on cellulase activities of solid koji
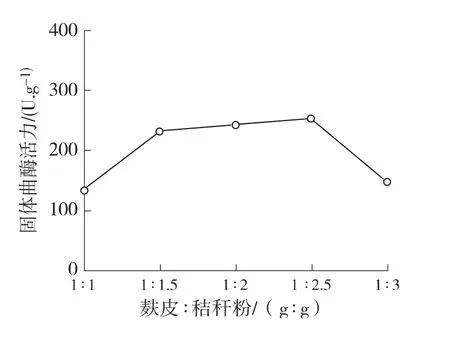
圖2 培養基料液比對酶活力的影響Fig.2 Effect of ratio of materials to liquid on cellulase activities of solid koji
2.2 纖維素酶固體曲發酵條件的研究
2.2.1 發酵時間對產酶的影響 T.reesei150-1-1發酵產纖維素酶需要一定的時間,從圖3可以看出,隨著發酵時間的延長,纖維素酶活力先慢慢增加;發酵時間為120 h時,纖維素酶活力達到最大值;再繼續延長發酵時間,纖維素酶活力顯著降低。這可能是由于培養基中營養成分耗盡,菌體停止代謝活動,有效發酵也就停止了。因此要得到酶活力較高的纖維素酶,控制發酵時間是關鍵環節。T.reesei150-1-1適宜發酵時間為120 h。
2.2.2 發酵溫度對產酶的影響 從圖4可以看出,溫度對固態發酵產纖維素酶也有影響。在溫度低于31℃的條件下,隨著溫度升高纖維素酶活力有所增大,31℃時纖維素酶活力達到最大,在高于31℃的條件下,纖維素酶活力則逐漸下降。微生物最適生長溫度可能是由溫度對生物體內無數個酶反應的綜合作用決定的,微生物在最適生長溫度以上生長速率降低,酶活力下降,可能是一些限速酶或其它酶的變性導致的。因此,對T.reesei150-1-1來說,適宜產酶的溫度為31℃。

圖3 發酵時間對酶活力的影響Fig.3 Effect of fermentation time on cellulase activities of solid koji
2.2.3 培養基初始pH值對產酶的影響 環境pH值可引起細胞膜電荷的變化,從而影響微生物對營養物質的吸收,影響代謝過程中酶的活性,改變營養物質的可給性和有害物質的毒性;而微生物代謝活動會改變環境pH值,所以培養基中往往要加緩沖劑。固體曲培養基用檸檬酸緩沖液調節初始pH值至4.2~6.6,考察初始pH值為 4.2、4.6、5.0、5.4、5.8、6.2 和 6.6 對固體曲酶活力的影響,實驗結果見圖5,發酵培養基初始pH值在4.2~5.0之間的條件下,隨著pH值的升高固體曲纖維素酶活力顯著增加;在pH值為5.0~6.6的條件下,隨著pH值升高,纖維素酶活則呈下降趨勢。在初始pH值為5.0時,T.reesei150-1-1產酶能力最強。

圖4 發酵溫度對酶活力的影響Fig.4 Effect of fermentation temperature on cellulase activities of solid koji

圖5 培養基起始pH值對酶活力的影響Fig.5 Effect of pH value on cellulase activities of solid koji
2.3 正交試驗優化固態發酵產酶條件 采用L9(33)正交表,考察發酵溫度(A)、發酵時間(B)和初始pH值(C)對固體曲纖維素酶活力的影響,試驗結果見表1。由表1可知,發酵時間對纖維素酶活力的影響最大,其次是發酵溫度,影響最小的是初始pH值,即3因子對纖維素酶活力的影響順序為發酵時間>發酵溫度>初始pH值,酶活力最高的發酵條件組合是A2B3C3,即:發酵溫度為31℃,發酵時間為120 h,初始pH值為5.5。經3次驗證,在該反應條件下發酵得到的纖維素酶濾紙酶活為423.6 U/g。

表1 正交試驗設計及試驗結果分析Table 1 Design of orthogonal experiment list and the result analysis of test
3 結論
應用本實驗室篩選得到的纖維素酶高產菌株T.reesei150-1-1發酵制備纖維素酶固體曲,通過正交試驗優化固態發酵培養基組成及發酵條件,制備得到纖維素酶活力較高的固體曲及粗酶液。
3.1 應用里氏木霉150-1-1制備纖維素酶固體曲的固態發酵培養基中麩皮與秸桿粉的最佳質量比為4∶1,最佳料液比為 1∶2.5。
3.2 應用里氏木霉150-1-1制備纖維素酶固體曲的最優發酵條件為發酵溫度31℃,發酵時間120 h,發酵起始pH值5.5,在此條件下發酵得到的纖維素酶固體曲酶活力達到423.6 U/g。
[1]史通,宋向陽,歐陽嘉,等.黑曲霉與里氏木霉混合發酵產β-葡萄糖苷酶[J].林產化學與工業,2013,33(5):101-105.
[2]LHND L R,WEIMER P J,VANZYL W H,et al.Microbial cellulose utilization:Fundamentals and biotechnology[J].Microbiology and Molecular Biology Reviews,2002,66(3):506-577.
[3]江小華,朱均均,余世袁,等.里氏木霉β-木糖苷酶的分離純化、酶學性質及水解機理研究[J].生物質化學工程,2013,47(1):27-32.
[4]衛民,趙劍,劉軍利,等.植物纖維原料水解生產乙醇的研究進展[J].生物質化學工程,2013,47(3):48-51.
[5]YAN Shou-bao,LI Jun,CHEN Xiang-song,et al.Enzymatical hydrolysis of food waste and ethanol production from the hydrolysate[J].Renewable Energy,2011(36):1259-1265.
[6]YANG Hui,CHEN Li,YAN Zong-cheng,et al.Emergy analysis of cassava-based fuel Ethanol in China[J],Biomass and Bioenergy.2011,35,581-589.
[7]丁重陽,王玉紅,章克昌.箱式固態發酵生產纖維素酶的研究[J].釀酒,2003,30(2):33-35.
[8]班靖洋,張栩,譚天偉.以甜高粱渣為原料發酵生產乙醇[J].北京化工大學學報,2007,34(6):637-639.
[9]張寧,蔣劍春,楊靜,等.N+注入誘變選育纖維素酶高產菌株及發酵產酶營養因子優化研究[J].生物質化學工程,2014,48(4):28-34.
[10]GHOSE T.Measurement of cellulase activities[J].Pure and Applied Chemistry,1987,58(2):257-268.
[11]王箐莎,王頡,周家楠,等.里氏木霉LW1固態發酵纖維素酶條件的研究[J].生物學雜志,2006,23(3):32-36.
[12]饒慶隆,杭志喜,彭軍,等.里氏木霉產纖維素酶碳源優化[J].江西農業大學學報,2008,30(3):528-542.

