γδT細胞在急性乙型肝炎病毒感染小鼠模型中的變化分析①
常 琳 王 磊 彭 輝 陳 敏 (重慶醫科大學病毒性肝炎研究所,感染性疾病分子生物學省部共建教育部重點實驗室,重慶400010)
乙型肝炎病毒(Hepatitis B virus,HBV)為一種噬肝病毒,感染后可致乙型肝炎、肝硬化等多種嚴重肝病,嚴重威脅生命健康。研究表明,在急性HBV感染過程中,HBV感染肝細胞后,可激發機體的免疫系統,包括激活多種非特異性免疫細胞及特異性免疫細胞等,使機體最終清除HBV,同時產生HBV特異性的抗體及記憶型免疫細胞[1-3]。肝臟中自然殺傷細胞(Nature killer cells,NK)、自然殺傷T細胞(Nature killer T cells,NKT)及 γδT 細胞等非特異性免疫細胞含量豐富,可占全部肝臟淋巴細胞的三分之二,在抗HBV感染免疫中起到了很重要的作用[4-6]。γδT細胞是除 NK、NKT外的另一種重要的非特異性免疫細胞,可在多種細菌或病毒感染中發生激活,起到免疫清除或免疫調節的作用[7-9]。但目前γδT細胞在急性HBV感染中的作用還未見相關報道。因此本文擬通過尾靜脈高壓水動力法注射HBV質粒構建急性乙型肝炎病毒感染小鼠模型,直接分析肝臟內γδT細胞的變化,并與外周血及脾臟中的γδT細胞比較,從而初步探討γδT細胞在HBV急性感染清除機制中的作用。
1 材料與方法
1.1 材料
1.1.1 質粒 含HBV全基因組(ayw亞型)1.3倍體真核表達質粒(pcDNA3.1-HBV1.3)及空載體pcDNA3.1均為本所(重慶醫科大學病毒性肝炎研究所)保存。
1.1.2 實驗動物 清潔級(SPF)雌性C57BL/6J小鼠45只,4~6周齡,體重(16~20)g,購自重慶醫科大學實驗動物中心。將鼠隨機分為9組,每組各5只,包括正常對照組(NC)、pcDNA3.1-HBV1.3質粒1天(pHBV1d)、5 天(pHBV5d)、10 天(pHBV10d)、15天(pHBV15d)、pcDNA3.1質粒1天(pcDNA1d)、3天(pcDNA3d)、5 天(pcDNA5d)、7 天(pcDNA7d)。小鼠在該中心清潔級標準飼養,動物房保持通風、干燥、室溫(22~25)℃,濕度(50~70)%,自由飲水,鼠料定量飼養。
1.1.3 試劑 Anti-Mouse CD16/CD32 Purified(14-0161-81,eBioscience),PerCP Hamster Anti-Mouse CD3e(553067,BD Parmingen),PE Hamster Anti-Mouse γδ T-cell receptor(553178,BD Parmingen),PE-Cy5TMAnti-Mouse CD69(15-0691-81,eBioscience),APC Rat anti-mouse CD25(558643,BD Parmingen),FITC Hamster anti-mouse γδ T-cell receptor(553177,BD Parmingen),PE anti-mouse IFN-gamma(12-7311-81,eBioscience),PE-Cy7TMRat anti-mouse TNF(557644,BD Parmingen),膠原酶Ⅳ(C5138,sigma),DNA 酶Ⅰ(D5025,sigma),percoll(17-0891-01,Pharmacia)。免疫組化檢測試劑:購自北京中杉金橋生物技術有限公司,包括mouse anti-HBsAg(ZM-0421),mouse anti-HBcAg(ZM-0122),polymer detection system(PV-6000)等。
1.1.4 設備 臺式高速冷凍離心機(德國Eppendorf,centrifuge 5810R),流式細胞儀(美國 BD,BD FACSCantoTMⅡ)。
1.2 方法
1.2.1 急性乙型肝炎病毒(HBV)感染小鼠模型復制 采用尾靜脈高壓水動力注射方法[10]。pcDNA 3.1-HBV1.3或 pcDNA3.1質粒約40 μg溶于1.5 ml PBS中,將鼠尾置于60℃溫水中數秒,以0.4 ml/s的速度將質粒溶液注入小鼠尾靜脈。于注射后各時間點,摘眼球取血,分離血清,檢測血清中HBsAg、HBeAg、ALT及 TB。以此來確定模型是否構建成功。
1.2.2 血清HBsAg、HBeAg及ALT、TBiL的檢測均送往重慶醫科大學附二院檢測。血清HBsAg、HBeAg用羅氏電化學發光法分析,結果用COI(cutoff index)表示,>1 COI為陽性。肝功能(ALT、TBiL)用全自動生化分析儀檢測。
1.2.3 小鼠肝臟組織HBsAg及HBcAg的檢測 用酶免疫組織化學方法檢測肝臟組織石蠟切片中HB-sAg及HBcAg的表達。收集正常對照小鼠、pHBV組小鼠的右葉肝臟,固定于10%的中性甲醛液中,直接送于重慶醫科大學病理教研室進行石蠟切片。石蠟切片經二甲苯脫蠟2次,逐級酒精水化,3%雙氧水去非特異性染色,抗原修復,5%山羊血清封閉后,加HBsAb或HBcAb 4℃過夜,加聚合物,DAB顯色,蘇木素復染,分化脫色,最后脫水、透明及封片,鏡檢。計數每高倍視野下(×400倍)陽性著色(棕色)的肝細胞數,并計算陽性率。
1.2.4 肝臟內淋巴細胞的分離 用乙醚麻醉小鼠,用PBS經肝門靜脈灌注去肝內殘留血液,剪下肝臟并用PBS清洗后剪碎,加入10 ml消化液(含0.05%膠原酶Ⅳ及0.01%DNA酶Ⅰ的 RPMI1640液),37℃水浴消化30 min,期間不停用吸管吹打,然后經200目濾網過濾后,500 r/min離心去沉淀(含肝細胞等),再1 800 r/min離心收集沉淀細胞(含淋巴細胞等),經33%percoll液2 500 r/min密度梯度離心后,去掉所有上層液體,留沉淀細胞,加入0.75%NH4Cl溶解紅細胞,再經FACS buffer(含1%胎牛血清的PBS)洗滌后,即得肝臟內淋巴細胞。
1.2.5 脾臟內淋巴細胞的分離 用兩張玻片相互擠壓磨碎脾臟,經200目濾網過濾后,1 800 r/min離心收集沉淀細胞(含淋巴細胞等),加入0.75%NH4Cl溶解紅細胞,再經FACS buffer洗滌后,即得脾臟內淋巴細胞。
1.2.6 肝或脾內γδT細胞染色及流式檢測 取肝或脾淋巴細胞2×105,加入CD16/32抗體4℃封閉10 min,再按說明書加入適量的熒光標記抗體anti-CD3e、anti-γδ T-cell receptor、anti-CD69 或 anti-CD25,4℃孵育30 min,用 FACS buffer洗滌后,吸入專用的流式上樣管,用FACS CantoⅡ(BD Biosciences)流式儀檢測,再用BD FACSDivaTMsoftware分析軟件進行流式數據數據分析得到 γδT細胞、CD25+γδT 或 CD69+γδT 的比例。
1.2.7 外周血γδT細胞的檢測 小鼠摘眼球取外周靜脈血,用肝素抗凝。取抗凝血100 μl,加入CD16/32抗體4℃封閉10 min,再加入適量的熒光抗體 anti-CD3e、anti-γδ T-cell receptor、anti-CD69 或anti-CD25,4℃孵育 30 min 后,加 2 ml 1∶10 稀釋的紅細胞裂解液(FACSTMlysing solution,BD)混勻,室溫避光作用10 min,離心后,用FACS buffer洗滌,立即流式檢測及數據分析,得到γδT細胞、CD25+γδT或CD69+γδT的比例。
1.2.8 γδT細胞的胞內細胞因子檢測 肝臟內淋巴細胞重懸于含10%胎牛血清(FCS)的RPMI1640的完全培養基中,加入終濃度為100 ng/ml佛波脂(PMA)、1 μg/ml離子霉素及蛋白轉運抑制劑(0.16 μg/ml莫能霉素),將細胞置于24孔板內,37℃ 5%CO2孵箱內作用4 h。細胞體外刺激后,用FACS buffer洗1次,加入CD16/32抗體4℃封閉10 min,用anti-TCR γδ mAb做表面染色,洗滌后,用4%多聚甲醛固定,經0.1%saponin透膜后,加入相應體積的 anti-IFN-γ及 anti-TNF-α流式抗體做胞內染色,4℃避光染色30 min,洗滌后,加200 μl的 FACS buffer重懸,于BD FACS CantoⅡ流式細胞儀上樣檢測,并用BD FACSDiva 2.0軟件分析數據,獲得IFN-γ+γδT 及 TNF-α+γδT 細胞的比例。
1.3 統計學處理 所有的實驗結果用PASW Statistics18.0 for windows統計軟件作多組間均數的方差分析(F檢驗),兩樣本均數間比較用q檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 急性HBV感染小鼠模型復制 小鼠對尾靜脈高壓水動力注射法耐受良好,除極個別在注射后立即發生心衰死亡外,其余均能迅速恢復正常飲食與飲水,肝臟也未發現明顯的結節或壞死。注入HBV質粒后,血清中的HBsAg在第1天(pHBV1d)即為陽性(33.64±14.88)COI(>1 COI),在第5天(pHBV5d)達高峰(146.92±24.23)COI,隨即降低,到第15天(pHBV15d)仍為陽性(圖1A);血清HBeAg水平在第1天即達高峰(2.26±2.34)COI,為陽性,并隨著時間的推移迅速降低,第10天(pHBV10d)為陰性(<1 COI,圖1B)。同時,HBV質粒小鼠血清中的ALT水平在第1天上升至300U/L,隨后迅速下降至正常,而TBiL水平一直保持正常,未見升高。正常對照小鼠與pcDNA對照質粒小鼠的外周血中HBV標志物一直為陰性。pcDNA質粒注射第一天小鼠的ALT水平升至80 U/L,隨即降低到正常水平。
同時用免疫組化法檢測了pHBV1d、pHBV5d及正常對照(NC)小鼠肝臟組織內HBsAg與HBcAg的表達,見圖2。圖中顯示,pHBV1d小鼠中表達HB-sAg或HBcAg的肝細胞達10% ~20%左右,HBsAg陽性細胞數高于HBcAg陽性細胞數。而pHBV5 d小鼠表達HBsAg或HBcAg的肝細胞迅速降低,僅有1%~3%左右,HBsAg主要表達于胞漿,而HB-cAg胞漿胞核均有表達。

圖1 HBV質粒(pHBV)急性轉染小鼠模型血清中HBsAg(A)及HBeAg(B)的時間變化曲線(>1 COI為陽性)Fig.1 The time variation curve of HBsAg(A)or HBeAg(B)in the serum of mice hydrodynamic injected with pcDNA3.1-HBV1.3 plasmid(positive when higher than 1 COI)
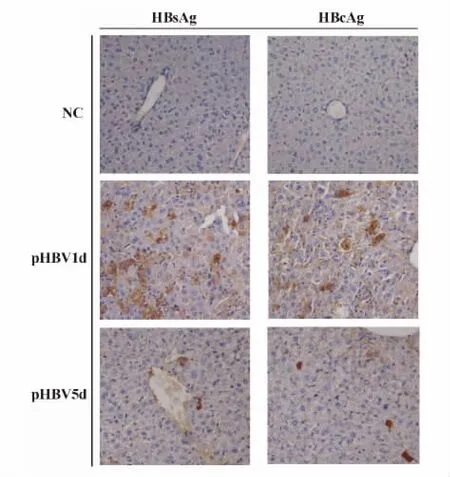
圖2 正常對照小鼠(NC)、HBV質粒注射1天(pHBV1d)與5天(pHBV5d)小鼠的肝臟組織內HBsAg與HB-cAg的表達(DAB顯色,×200倍)Fig.2 The HBsAg or HBcAg expression in liver tissue from NC,pHBV1d,or pHBV5d mouse by immunohistochemistry staining(×200 multiple)

圖3 小鼠肝臟、脾臟及外周血中γδT細胞的流式檢測圖(圖中比例表示γδT細胞占T細胞中的比例)Fig.3 The FACS figures of γδT cells in murine liver,spleen or blood(the values in the figure represent the proportion of γδT cells in T cells)
2.2 急性HBV感染小鼠模型中肝臟、脾臟及外周血γδT細胞比例的變化 用流式細胞術分別檢測了小鼠肝臟、脾臟及外周血中γδT細胞占T細胞中的比例(圖3),結果顯示正常對照小鼠(NC)肝臟中的γδT細胞比例(4.5±0.6)%明顯高于脾臟(2.1±0.3)%或外周血(1.2±0.6)%,差異有顯著性(P<0.01)。在HBV質粒(pHBV)急性轉染小鼠后的第1天(pHBV1d),肝臟內的γδT細胞的比例即刻升高至(8.3±4.3)%,然后隨時間的推移而逐漸降低,但到第10天時,γδT細胞的比例又快速升高至(8.0±1.2)%,而后又下降。經統計學分析,pHBV1d小鼠肝臟內的γδT細胞比例明顯高于NC、pHBV5d、pHBV15d天的比例,差異有顯著性(P<0.05)。但各時間點脾臟或外周血中的γδT細胞比例未見有明顯的變化,組間的差異無顯著性(P>0.05,圖4)。在 pcDNA3.1對照質粒注射后,小鼠肝臟、脾臟或外周血中的γδT細胞比例均未見有顯著性的變化發生(P>0.05,圖5)。
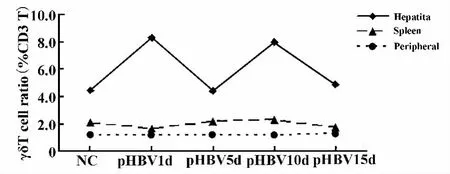
圖4 水動力法注射小鼠HBV質粒(pHBV)后肝臟、脾臟及外周血中γδT細胞比例變化的時間曲線Fig.4 Time variation curve of the proportion of γδT cells in the liver,spleen or peripheral blood of mice with hydrodynamic injection of pcDNA3.1-HBV1.3 plasmid

圖5 pcDNA3.1質粒注射小鼠后肝臟、脾臟及外周血中γδT細胞比例的時間變化曲線Fig.5 Change in the proportion of γδT cells in the liver,spleen or peripheral blood of mice injected with pcDNA3.1 plasmid

圖6 小鼠肝臟內表達CD25+或CD69+的γδT細胞流式檢測圖(圖中比例表示CD25+或CD69+γδT細胞占γδT細胞中的比例)Fig.6 FACS figure of CD25+or CD69+ γδT cells in murine liver(the values in the figure represent the proportion of CD25+or CD69+ γδT cells in γδT cells)
2.3 肝臟中γδT細胞的激活表型在急性HBV感染小鼠模型中的變化 檢測了正常對照小鼠(NC)及HBV 質粒注射小鼠(pHBV)后第1、5、10、15天肝臟內γδT細胞的激活表型分子CD25與CD69(流式檢測圖見圖6)。CD69陽性的γδT細胞比例在NC肝臟中為(9.9±2.7)%,而在pHBV小鼠中CD69+γδT細胞比例隨著時間延長而逐漸降低,到第15天比例又逐漸回升。而肝臟內CD25+γδT細胞比例在pHBV質粒注射后第5天達到最高值(8.4±3.7)%,與血清中HBsAg水平達高峰時間一致,然后比例隨著時間而降低(圖7)。統計分析結果顯示,pHBV模型組小鼠第10天的CD69+γδT細胞比例與其他組比較差異有顯著性(P<0.05),而各時間點下表達CD25分子γδT細胞的比例差異無顯著性,P>0.05。
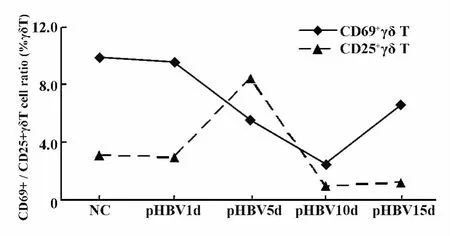
圖7 肝臟內CD25或CD69陽性的γδT細胞比例在急性HBV質粒(pHBV)轉染小鼠模型中的變化Fig.7 Change in the proportion of CD25 or CD69 positive γδT cells in the liver of mice injected with HBV plasmid

圖8 小鼠肝臟內產生IFN-γ或TNF-α的γδT細胞流式檢測圖(圖中比例表示 IFN-γ+或 TNF-α+γδT細胞占γδT細胞中的比例)Fig.8 FACS figures of IFN-γ+or TNF-α+ γδT cells in murine liver(the values in the figure represent the proportion of IFN-γ+or TNF-α+γδT cells in γδT cells)
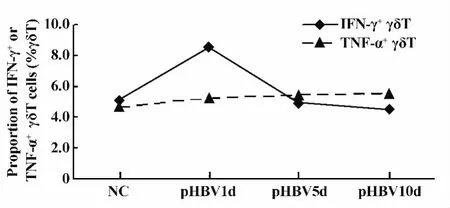
圖9 肝臟內IFN-γ或TNF-α陽性的γδT細胞比例在急性HBV質粒轉染小鼠模型中的變化Fig.9 Change in the proportion of IFN-γ or TNF-α positive γδT cells in the liver of mice injected with HBV plasmid
2.4 肝臟內產生 IFN-γ或TNF-α細胞因子的γδT細胞比例在急性HBV感染小鼠模型中的變化 用流式細胞儀檢測了正常對照小鼠(NC)、pHBV模型小鼠1、5、10 d 肝臟內 IFN-γ+或 TNF-α+γδT 細胞比例(流式檢測圖見圖8)。pHBV質粒尾靜脈注射后第1天產生的 IFN-γ的 γδT細胞比例升高至(8.6±3.2)%,之后即刻降低至正常對照水平。而TNF-α陽性的γδT細胞比例隨著時間而緩慢上升(圖9)。統計分析的結果顯示,pHBV1天的IFN-γ+或TNF-α+γδT細胞比例與其他時間點比較,差異無顯著性(P>0.05)。
3 討論
HBV病毒主要感染肝細胞,肝臟內富含淋巴細胞等免疫細胞,它們與抗HBV免疫及肝細胞免疫炎癥密切相關。其中非特異性免疫細胞包括NK、NKT及γδT細胞總量可占肝臟淋巴細胞的一半以上,因此在與HBV感染相關的免疫機制中非常重要[4-6]。
γδT細胞是一類除NK、NKT等細胞外的天然免疫細胞,參與了多種細菌與病毒的免疫應答[7-9]。Ajuebor等[11]的報道顯示,在由腺病毒引起的小鼠肝臟炎性損傷過程中,γδT細胞是肝細胞免疫損傷的關鍵因素。Barcy等[12]也發現,在慢性人皰疹病毒8型感染中,γδT細胞的比例及功能均增強。Tseng等[13]研究γδT細胞與慢性丙型肝炎的關系中發現,患者肝組織的γδT細胞比例增加,功能增強,與肝組織的免疫病理密切相關。而目前有關γδT細胞在HBV感染中的作用還不怎么清楚,我們在前期的研究中主要觀察了HBV感染患者外周血中γδT細胞比例與表型的變化[14],因此本文以急性HBV感染小鼠作模型,著重觀察肝臟內γδT細胞的比例、激活表型及細胞因子表達的變化,以期了解γδT細胞在HBV感染免疫反應中的作用。
由于目前HBV自然感染模型僅限于黑猩猩等靈長類動物,而無法在普通實驗室復制。因此我們參照Yang等[10]方法,利用尾靜脈高壓水動力注射原理,直接將HBV質粒轉染入小鼠肝臟,可使HBV質粒在肝細胞中復制與抗原表達,從而模擬機體的HBV急性感染清除的過程。我們在HBV質粒注射后的不同時間檢測了HBsAg或HBeAg在血清中的水平,結果顯示,HBsAg可在肝細胞中高效表達并分泌至血液中,第1天即為陽性,并在第五天達高峰,而HBeAg在第1天為陽性,隨之下降,并維持于0.5 COI~0.9 COI之間。而對照pcDNA3.1質粒注射后,HBsAg(0.733±0.366 COI)與 HBeAg(0.091±0.017 COI)均為陰性。同時我們用免疫組化法檢測了HBV質粒小鼠肝組織內HBsAg與HB-cAg的表達,發現第1天小鼠肝細胞內表達最強(陽性率為10% ~20%左右),而到第5天降低至僅有1% ~3%左右。結果顯示,肝細胞內HBV抗原消失時間早于血清中的,這與HBV抗原具有一定半衰期有關。結果也證明,經水動力法注射HBV質粒,可使HBV在肝細胞內得以感染與抗原表達。因此,小鼠急性HBV質粒轉染清除模型構建成功。但Yang[10]的結果顯示,HBV質粒轉染后第1天 HB-sAg及HBeAg水平均達高峰,隨后降低,而我們的模型中HBsAg水平在第5天才達高峰,可能與所選的小鼠品系及質粒載體有關系。
首先,我們觀察了模型肝臟、脾臟及外周血內γδT細胞的比例在HBV質粒注射后的不同時間下的變化,結果顯示,在HBV質粒轉染后第1天,肝臟內的γδT細胞比例立即升高,而脾中的比例降低,外周血中的比例略升高。之后,γδT細胞比例降低,而到第10天,比例又升高。結果提示在注射后第1天,由于HBV質粒轉染入肝細胞內,肝細胞瞬間表達大量的HBV抗原,并且由于尾靜脈高壓注射引起肝細胞膜暫時性通透性增加,肝細胞結構受到一定程度的破壞,因此可引起大量免疫細胞向肝臟的聚集。由于γδT細胞作為一種非特異性免疫細胞,具有在短時間內迅速遷移至機體損傷部位而發生炎癥或修復反應的特性,因此,在HBV質粒注射后第1天,γδT細胞即可反應性地從脾臟或血中向肝臟內聚集,從而導致肝臟內γδT細胞比例的增高。而后,其他免疫細胞在肝臟內逐漸增多,且γδT細胞在免疫反應過程中有一定的損傷與消耗,而使比例降低,隨著時間推移,γδT細胞可發生一定的增殖或遷移性補充而使比例再次升高。而脾臟或外周血中的γδT細胞比例未發生顯著性的變化。同時,我們課題組的其他成員還檢測了HBV質粒小鼠肝臟中NK、CD4+T及CD8+T細胞比例的變化。發現NK細胞(占肝淋巴細胞比例)也是在第1天較正常小鼠(17.8±5.4)%急劇升高,為(33.7±4.1)%,隨后迅速下降,第10天降至正常小鼠水平。而肝內CD4+T或CD8+T細胞比例(占肝T細胞比例)至第5天才分別下降或上升到最高水平。結果顯示,NK或γδT等非特異性免疫細胞可對外來抗原迅速作出反應,是參與機體免疫反應的第一線。
接著,我們又觀察了肝臟內γδT細胞激活分子CD69及CD25的表達,以及產生細胞因子IFN-γ或TNF-α的情況。結果顯示,CD69分子的表達在前10天呈下降,而在第15天,表達又增高;相反,CD25+γδT比例在第5天升高至高峰,與HBsAg在血清中的高峰時間一致,而后又降低。兩種激活分子的表達呈現了相反的變化規律。結果提示,可能肝內已存在的CD69+γδT細胞因被消耗而使比例降低,但CD25分子卻為HBV感染后激活γδT細胞而產生,因此,γδT細胞的CD25激活分子的表達增加。而γδT細胞在激活狀態可分泌TNF-α或IFN-γ等多種細胞因子,與多篇文獻報道一致。
因此,本文初步提示了,γδT細胞在急性HBV感染小鼠模型中早期即可比例升高,接著出現激活分子增加,細胞因子產生增強的過程,結果揭示了γδT細胞可能參與了HBV急性感染與清除的過程。
[1]Liang TJ.Hepatitis B:the virus and disease[J].Hepatology,2009,49(5 Suppl):S13-S21.
[2]Liaw YF,Chu CM.Hepatitis B virus infection[J].Lancet,2009,373(9663):582-592.
[3]中華醫學會肝病學分會和中華醫學會感染病學分會.慢性乙型肝炎防治指南[J].中華內科雜志,2006,45(2):162-170.
[4]Vivier E,Tomasello E,Baratin M,et al.Functions of natural killer cells[J].Nat Immunol,2008,9(5):503-510.
[5]Welsh RM,Waggoner SN.NK cells controlling virus-specific T cells:Rheostats for acute vs.persistent infections[J].Virology,2013,435(1):37-45.
[6]Dong Z,Wei H,Sun R,et al.The roles of innate immune cells in liver injury and regeneration[J].Cell Mol Immunol,2007,4(4):241-252.
[7]Bonneville M,O'Brien RL,Born WK.Gammadelta T cell effector functions:a blend of innate programming and acquired plasticity[J].Nat Rev Immunol,2010,10(7):467-478.
[8]Born WK,Yin Z,Hahn YS,et al.Analysis of gamma delta T cell functions in the mouse[J].J Immunol,2010,184(8):4055-4061.
[9]Casetti R,Martino A.The plasticity of gamma delta T cells:innate immunity,antigen presentation and new immunotherapy[J].Cell Mol Immunol,2008,5(3):161-170.
[10]Yang PL,Althage A,Chung J,et al.Hydrodynamic injection of viral DNA:a mouse model of acute hepatitis B virus infection[J].Proc Natl Acad Sci USA,2002,99(21):13825-13830.
[11]Ajuebor MN,Jin Y,Gremillion GL,et al.Gammadelta T cells initiate acute inflammation and injury in adenovirus-infected liver via cytokine-chemokine cross talk[J].J Virol,2008,82(19):9564-9576.
[12]Barcy S,De Rosa SC,Vieira J,et al.Gamma delta+T cells involvement in viral immune control of chronic human herpesvirus 8 infection[J].J Immunol,2008,180(5):3417-3425.
[13]Tseng CT,Miskovsky E,Houghton M,et al.Characterization of liver T cell receptor gammadelta T cells obtained from individuals chronically infected with hepatitis C virus(HCV):evidence for these T cells playing a role in the liver pathology associated with HCV infection[J].Hepatology,2001,33(5):1312-1320.
[14]Chen M,Zhang D,Zhen W,et al.Characteristics of circulating T cell receptor gamma-delta T cells from individuals chronically infected with hepatitis B virus(HBV):an association between V(delta)2 subtype and chronic HBV infection[J].J Infect Dis,2008,198(11):1643-1650.

