TLRs與腫瘤增殖和侵襲①
劉 丹 李航宇(中國醫科大學附屬盛京醫院普通外科,沈陽110004)
Toll樣受體(Toll-like receptors,TLRs)是參與天然免疫應答的一類重要分子,是機體抵抗病原微生物感染以及抗腫瘤的第一道防線。TLRs主要表達于免疫細胞表面,促進炎癥因子的合成與釋放,引發炎癥反應。近年來發現TLRs在腫瘤組織中亦有表達,不同細胞表面表達的TLRs可能對腫瘤細胞產生不同的作用。在免疫細胞表面表達的TLRs可能介導腫瘤的免疫逃逸,同時也具有抗腫瘤作用,而腫瘤細胞表面表達的TLRs可能參與腫瘤增殖和侵襲等生物學行為的調控。本文就TLRs在腫瘤組織中的表達及其對腫瘤增殖、侵襲的影響作以簡要綜述。
1 TLRs的結構、分布及其配體
1.1 TLRs的結構 TLRs一詞源于果蠅體內的Toll受體,與人類的白介素1受體(Interleukin-1 receptor,IL-1R)有著相似的序列[1]。TLRs是一類天然免疫受體家族,其成員都是Ⅰ型跨膜蛋白,其包膜外區參與對病原相關分子模式(Pathogen-associated molecular patterns,PAMPs)的識別;胞內段的髓樣分化因子88(Myeloid differentiation primary-response protein 88,MyD88)參與細胞內的信號轉導過程[2,3]。
1.2 TLRs的分布 從1997年 Medzhitov[4]首次發現TLRs到現在,哺乳動物中已被確認的TLRs家族成員有13種,其中有11種表達于人類細胞[5],并廣泛分布于各種組織中。最初的研究認為TLRs主要表達于免疫細胞表面,包括單核巨噬細胞、B淋巴細胞、T淋巴細胞、樹突狀細胞、NK細胞等[6]。近年來越來越多的研究證實在腫瘤組織中也有TLRs的表達(見表1),如在胃癌、結直腸癌、卵巢癌、宮頸癌、肺癌、前列腺癌、乳腺癌、黑色素瘤、肝癌、喉癌、胰腺癌、食管鱗狀細胞癌等腫瘤組織中均有不同亞型的TLRs表達,這些TLRs通過不同的配體激活后對腫瘤的發生發展起重要作用[7-27]。
1.3 TLRs的配體 TLRs是一種模式識別受體,可以識別特異性的配體分子(見表2)。TLRs主要通過胞膜外區結構與特異性配體結合,向胞內區傳遞信號發揮作用[28]。TLRs能夠識別不同的損傷相關分子模型(Damage-associated molecular patterns,DAMPs)和 PAMPs[29]。PAMPs 是由病原微生物產生的高度保守的分子產物,這些病原微生物包括革蘭氏陽性菌、革蘭氏陰性菌、真菌和病毒等。DAMPs是由受損或死亡的細胞釋放的內源性分子。DAMPs和 PAMPs都能通過 TLRs 激活免疫反應[30,31]。在腫瘤的發生發展過程中,伴隨腫瘤組織的凋亡、壞死及胞吐(Exocytosis),也有大量的DAMPs和PAMPs釋放。腫瘤組織中的TLRs可以識別這些DAMPs和PAMPs,活化其下游的信號傳導通路,導致腫瘤局部炎癥反應,進而對腫瘤組織的增殖、侵襲等生物學行為有重要的影響。
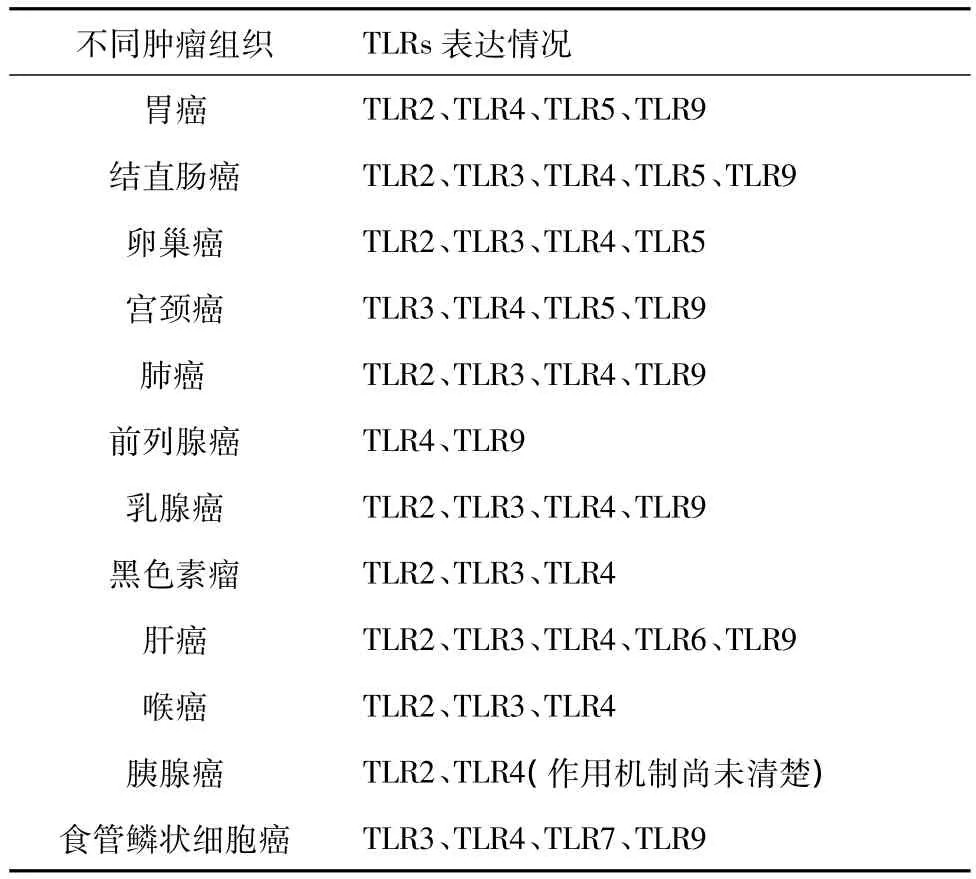
表1 不同腫瘤組織中TLRs的表達情況Tab.1 The expression of TLRs in different tumor tissues

表2 人類TLRs及其配體Tab.2 Human TLRs and their ligands
2 TLRs對腫瘤增殖、侵襲的影響
TLRs的生物學功能中最突出的就是促進細胞因子的合成與釋放,引發炎癥反應[32]。近年來研究表明由自身免疫疾病或者病原微生物感染引起的許多慢性炎癥是相應惡性腫瘤的癌前病變,這些病原微生物包括幽門螺桿菌、人類乳頭瘤病毒、乙肝病毒、丙肝病毒、EB病毒等,它們感染機體促進消化系統腫瘤、宮頸癌、肝癌、造血系統腫瘤的發生發展[33,34]。慢性乙型肝炎肝組織上 TLR2和 TLR4的表達明顯升高[35],HBV的感染及炎癥促進了HCC(Hepatocellular carcinoma,HCC)的發生發展[36],TLR2和TLR4信號途徑的持續激活被認為是慢性炎癥持續存在進而發展成為惡性腫瘤的重要因素[37]。
在腫瘤組織中,TLRs同時表達于免疫細胞表面和腫瘤細胞表面,TLRs在腫瘤組織中的作用表現非常復雜。TLRs的本質就是感受細胞外信號刺激,將其傳導至細胞內,通過相應的信號轉導通路作用于核轉錄因子,調控不同的效應因子表達。因此,TLRs的作用具有刺激依賴性和細胞類型依賴性。也就是說,不同的細胞外刺激可以誘發TLRs的不同作用;相同的刺激作用于不同細胞表面的TLRs也會誘發其不同的作用。
免疫細胞表面的TLRs激活,一方面可以介導免疫反應,具有抗腫瘤效應[20];另一方面可以通過產生免疫抑制因子和抑制凋亡促進腫瘤的免疫逃逸。He等[38]發現:在人類肺癌組織中,TLR4感受微環境中LPS刺激,誘導產生免疫抑制因子如IL-8、VEGF和 TGF-β,并誘導肺癌細胞對于 TNF-α 或TRAIL的凋亡抵抗,促進人類肺癌細胞的免疫逃逸。
腫瘤細胞表面TLRs的激活不僅可以促進腫瘤細胞的發生、增殖,還可以促進腫瘤的浸潤、轉移、增強腫瘤的侵襲性。Chochi等[39]認為,TLR4通過感受幽門螺桿菌的LPS刺激,激活信號轉導途徑,促進胃癌細胞增殖。Sheyhidi等[40]發現在食管鱗狀細胞癌組織中 TLR3、TLR4、TLR7、TLR9的表達增高,這些TLRs的過表達與腫瘤浸潤、轉移密切相關。腫瘤細胞表面TLRs的激活還可以產生抗凋亡蛋白[41,42],促進凋亡抵抗,進而促進癌細胞增殖。在卵巢癌組織中,腫瘤細胞表面的TLR4感受LPS刺激,也能明顯促進上皮卵巢癌細胞的增殖[43]。Hua[44]在前列腺癌中,Wang[45]在結腸癌中,均發現TLRs信號途徑的激活與腫瘤的轉移密切相關。張建軍等人[26]近年通過實驗證實:在胰腺癌組織中TLR2 mRNA、TLR4 mRNA 及 TLR2、TLR4蛋白的表達均顯著高于癌旁組織,并發現,在有淋巴轉移、血管侵犯及臨床分期較晚的胰腺癌組織中,TLR2、TLR4 mRNA及蛋白表達均升高,這說明TLR2和TLR4信號通路的激活可能參與胰腺癌的發展過程并促進腫瘤轉移,但對于TLR2、TLR4在胰腺癌進展過程中的作用機制目前尚無研究報道。腫瘤細胞表達的TLRs對其增殖、侵襲的影響與腫瘤微環境的變化是密不可分的,TLRs只有感受腫瘤微環境的改變才能發揮促進腫瘤增殖、侵襲等作用,例如Schmausser等[46]發現把經TLR4配體體外活化的腫瘤細胞接種在正常小鼠皮下,腫瘤細胞不增殖。這說明TLRs只有感受腫瘤微環境中的信號刺激,才能被激活,進而促進腫瘤生長。另有研究表明TLRs的激活也有助于腫瘤逃避免疫監視[33],與腫瘤的預后不良[47]、多藥耐藥[43]、癌性疼痛[48]等密切相關。
腫瘤細胞表面的TLRs激活后還可以損傷免疫細胞的抗腫瘤作用,從而改變炎癥反應原本的防御性作用,促進腫瘤的增殖和侵襲[49]。由此可見:相同的信號刺激作用于不同類型細胞表面的TLRs所產生的作用可能截然相反。盡管腫瘤細胞表面TLRs的激活促進了腫瘤的發生發展,但在某些腫瘤組織中也能夠抑制腫瘤的增殖。例如人類黑色素細胞能夠表達TLR3,這種TLR3途徑的激活能夠抑制細胞增殖、誘導腫瘤細胞死亡[50],這是由于 TLR3激活后介導炎癥介質表達和釋放,導致自身抗腫瘤免疫提高的結果[51]。
3 TLRs相關的信號轉導通路
3.1 TLRs信號轉導通路 TLRs在腫瘤組織中的復雜作用與其介導的信號轉導通路密切相關。目前,TLRs信號轉導途徑[52]分為兩種:人髓樣分化因子88(MyD88)依賴性途徑和MyD88非依賴性途徑[2,53](見圖1)。其中 TLR1、TLR2、TLR5、TLR6、TLR7、TLR8、TLR9是由MyD88依賴性途徑介導的,TLR3是由MyD88非依賴性途徑介導的,而TLR4可同時經過兩條途徑進行信號轉導[54]。
對于MyD88依賴性途徑,白細胞介素1(Interleukin 1,IL-1)受體家族與TLRs具有相似的細胞內TIR 結構域(Toll/IL-1R homologous region,TIR),兩者具有相似的信號轉導途徑[55]。大多數的TLRs均顯示可以通過接頭蛋白MyD88激活IL-1受體相關激 酶(IL-1 receptorassociatedkinase,IRAK)。MyD88有三個功能區域:N端的死亡區(Death domain,DD)、中間區域和C端的toll區。TIR結構域類似于IL-1受體的胞質區,通過募集連接蛋白來傳遞信號。DD介導有DD序列的蛋白質與蛋白質之間的相互作用。當TLRs與PAMPs結合后其本身結構發生二聚化,通過TIR結構域與MyD88的C端toll區相互作用,活化后的MyD88的DD募集下游同樣含死亡結構域的絲/蘇氨酸蛋白激酶(Serine/threonine-kinase)導致IRAK自身磷酸化,磷酸化的IRAK1和IRAK4共同激活腫瘤壞死因子受體相關因子(Tumor necrosis factor receptor associated factor,TRAF),活化后的TRAF6與轉化生長因子(TGF)-β及轉化生長因子β活化的激酶(Transforming growth factor-β activated kinase,TAK1)結合蛋白(TAK1-binding protein 1,TAK1)形成 TAB1/2復合物,最終活化核因子(NF)-κB,產生大量的炎性因子(如IFN-γ、TNF-α、IL-1β、IL-6、IL-8 等),介導機體的炎癥應答[30]。
對于MyD88非依賴性途徑,需要TIR結構域銜接蛋白(TRIF)的參與。TLR4通過接頭蛋白TRAM將信息傳遞給銜接蛋白TRIF,從而進行信號轉導,這個途徑可誘導DC成熟,最后誘導免疫應答的發生。而TLR3則直接通過TRIF進行信號轉導。最終激活 NF-κB 誘導 IFN-β 的分泌[56]。
3.2 TLRs相關信號通路對腫瘤的影響 TLRs啟動經典的NF-κB信號通路,產生細胞因子,構成腫瘤微環境,促進癌癥的發生、發展[57]。然而腫瘤的發生發展受多種信號轉導通路的影響,例如MAPK信號轉導途徑、Akt/PKB信號通路、Wnt信號轉導途徑、Stat3(Signal transducers and activator transcription factors,STATs)信號途徑等,那么TLRs信號轉導途徑對腫瘤的影響是否與這些通路相關?TLRs途徑激活后活化TRAF6,TRAF6是E3泛素連接酶家族的成員,目前被認為是MAPK信號通路最為關鍵的激活劑[58]。這兩條信號轉導途徑在腫瘤組織中協同作用,促進腫瘤細胞分泌炎癥因子,如 TGF-β、VEGF、IL-8等從而促進腫瘤的增殖以及凋亡抵抗。Stat3信號途徑激活后上調CyclinD1的表達[59],而CyclinD1是Wnt/β-catenin途徑下游調控的靶基因,也是TLRs途徑下游信號分子之一,這三條信號轉導通路可能通過CyclinD1協同促進腫瘤的增殖。Akt/PKB途徑激活后調節IKK活性導致NF-κB的核轉位及活化,由此與TLRs途徑相關聯而影響腫瘤的發生發展。

圖1 TLRs信號轉導通路Fig.1 TLRs signal transduction pathway
腫瘤組織中存在多種信號轉導通路,構成一個非常復雜的信號網絡系統。不同的信號可以激活同一條轉導通路,而同一信號往往能夠激活多條信號轉導通路,多種信號通路活化后也可作用相同的效應基因,這表明各通路在腫瘤發生發展中可能起協同作用。腫瘤組織中的多條信號通路間的分子作用機制還有待于進一步研究。
4 研究意義及展望
TLRs在天然免疫中有極其重要的作用,也是腫瘤發生發展過程中關鍵的調控因子,但其作用機制尚未完全明了。對于TLRs信號轉導途徑及其相關通路與腫瘤之間相互關系、相互作用的研究有助于臨床上探索抗腫瘤治療的措施,為抗腫瘤治療增加新的靶點。然而在腫瘤微環境中,腫瘤細胞及浸潤的免疫細胞表面均表達TLRs,免疫細胞表面TLRs激活后介導免疫反應具有抗腫瘤作用和促進腫瘤細胞免疫逃逸作用,而腫瘤細胞表面TLRs激活后介導反應具有損傷免疫細胞的抗腫瘤作用,從而促進腫瘤的增殖、增強腫瘤的侵襲性及抗凋亡特性,如何通過選擇性抑制腫瘤細胞表面的TLRs途徑而抗腫瘤治療仍是我們臨床研究的重點。
[1]Lemaitre B,Nicolas E,Michaut L,et al.The dorsoventral regulatory gene cassette sp?tzle/Toll/cactus controls the potent antifungal response in Drosophila adults[J].Cell,1996,86(6):973-983.
[2]Akira S,Takeda K.Toll-like receptor signaling[J].Nat Rev Immunol,2004,4(7):499-511.
[3]TakedaK,Akim S.Tol1-1ike receptors in innate immunity[J].Int lmmunol,2005,17:1-l4.
[4]Medzhitov R,Preston-Hurlburt P,Janeway CA Jr.A human homologue of the Drosophila Toll protein signals activation of adaptive immunity[J].Nature,1997,388(6640):394-397.
[5]Oshiumni H,Matsumoto M,Funami K,et al.TICAM-1,an adaptor molecule that participates in Toll-like receptor 3 mediated interferonbeta in-duction [J].Nat Immunol,2003,4:161-167.
[6]覃勝靈,陳 皓,邱偉華.Toll樣受體在腫瘤中的研究進展[J].中華實驗外科雜志,2009,26(9):1233-1234.
[7]Huang B,Zhao J,Li H,et al.Toll-like receptors on tumor cells facilitate evasion of immune surveillance[J].Cancer Res,2005,65(12):5009-5014.
[8]Fukata M,Abreu MT.Role of Toll-like receptors in gastrointestinal malignancies[J].Oncogene,2008,27(2):234-243.
[9]Pimentel-Nunes P,Afonso L,Lopes P,et al.Increased expression of toll-like receptors(TLR)2,4 and 5 in gastric dysplasia [J].Pathol Oncol Res,2011,17(3):677-683.
[10]Tsimogiannis KE,Tellis CC,Tselepis AD,et al.Toll-like receptors in the inflammatory response during open and laparoscopic colectomy for colorectal cancer[J].Surg Endosc,2012,26(2):330-336.
[11]Eiró N,González L,González LO,et al.Study of the expression of toll-like receptors in different histological types of colorectal polyps and their relationship with colorectal cancer[J].J Clin Immumol,2012,32(4):848-854.
[12]Woods DC,White YA,Dau C,et al.TLR4 activates NF-κB in human ovarian granulosa tumor cells[J].Biochem Biophys Res Commun,2011,409(4):675-680.
[13]DeCarlo A,Rosa B,Jackson R,et al.Toll-like receptor transcriptome in the HPV-positive cervical cancer microenvironment[J].Clin Dev Immunol,2012,doi:10.1155/2012/785825.
[14]Werner J,Decarlo CA,Escott N,et al.Expression of integrins and Toll-like receptors in cervical cancer:effect of infectious agents[J].Innate Immun,2012,18(1):55-69.
[15]Samara KD,Antoniou KM,Karagiannis K,et al.Expression profiles of Toll-like receptors in non-small cell lung cancer and idiopathic pulmonary fibrosis [J].Int J Oncol,2012,40(5):1397-1404.
[16]Pinto A,Morello S,Sorrentino R.Lung cancer and Toll-like receptors [J].Cancer Immunol Immunother,2011,60(9):1211-1220.
[17]González-Reyes S,Fernández JM,González LO,et al.Study of TLR3,TLR4,and TLR 9 in prostate carcinomas and their association with biochemical recurrence[J].Cancer Immunol Immunother,2011,60(2):217-226.
[18]Theodoropoulos GE,Saridakis V,Karantanos T,et al.Toll-like recept-ors gene polymorphisms may confer increased susceptibility to breast cancer development[J].Breast,2012,21(4):534-538.
[19]Cai Z,Sanchez A,Shi Z,et al.Activation of Toll-like receptor 5 on breast cancer cells by flagellin suppresses cell proliferation and tumor growth [J].Cancer Res,2011,71(7):2466-2475.
[20]Goto Y,Arigami T,Kitago M,et al.Activation of toll-like receptors 2,3,and 4 on human melanoma cells induces inflammatory factors[J].Mol Cancer Therapeutics,2008,7(11):3642-3653.
[21]Roh YS,Seki E.Toll-like receptors in alcoholic liver disease,nonalcoholic steato hepatitis and carcinogensis[J].J Gastroenterol Hepatol,2013,28(Suppl 1):38-42.
[22]Junjie X,Songyao J,Minmin S,et al.The association between Toll-like receptor 2 single-nucleotide polymorphisms and hepatocellular carcinoma susceptibility[J].BMC Cancer,2012,12:57.
[23]French SW,Oliva J,French BA,et al.Alcohol,nutrition and liver cancer:Role of Toll-like receptor signaling[J].World J Gastroenterol,2010,16(11):1344-1348.
[24]Mencin A,Kluwe J,Schwabe RF.Toll-like receptors as targets in chronic liver diseases[J].Gut,2009,58(5):704-720.
[25]Sikora J,Frydrychowicz M,Kaczmarek M,et al.TLR receptors in laryngeal carcinoma-immunophenotypic,molecular and functional studies[J].Folia Histochem Cytobiol,2010,48(4):624-631.
[26]張建軍,吳河水,王 琳,等.TLR2和TLR4在胰腺癌中的表達及其意義[J].中國普通外科雜志,2010,19(03):239-244.
[27]Camilla Rydberg,Anne M?nsson,Rolf Uddman,et al.Toll-like receptor agonists induce inflammation and cell death in a model of head and neck squamous cell carcinomas [J].Immunology,2009,128(1 suppl):e600-e611.
[28]Tsan MF.Tol1-like receptors,inflammation and cancer[J].Semin Cancer Biol,2006,16:32-37.
[29]Takeda K,Kaisho T,Akira S,et al.Toll-like receptors[J].Annu Rev Immunol,2003,21:335-376.
[30]Sato Y,Goto Y,Narita N,et al.Cancer cells expressing Toll-like r-eceptors and the tumor microenvironment[J].Cancer Microenviron,2009,2(1):205-214.
[31]Ellerman JE,Brown CK,De Vera M,et al.Masquerader:high mobility group box-1 and cancer[J].Clin Cancer Res,2007,13(10):2836-2848.
[32]Akira S,Uematsu S,Takeuchi O.Pathogen recognition and innate immunity[J].Cell,2006,124(4):783-801.
[33]Rakoff-Nahoum S,Medzhitov R.Toll-like receptors and cancer[J].Nat Rev Cancer,2009,9:57-63.
[34]Kuper H,Adami HO,Trichopoulos D.Infections as a major preventable cause of human cancer[J].Intern Med,2000,248:171-183.
[35]尉秀清,郭云蔚,文卓夫,等.慢性重型乙型肝炎患者外周血單核細胞Toll樣受體4的變化及其與IL-6的關系[J].中國病理生理雜志,2007,23(8):1563-1565.
[36]Chen JD,Liu CJ,Lee PH,et al.Hepatitis B genotypes correlate with tumor recurrence after curative resection of hepatocellular carcinoma[J].Clin Gastroenterol Hepatol,2004,2(1):64-71.
[37]Bauer AK,Dixon D,DeGraff LM,et al.Toll-like receptor 4 in butylated hydroxytoluene-inducedmouse pulmonary inflammation and tumorigenesis [J].J Natl Cancer Inst,2005,97(23):1778-1781.
[38]He W,Liu Q,Wang L,et al.TLR 4 signaling promotes immune escape of human lung cancer cells by inducing immunosuppressive cytokines and apoptosis resistance[J].Mol Immunol,2007,44:2850-2859.
[39]Chochi K,Ichikura T,Kinoshita M,et al.Helicobacterpylori augments growth of gastric cancers via the lipopolysaccharide toll-like receptor 4 pathway whereas its lipopolysaccharide attenuates antitumor activities of human mononuclear cells[J].Clin Cancer Res,2008,14(10):2909-2917.
[40]Sheyhidin I,Nabi G,Hasim A,et al.Over expression of TLR3,TLR4,TLR7 and TLR9 in esophageal squamous cell carcinoma[J].World J Gastroenterol,2011,17(32):3745-3751.
[41]Marx J.Inflammation and cancer:the link grows stronger[J].Science,2004,306:966-968.
[42]Nakanishi C,Toi M.Nuclear factor-kappa B inhibitors as sensitizers to anticancer drugs [J].Nat Rev Cancer,2005,5(4):297-309.
[43]Kelly MG,Alvero AB,Chenr R,et al.TLR 4 signaling promotes tumor growth and paelitaxel chemoresistancein ovarian cancer[J].Cancer Res,2006,66(7):3859-3868.
[44]Hua D,Liu MY,Cheng ZD,et al.Small interfering RNA-directed targeting of Toll-like receptor 4 inhibits human prostate cancer cell invasion,survival,and tumorigenicity [J].Mol Immunol,2009,6(15):2876-2884.
[45]Wang EL,Qian ZR,Nakasono M,et al.High expression of Tolllike receptor 4/myeloid differentiation factor 88 signals correlates with poor prognosis in colorectal cancer[J].Br J Cancer,2010,102(5):908-915.
[46]Schmausser B,Andrulis M,Endrich S,et al.Toll-like receptors TLR 4,TLR 5 and TLR 9 on gastric carcinoma cells:an implication for interaction with Helicobacterpylori[J].Int J Med Microbiol,2005,295(3):179-185.
[47]張譽藝,屈 靜,張 建.TLR4活化對肝癌細胞H7402生物學特征的影響[J].中國免疫學雜志,2012,8(28):695-700.
[48]Tanga FY,Nutile-McMenemy N,DeLeo JA.The CNS role of Toll-like receptor 4 in innate neuroimmunity and painful neuropathy[J].Proc Natl Acad Sci,2005,102(16):5856-5861.
[49]Albini A,Sporn MB.The tumor microenvironment as a target for chemoprevention[J].Nat Rev Cancer,2007,7(2):139-147.
[50]Salaun B,Lebecque S,Matikainen S,et al.Toll-like receptor 3 expre-ssed by melanoma cells as a target for therapy?[J].Clin Cancer Res,2007,13(15 Pt 1):4565-4574.
[51]Andreani V,Gatti G,Simonella L,et al.Activation of Toll-like receptor 4 on tumor cells in vitro inhibits subsequent tumor growth in vivo[J].Cancer Res,2007,67(21):10519-10527.
[52]Song DH,Lee JO.Sensing of microbial molecular patterns by Toll-like receptors[J].Immunol Rev,2012,250(1):216-229.
[53]Fukata M,Abreu MT.Pathogen recognition receptors,cancer and inflammation in the gut[J].Curr Opin Pharmacol,2009,9(6):680-687.
[54]Tanaka T,Legat A,Adam E,et al.DiC14-amidine cationic liposomes stimulate myeloid dendritic cells through Toll-like receptor 4 [J].Eur J Immunol,2008,38(5):1351-1357.
[55]Finlay BB,Hancock RE.Can innate immunity be enhanced to treat microbial infection?[J].Nat Rev Micorbiol,2004,6(2):497-504.
[56]Yamamoto M,Sato S,Hemmi H,et al.Role of adaptor TRIF in the MyD88-independent toll-like receptor signaling pathway[J].Science,2003,301:640-643.
[57]Ridnour LA,Cheng RY,Switzer CH,et al.Molecular pathways:Toll-like receptors in the tumor microenvironment--poor prognosis or new therapeutic opportunity [J].Clin Cancer Res,2013,19(6):1340-1346.
[58]Krishnan J,Selvarajoo K,Tsuchiya M,et al.Toll-like receptor signal transduction[J].Exp Mol Med,2007,39(4):421-438.
[59]Kijima T,Niwa H,Steinman RA,et al.STAT3 activation abrogates growth factor dependence and contributes to head and neck squamous cell carcinoma tumor growth in vivo [J].Cell Growth Differ,2002,13:355-362.

