紫花地丁含藥血清對巨噬細胞吞噬功能及TOLL樣受體表達的影響①
張智偉 蔡 琨 吳瑪莉 于紅紅 冷 泠 岳文鵬 田維毅
(貴陽中醫學院基礎醫學院,貴陽 550002)
紫花地丁載于《本草綱目》,具有清熱解毒、涼血消腫、消癰散結的功效。臨床報道,紫花地丁常用于治療腮腺炎、蜂窩組織炎、癤腫、靜脈炎、自身免疫性不孕、過敏性紫癜性腎炎等炎癥性和免疫性疾病[1-6]。巨噬細胞是機體炎癥和免疫反應的重要調控因素,其功能狀況與機體炎癥/免疫過程密切相關。巨噬細胞表面Toll樣受體(Toll-like receptors,TLRs)是近年來發現的一類重要模式識別受體,在巨噬細胞上有大量分布,是其活化和釋放炎癥細胞因子的重要信號通路[7]。巨噬細胞Toll樣受體在哺乳動物已發現13個成員,其中以TLR-1~5的研究尤為多見。在我們前期研究中發現,紫花地丁含藥血清在一定濃度下對巨噬細胞分泌NO、TNF-α和IL-6具有顯著調節作用。有文獻報道,在炎癥反應初期,適量的NO、TNF-α分泌是機體對抗炎癥的積極反應,但是如果它們持續不斷地釋放則會導致炎癥的不斷擴大、加重[8]。為了進一步探索紫花地丁干預巨噬細胞分泌炎癥因子的機制,本文采用血清藥理方法,考察了紫花地丁含藥血清對巨噬細胞吞噬功能和Toll樣受體1~5mRNA表達的影響。
1 材料與方法
1.1 主要儀器 NU-440-400E型生物安全柜(美國Nuair),MK3型酶標儀(美國 Thermo),F-32水浴鍋(德國 Julabo),Biometra TProfessional Thermocycler PCR儀(德國Biometra),CO2培養箱(美國Thermo),BIO-RAD GelDoc 2000凝膠成像系統(美國伯樂)。
1.2 主要試劑 DMEM培養基(美國Gibco),Trizol reagent(美國 Invitrogen),逆轉錄試劑盒與 Taq酶(大連寶生物),PCR反應引物(北京鼎國昌盛生物科技有限公司合成),中性紅(上海試劑三廠)。
1.3 實驗藥物 中藥紫花地丁購自北京同仁堂藥店貴陽店,經貴陽中醫學院生藥實驗室鑒定為正品。采用常規方法制備水煎劑,按8 ml(水)∶1 g(生藥)比例,加超純水浸泡30 min,煮沸30 min,趁熱4層紗布過濾,濾液自然滴盡,第2煎按6 ml(水)∶1 g(生藥)比例加水,如前法煮沸30 min并過濾,合并兩次濾液,加熱濃縮成相當于生藥3 g/ml的水煎液,4℃保存,1周內使用。
1.4 實驗動物 制備含藥血清選用清潔級SD大鼠,雄性,體重180~200 g;制備腹腔巨噬細胞選用清潔級KM小鼠,雌雄不分,體重18~22 g。實驗動物均購自貴陽醫學院實驗動物中心[動物合格證SCXK(黔)2002-0001]。
1.5 紫花地丁含藥血清的制備 將實驗大鼠隨機分為正常血清對照組和紫花地丁含藥血清組,每組10只,紫花地丁含藥血清組每天以15 g/kg(大鼠體重)分2次(12 h 1次)灌胃,給藥體積為1 ml/100 g,對照組代以等體積生理鹽水,連續3 d。最后一次給藥前12 h禁食不禁水,每組于最后一次給藥后0.5 h開始隨機抽取1只大鼠股動脈采血,每10 min采集1只,到2 h采完。所有血液常溫靜置4 h后3 000 r/min離心10 min,收集上清并混合,56℃30 min滅活補體,22 μm 過濾除菌,-80℃保存備用。根據前期觀察含藥血清的細胞毒性實驗結果,選用對巨噬細胞安全的5%~20%含藥血清為本實驗的血清濃度。
1.6 小鼠腹腔巨噬細胞的制備 小鼠腹腔注射3%硫代乙醇酸鈉1 ml,3 d后,常規無菌操作向腹腔內注入10 ml磷酸鹽緩沖液(PBS),輕揉腹部3~5 min,用吸管收集腹腔液,1 000 r/min離心5 min,PBS液洗滌細胞3次,棄上清,加入含15%滅活胎牛血清的DMEM培養液,調整細胞濃度至5×106個/ml。在96孔板中,每孔加入細胞懸液100 μl,37℃、5%CO2溫育貼壁2 h后立即用于下列實驗。
1.7 中性紅法檢測巨噬細胞吞噬活性 在上述96孔板中,將貼壁2 h后的細胞懸液棄上清,然后加入用含血清的DMEM培養液配制的濃度為0.002 g/ml的中性紅溶液200 μl/孔,置37℃、5%CO2培養3 h,棄中性紅溶液,PBS沖洗3次,每孔加入細胞裂解液(體積分數50%的乙酸和體積分數50%的無水乙醇的混合液)200 μl,室溫下放置24 h,待細胞溶解后,492 nm測定吸光度。
1.8 RT-PCR法檢測巨噬細胞TLR-1、TLR-2、TLR-3、TLR-4、TLR-5 mRNA表達 取上述培養24 h的細胞,按說明書用Trizol法提取總RNA為模板,以Oligo-dT為引物逆轉錄合成 cDNA。PCR引物按NCBI中Primer-BLAST設計,序列如表1。反應條件:94℃,45 s;53℃,45 s;72℃,1 min;35 cycles。反應體系:ddH2O 17.5 μl,10×PCR buffer 2.5 μl,10×dNTP Mix 2.5 μl,Primer1 0.5 μl,Primer2 0.5 μl,Taq plusDNA 0.5 μl,cDNA 1 μl。先將 GAPDH 電泳結果由Quantity One軟件采用等高線定量法分析,確定添加模板量,進而調整添加模板與滅菌水的比例并進行PCR,Quantity One軟件分析電泳結果。同時將所得PCR產物進行膠回收,送上海生工生物工程股份有限公司單向測序,并在 NCBI中進行BLAST分析其吻合度,結果見表1。
1.9 統計學分析 實驗結果采用SPSS17.0統計軟件分析。檢測數據以表示,P<0.05 為差異具有顯著性。
2 結果
2.1 紫花地丁含藥血清對小鼠腹腔巨噬細胞吞噬功能的影響 圖1結果顯示,與相同濃度正常血清對照組比較:紫花地丁含藥血清各濃度組巨噬細胞中性紅吞噬量明顯升高(P<0.01)。
2.2 紫花地丁含藥血清對小鼠腹腔巨噬細胞TLR-1、TLR-2、TLR-3、TLR-4、TLR-5 mRNA 表達的影響圖2和表2結果顯示,與相同濃度正常血清對照組比較:(1)TLR-1mRNA表達量:5%濃度組顯著升高(P<0.01),而10%和20%濃度組顯著降低(P<0.05或 P<0.01);(2)TLR-2mRNA表達量:10%濃度組量顯著降低(P<0.01),而20%濃度組顯著升高(P<0.01);(3)TLR-3mRNA表達量:5%濃度組升高(P<0.05),而 10%濃度組顯著降低(P<0.01);(4)TLR-4mRNA表達量:各濃度組無顯著變化(P>0.05);(5)TLR-5mRNA表達量:各濃度組顯著升高(P<0.01)。
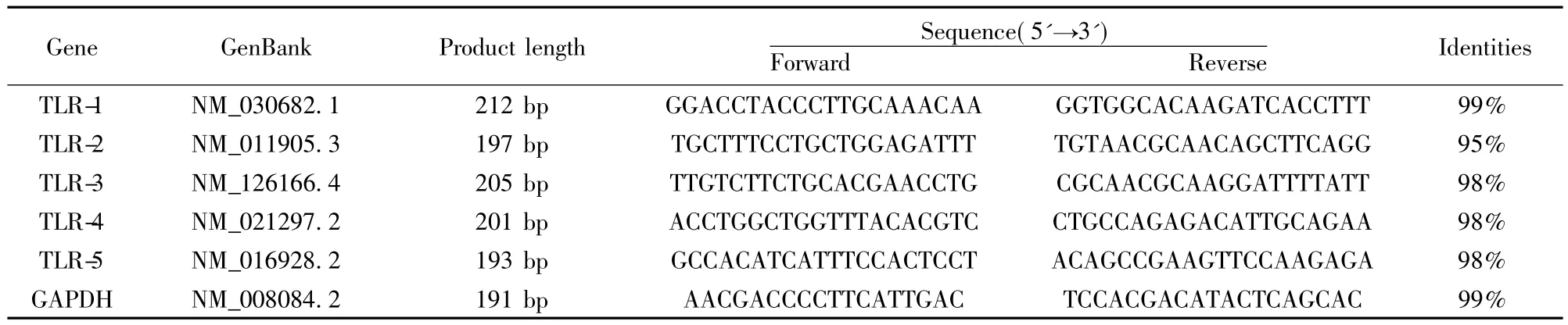
表1 RT-PCR的引物及產物的吻合度Tab.1 Primers for RT-PCR and identities of product
表2 紫花地丁含藥血清對小鼠腹腔巨噬細胞TLR-1~5 mRNA表達量的影響(,n=8)Tab.2 Effects of viola-containing serum on expression level of TLR-1-5 mRNA in mouse macrophages(,n=8)

表2 紫花地丁含藥血清對小鼠腹腔巨噬細胞TLR-1~5 mRNA表達量的影響(,n=8)Tab.2 Effects of viola-containing serum on expression level of TLR-1-5 mRNA in mouse macrophages(,n=8)
Note:1)P<0.05,compared with the same concentration of normal serum group;2)P<0.01,compared with the same concentration of normal serum group.
.51 10.49±1.32 3.51±2.90 10 15.55±2.00 11.20±1.00 10.33±2.18 11.56±4.56 4.23 ±2.36 20 5.10±0.51 7.32±0.16 3.74±2.37 6.75±1.58 2.52±1.80 Viola-containing serum 5 15.12±1.602) 11.14±1.02 17.67±3.111) 10.02±1.71 11.69±3.132)10 9.54±1.412) 8.81±1.102) 3.77±1.342) 8.99±2.34 14.43±1.952)20 3.30±1.351) 8.87±0.992) 3.08±1.98 5.94±1.40 14.57±2.932)-4 TLR-5 Normal serum 5 10.53±2.73 10.45±1.89 13.09±1 Groups Serum concentration(%)%Adj.Vol.(Relative gray values)TLR-1 TLR-2 TLR-3 TLR
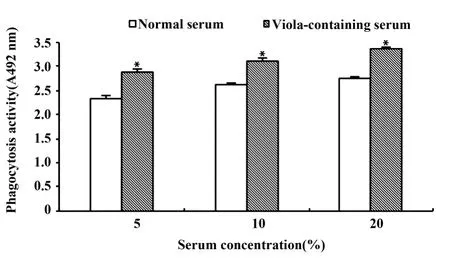
圖1 紫花地丁含藥血清對小鼠腹腔巨噬細胞吞噬功能的影響(n=8)Fig.1 Effectsofviolacontaining serum on mouse macrophages phagocytosis activity(n=8)
3 討論
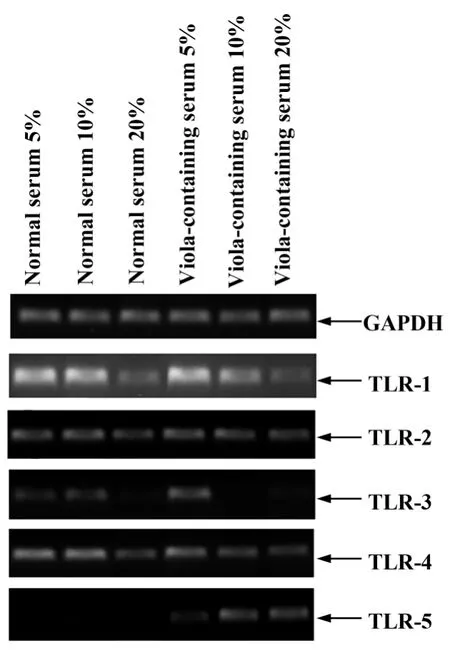
圖2 小鼠腹腔巨噬細胞 TLR-1、TLR-2、TLR-3、TLR-4、TLR-5 mRNA表達Fig.2 Expression of TLR-1,TLR-2,TLR-3,TLR-4 and TLR-5 mRNA in mouse macrophages
血清藥理學方法由日本學者田代真一在上世紀80年代提出[9]。這種方法具有實驗周期短、條件易于控制、結果易于觀察等特點。因其“半體內”特點更貼近中藥在體內發揮藥理作用,被廣泛應用于中藥作用機制的研究。巨噬細胞是機體免疫系統的重要細胞成員,具有識別和吞噬異物、提呈抗原、分泌多種活性介質等作用,參與維持機體的免疫穩態[10]。靜息狀態的巨噬細胞功能低下,只有在活化狀后才能發揮較強的吞噬、分泌、炎癥和免疫調控等功能[10]。為了探索紫花地丁對巨噬細胞活化作用及其機制,我們考察了紫花地丁含藥血清對巨噬細胞吞噬功能和Toll樣受體1~5mRNA表達的影響。
本實驗結果顯示:(1)紫花地丁含藥血清各濃度組較正常血清組巨噬細胞中性紅吞噬量明顯升高(P<0.01);(2)紫花地丁含藥血清一定濃度組TLR-1、TLR-2和TLR-3的mRNA表達量表現出升高或降低(P<0.05或 P<0.01),TLR-4mRNA 表達量無顯著變化(P>0.05),TLR-5mRNA表達量顯著升高(P<0.01)。實驗結果提示:紫花地丁含藥血清對巨噬細胞吞噬功能具有明顯促進作用;對不同TOLL樣受體mRNA表達量的干預作用則表現各異。Farhat等[12]報道 TLR-1與 TLR-2可協同發揮識別作用;王梁華等[13]報道TLR-2的多抗能部分抑制LPS激活巨噬細胞吞噬金葡萄球菌的能力,也能部分阻斷對U937細胞的吞噬活性;Wang等[14]報道,在西尼羅病毒感染的小膠質細胞中TLR-3缺乏導致IL-6和TNF-α分泌減少;張代娟等[15]報道青心酮預處理能顯著上調可溶性Toll樣受體4(sTLR4)mRNA及蛋白表達,減少TNF-α分泌,抑制炎癥反應;趙保勝等報道,黃連解毒湯能阻斷TLR-4高表達,阻斷TLR-4胞內信號轉導的MyD88依賴和非依賴兩條途徑(以阻斷非依賴途徑為主),抑制相關基因表達產物TNF-α、IFN-β過度分泌,具有 TLR4拮抗劑樣作用[16];李巖等[17]報道黃芩苷可以抑制脂多糖介導的TLR-4表達增高,同時減弱脂多糖誘導的TLR4信號途徑激活,抑制I-κB降解,降低TNF-α表達;Hayashi等[18]報道TLR-5可調動核因子 NF-κB并刺激TNF-α分泌。我們前期研究顯示,一定濃度的紫花地丁含藥血清能促進巨噬細胞分泌TNF-α、NO(P<0.05 或 P<0.01);而對 IL-6 分泌具有雙向調節作用(P<0.01)。結合本實驗結果,推測紫花地丁含藥血清調控巨噬細胞TOLL樣受體的表達可能是該藥干預巨噬細胞吞噬功能和分泌炎癥因子的途徑之一;同時紫花地丁作為臨床抗感染和抗炎治療的常用中藥,其基于巨噬細胞的免疫和炎癥干預作用可能是該藥臨床療效的中藥機制。
在本實驗結果中,不同濃度的正常血清組巨噬細胞TLR-1~5的表達量存在差異,這可能是因血清中原有的TOLL樣受體調控物質表現出的量效差異性;同時,本實驗不同濃度的含藥血清對巨噬細胞TLR-1~3的表達量呈現雙向調節作用,這反映了中藥成分及其藥理效應的復雜性和多樣性,其具體機制有待進一步探索。
[1]莊淑萍.紫花地丁方治療腮腺炎[J].山東中醫雜志,2002,21(5):311.
[2]葉春芝.紫花地丁治療蜂窩組織炎[J].浙江中醫雜志,2006,41(3):170.
[3]張勤義,杜桂玲.紫花地丁治療癤腫療效觀察[J].中國社區醫師,2005,21(1):36.
[4]林樹德,黃曉紅,張臻穎.紫花地丁泥治療靜脈炎50例[J].福建醫藥雜志,1993,15(4):72.
[5]祁天壽,李國慶,徐貴江,等.自擬消抗種子方治療抗精子抗體陽性男性不育的臨床觀察[J].中國中西醫結合雜志,2007,27(11):983-985.
[6]孫開展,史春青.中西醫結合治療過敏性紫癜性腎炎療效觀察 [J].四川中醫,1997,15(3):26-27.
[7]何小兵,賈懷杰,景志忠.Toll樣受體對病原真菌的天然免疫識別[J].中國生物工程雜志,2012,32(12):86-92.
[8]徐智敏,唐彥君,劉 寧.Lactobacillus casei胞外多糖對體外培養的巨噬細胞分泌TNF-α、NO及IL-10的影響[J].中國免疫學雜志,2013,29(8):809-812,815.
[9]田代真一.和漢藥の實驗的研究におる諸問題-invitro實驗の問題[J].和漢醫藥學會雜志,1991,(3):218-221.
[10]Fujiwara N ,Kobayashi K.Macrophages in inflammation[J].Curr Drug TargetsInflamm Allergy,2005,4(3):281-286.
[11]顧曙余,梁魯曉雪,李 蓮,等.“小鼠腹腔巨噬細胞吞噬實驗”方法的改進與研究[J].安徽農學通報,2013,19(23):17-18.
[12]Farhat K,Riekenberg S,Heine H,et al.Heterodimerization of TLR2 with TLR1 or TLR6 expands the ligand spectrum but does not lead to differential signaling[J].J Leukocyte Biol,2008,83(3):692-701.
[13]王梁華,馮 煜,鐘 山,等.Toll樣受體抗體抑制脂多糖激活巨噬細胞的吞噬活性[J].生物化學與生物物理進展,2001,28(3):367-371.
[14]Wang T,Town T,Alexopoulou L,et al.Toll-like receptor 3 medi ates WestNilevirusentryinto thebrain causing lethal encephalitis[J].Nature Medicine,2004,10(12):1366-1373.
[15]張代娟,武少杰,劉同美,等.青心酮對RAW264.7細胞可溶性Toll樣受體4表達及TNF-α的影響[J].濰坊醫學院學報,2006,28(4):264-265,插頁Ⅱ.
[16]趙保勝,劉洪斌 ,馬悅穎,等.黃連解毒湯含藥血清對Toll樣受體3、4型及其下游信號轉導通路的影響[J].中國實驗方劑學雜志,2007,13(5):15-20.
[17]李 巖,李 明,李建婷,等.黃芩苷對脂多糖誘導的巨噬細胞Toll樣受體4表達的影響[J].中國動脈硬化雜志,2009,17(12):985-988.
[18]Hayashi F,Smith KD,Ozinsky A,et al.The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5[J].Nature,2001,410(6832):1099-1103.

