Smoothened、STAT3和MMP-9在三陰性乳腺癌中的表達及臨床意義
方 明 康 樂 陳英杰 劉 健 馬君燕 陶雅軍
(大連醫科大學附屬第一醫院,大連 116001)
乳腺癌是一種異質性疾病,臨床病理分型較為復雜,因此根據乳腺癌基因表達譜對每一型乳腺癌患者進行個體化治療非常重要。三陰性乳腺癌(Triple negative breast cancer,TNBC)是乳腺癌的一種亞型,指雌激素受體(Estrogen receptor,ER)、孕激素受體(Progesterone receptor,PR)均陰性且人類表皮生長因子受體2(Human epidermal growth factor receptor-2,HER-2)無過表達的乳腺癌。TNBC約占全部乳腺癌的10%~17%,和其他類型乳腺癌相比,其更富有侵襲性,轉移早、復發率高,患者生存時間明顯縮短[1-3]。
盡管還沒有明確的鑒定標志,但電鏡研究已揭示位于乳腺導管基底及其上部、數量極少、未分化呈電子半透明狀的細胞即為乳腺干細胞[4]。成體干細胞因其壽命長且相對未分化,能夠累積各種突變,因此成為癌癥發生的可能靶標。在三陰性乳腺癌組織中含有較多的基底樣型癌細胞,乳腺癌干細胞可能位于其中,故推測三陰性乳腺癌患者的預后較其他類型乳腺癌差的重要原因是其腫瘤組織中乳腺癌干細胞的數量更多或活化程度更高。Smoothened(SMO)基因是參與調控腫瘤干細胞活化的重要基因,信號轉導子及轉錄活化子3(Signal transducers and activators of transcription,STAT3)在腫瘤干細胞自我維持與更新中具有重要作用,因此亦被看做是參與調控腫瘤干細胞的重要基因。MMP-9在腫瘤的侵襲、浸潤等方面具有重要作用。本研究旨在通過研究SMO、STAT3和MMP-9在三陰性乳腺癌、乳腺增生和正常乳腺組織中的表達差異及與三陰性乳腺癌臨床病理因素的關系,探討它們在乳腺癌干細胞激活及在三陰性乳腺癌發生發展中的作用。
1 材料與方法
1.1 材料 33例三陰性乳腺癌、30例乳腺增生及18例癌旁正常乳腺組織石蠟標本均采集自2008年5月~2012年11月大連市中心醫院病理科存檔標本。33例乳腺癌患者術前均未接受放療、化療、激素或免疫治療,患者平均年齡52.3歲,病理類型均為浸潤性導管癌,病理分期依據AJCC標準[5],其中Ⅰ期8例、Ⅱa期11例、Ⅱb期6例、Ⅲa期4例和Ⅳ期4例。
1.2 試劑與方法 SMO兔抗人單克隆抗體(ab72130)、STAT3兔抗人單克隆抗體(ab15523)均購自英國Abcam公司。鼠抗人MMP-9單克隆抗體、SP廣譜超敏試劑盒、DAB酶底物顯色劑等均購于福建邁新生物技術開發公司。實驗分為三陰性乳腺癌組、乳腺增生組及正常乳腺組,免疫組化SP法及DAB顯色操作步驟均按照說明書進行。按照抗體說明用已知卵巢癌陽性切片作為SMO陽性對照,子宮內膜腺癌陽性切片作為STAT3陽性對照,基底細胞癌陽性切片作為MMP-9陽性對照,以PBS代替一抗作為陰性對照。
1.3 結果判定 SMO和MMP-9蛋白陽性表達均為胞漿內出現棕黃色顆粒,STAT3蛋白陽性表達為胞核內出現棕黃色顆粒。免疫組化結果采用半定量法進行判定,根據染色密度(陰性=0、弱陽性=1、中度陽性=2、強陽性=3)和陽性細胞百分比(0=陰性、1=<25%、2=25%~50%、3=51%~75%、4=>75%)的乘積計算5個高倍視野的免疫反應評分(Immuno-Reactive-Score,IRS)。最后結果:陰性(IRS:0):-,弱陽性(IRS:1-4):+,中度陽性(IRS:5-8):++,強陽性(IRS:9-12):+++。
1.4 統計學分析 數據處理應用SPSS 14.0統計學軟件,采用 χ2檢驗對 SMO、STAT3、MMP-9蛋白在三陰性乳腺癌、乳腺增生和正常乳腺組織中的表達進行分析,用Spearman等級相關分析SMO、STAT3、MMP-9在乳腺癌組織中表達的相關性,生存分析采用Cox回歸的多因素分析,P<0.05具有統計學意義。
2 結果
2.1 SMO、STAT3、MMP-9 蛋白在三陰性乳腺癌、乳腺增生和正常乳腺組織中的表達 SMO蛋白在三陰性乳腺癌和乳腺增生組織中的陽性表達率分別為90.9%和60.0%,在正常乳腺組織中無表達;STAT3蛋白在三陰性乳腺癌和乳腺增生組織中的陽性表達率分別為96.9%和73.3%,在正常乳腺組織中無表達;MMP-9蛋白在三陰性乳腺癌和乳腺增生組織中的陽性表達率分別為90.9%和36.7%,在正常乳腺組織中無表達;SMO、STAT3和MMP-9蛋白表達在三陰性乳腺癌、乳腺增生及正常乳腺組織中均有顯著差異(均 P<0.05),見表1、圖1。

表1 SMO、STAT3、MMP-9蛋白在三陰性乳腺癌、乳腺增生和正常乳腺組織中的表達Tab.1 Expression of SMO,STAT3 and MMP-9 in TNBC,mammary hyperplasia and normal breast tissue
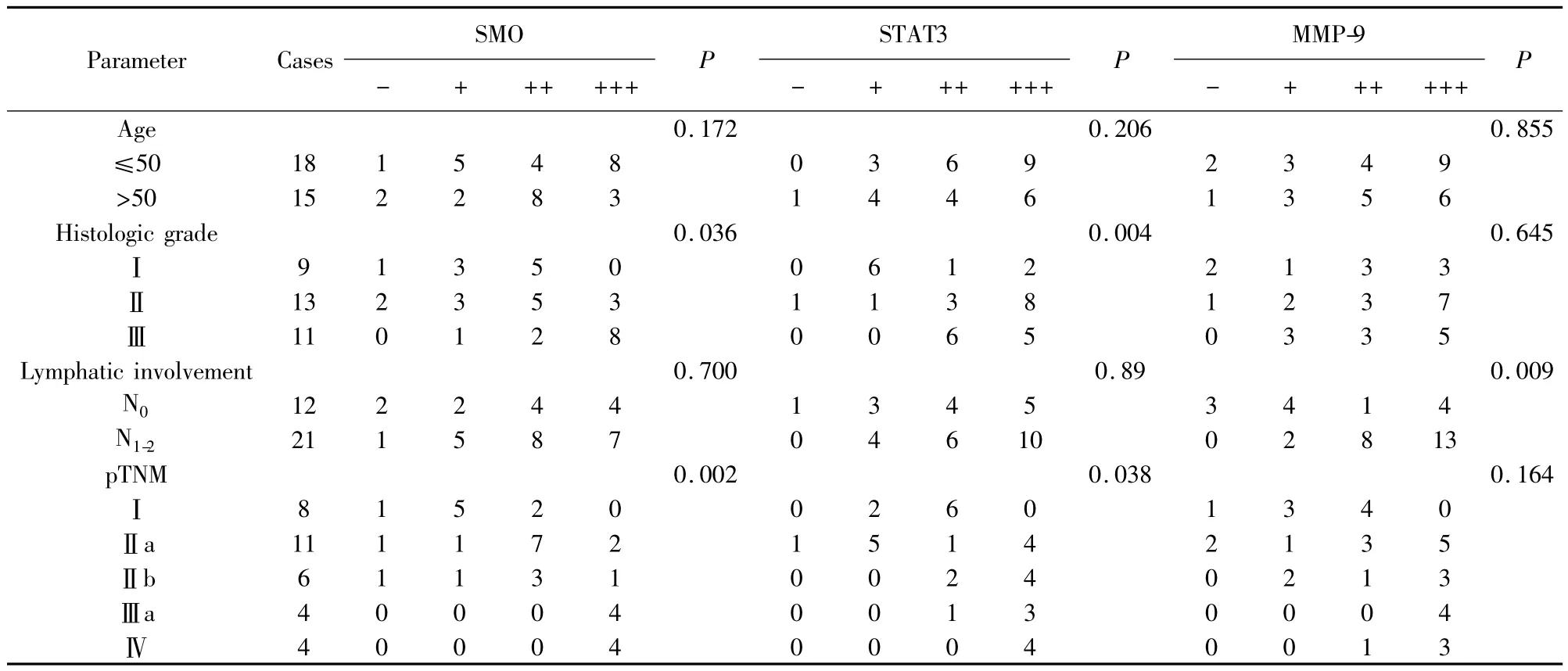
表2 SMO、STAT3、MMP-9蛋白表達與三陰性乳腺癌臨床病理因素的關系Tab.2 Relationships between expression of SMO,STAT3,MMP-9 and clinicopathological parameters in TNBC
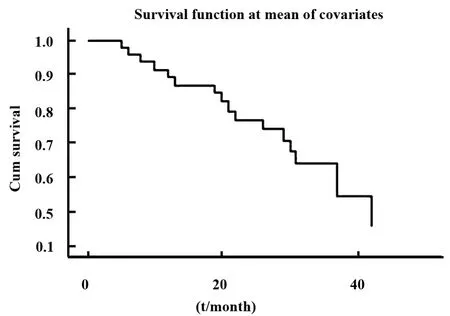
圖2 三陰性乳腺癌患者生存情況Fig.2 Survival data of TNBC
2.2 SMO、STAT3、MMP-9 蛋白表達與乳腺癌臨床病理因素的關系 由表2可知,SMO的表達與乳腺癌組織學分級、pTNM 分期有關(P=0.036,P=0.002),其表達隨著組織學分級和臨床分期的增高而增高;STAT3的表達亦與乳腺癌組織學分級、pTNM 分期有關(P=0.004,P=0.038),其表達隨著組織學分級和臨床分期的增高而增高;SMO和STAT3的表達均與患者年齡、淋巴結轉移無關(均P>0.05);MMP-9的表達與淋巴結轉移有關(P=0.009),與患者年齡、組織學分級以及臨床分期均無關(均P>0.05)。Spearman相關檢驗顯示SMO和STAT3(r=0.361,P=0.039)、SMO 和 MMP-9(r=0.633,P=0.000)、MMP-9 和 STAT3(r=0.803,P=0.000)在三陰性乳腺癌中的表達均相關。
2.3 三陰性乳腺癌患者預后相關因素 三陰性乳腺癌患者生存情況見圖2,Cox回歸分析顯示,最終進入回歸方程的是 SMO[Exp(B)=10.677,P=0.022]和pTNM 分期[Exp(B)=1.889,P=0.002。]
3 討論
目前關于三陰性乳腺癌發生發展的確切機制尚不清楚,但有研究認為癌癥干細胞愈豐富的腫瘤患者其預后愈差。由于三陰性乳腺癌具有復發率高、易轉移、耐藥及生存期短等特點,因此推測在三陰性乳腺癌組織中可能具有較多的處于活化狀態的癌癥干細胞,并且相關調控基因的表達異常在癌癥干細胞的活化過程中起了非常重要的作用。SMO基因屬于原癌基因,編碼SMO蛋白負責Hedgehog信號通路的傳導,對于癌癥干細胞自我更新及分化潛能的維持至關重要,其突變與皮膚、腦、肝、肺、前列腺、胰腺、卵巢等器官的惡性腫瘤發生均有關[6-8]。本研究發現在乳腺增生組織中SMO的表達增加,且與正常乳腺組織相比具有顯著性差異,提示在乳腺組織中細胞的增殖與SMO的激活有關,推測SMO可能參與誘導乳腺干細胞進入細胞周期以擴大乳腺干細胞池進而促進乳腺增生的形成。而與乳腺增生相比,在三陰性乳腺癌組織中SMO的表達亦明顯增加,提示在正常乳腺-乳腺增生-三陰性乳腺癌這一連續發展的過程中SMO的激活可能參與乳腺干細胞向乳腺癌干細胞的轉化從而促進乳腺癌的發生。Moraes等[9]報道在MMTV啟動子控制下的人SMO(SmoM2)激活可導致轉基因鼠乳腺導管增生、增強原始乳腺球的形成能力、促進早期乳腺癌的發展,這與本研究結果一致。STAT3基因是人類胚胎期干細胞自我更新的重要基因,在很多上皮組織惡性腫瘤中均有激活。活化的STAT3介導多種基因的表達,如twist、snail、IL-8以及干細胞標志Oct-4等,可抑制腫瘤細胞凋亡、促進腫瘤細胞增殖與轉移、抑制抗腫瘤免疫應答等,與腫瘤患者的預后密切相關[10,11]。此外,有研究表明STAT3的激活能促進癌癥干細胞的增殖并抑制其分化,而抑制STAT3的表達則可阻止癌癥干細胞的生長[12]。本研究發現在乳腺增生和三陰性乳腺癌組織中STAT3的表達均增加,且STAT3的表達在三陰性乳腺癌、乳腺增生和正常乳腺組織中均具有顯著性差異,提示STAT3的激活可能參與乳腺干細胞向乳腺癌干細胞的轉化進而促進乳腺癌的發生。在本研究中SMO和STAT3蛋白的表達均隨著組織學分級和臨床分期的增高而增高,且SMO的表達與STAT3具有相關性,提示SMO和STAT3可能協同調控乳腺癌干細胞的激活進而參與到乳腺癌的進一步發展過程中。MMP-9是降解細胞外基質的主要酶類,可分解基底膜中的纖維連接蛋白和層粘連蛋白促進腫瘤細胞的遷移,MMP-9亦是STAT3的下游作用因子[13],而MMP-9的活化又可進一步激活STAT3[14]。本研究顯示MMP-9的表達與乳腺癌的淋巴結轉移有關,且MMP-9的表達與SMO和STAT3的表達均明顯相關,提示活化的SMO和STAT3可能通過與MMP-9的相互作用進而促進乳腺癌的浸潤和轉移。本研究還發現SMO的高表達與三陰性乳腺癌患者的生存期短明顯相關,進一步說明SMO的靶標可能就是干細胞。這些研究結果提示SMO和STAT3在三陰性乳腺癌的發生發展中具有重要作用,其可作為三陰性乳腺癌患者治療的重要靶標,但SMO和STAT3如何促進乳腺干細胞的惡性轉化,SMO和STAT3之間的相互關系等問題還需深入研究。
[1]Sotiriou C,Phil D,Pusztaj J.Gene-expression signatures in breast cancer[J].N Engl J Med,2009,360(8):790-800.
[2]Rakha EA,Elsheikh SE,Aleskandarany MA,et al.Triplenegative breast cancer:distinguishing between basal and nonbasal subtypes[J].Clin Cancer Res,2009,15(7):2302-2310.
[3]Lim KH,Oh DY,Chie EY,et al.Metaplastic breast carcinoma:clinicopathologic features and prognostic value of triple negativity[J].Jpn J Clin Oncol,2010,40(2):112-118.
[4]Chepko G,Dickson RB.Ultrastructure of the putative stem cell niche in rat mammary epithelium[J].Tissue Cell,2003,35(2):83-93.
[5]Singletary SE,Connolly JL.Breast cancer staging:working with the sixth edition of the AJCC Cancer Staging Manual[J].CA Cancer J Clin,2006,56(1):37-47.
[6]Yauch RL,Dijkgraaf GJ,Alicke B,et al.Smoothened mutation confers resistance to a Hedgehog pathway inhibitor in medulloblastoma[J].Science,2009,326(5952):572-574.
[7]Chen X,Horiuchi A,Kikuchi N,et al.Hedgehog signal pathway is activated in ovarian carcinomas,correlating with cell proliferation:it's inhibition leads to growth suppression and apoptosis[J].Cancer Sci,2007,98(1):68-76.
[8]Karhadkar SS,Bova GS,Abdallah N,et al.Hedgehog signalling in prostate regeneration,neoplasia and metastasis[J].Nature,2004,431(7009):707-712.
[9]Moraes RC,Zhang X,Harrington Net al.Constitutive activation of smoothened(Smo)in mammary glands of transgenic mice leads to increased proliferation,altered differentiation and ductal dysplasia[J].Development,2007,134(6):1231-1242.
[10]Deng J,Liu Y,Lee H,et al.S1PR1-STAT3 signaling is crucial for myeloid cell colonization at future metastatic sites[J].Cancer Cell,2012,21(5):642-654.
[11]Johnston PA,Grandis JR.STAT3 SIGNALING:Anticancer Stra tegies and Challenges[J].Mol Interv,2011,11(1):18-26.
[12]Tang Y,Luo Y,Jiang Z,et al.Jak/Stat3 signaling promotes so matic cell reprogramming by epigenetic regulation[J].Stem Cells,2012,30(12):2645-2656.
[13]Wang XH,Liu BR,Qu B,et al.Silencing STAT3 may inhibit cell growth through regulating signaling pathway,telomerase,cell cycle,apoptosis and angiogenesis in hepatocellular carcinoma:potential uses for gene therapy[J].Neoplasma,2011,58(2):158-171.
[14]Kotipatruni RR,Nalla AK,Asuthkar S,et al.Apoptosis induced by knockdown of uPAR and MMP-9 is mediated by inactivation of EGFR/STAT3 signaling in medulloblastoma[J].PLoS One,2012,7(9):e44798.

