抗TLR2抗體抑制小鼠金黃色葡萄球菌肺炎炎癥反應①
溫順航 林 立 李昌崇 蘇小燕 張慧玲 吳滬軍
(溫州醫科大學附屬育英兒童醫院呼吸科,溫州 325000)
金黃色葡萄球菌(Staphylococcus aureus,SA)是肺炎的常見病原菌之一,常引起肺膿腫、胸腔積液等嚴重炎癥反應并發癥,但其具體機制尚不清楚。Toll樣受體2(Toll-like receptor 2,TLR2)是識別SA病原相關分子模式(Pathogen-associated molecular patterns,PAMP)的最重要模式識別受體(Pattern recognition receptor,PRR),調節細胞因子、趨化因子的產生和炎癥細胞招募及激活等炎癥反應[1]。已有報道[2],在敗血癥模型中抗TLR2抗體可以阻斷TLR2介導的炎癥反應,但其在小鼠SA肺炎炎癥反應方面的研究未見報道。本研究采用抗TLR2抗體阻斷TLR2介導的炎性通路,觀察其對小鼠SA肺炎炎癥反應的影響。
1 材料與方法
1.1 動物及材料 60只SPF級5~7周C57BL/6J小鼠購自上海史萊克實驗動物有限公司,體重16~20 g,隨機分為:對照組、SA肺炎組和抗TLR2抗體組,再根據觀察時間不同,各分為3 d和8 d亞組,共6小組,每組10只。抗TLR2抗體(T2.5,ab16894)及免疫組化TLR2一抗(ab24194)購自英國abcom公司;角質細胞源細胞因子(KC)、IL-10 ELISA試劑盒為PeproTech公司生產;TSA培養基、腦心浸液肉湯和無內毒素的PBS購自美國Gibco公司。
1.2 細菌及菌液制備 SA(ATCC25923)菌株來源于溫州醫科大學附屬育英兒童醫院檢驗科,本實驗室保存。SA劃線接種到TSA平板,并在37℃條件下培養過夜,挑取菌落接種到腦心浸液肉湯,37℃培養6 h以達到細菌生長曲線對數期。離心機3 500 r/min離心細菌菌液15 min,棄上清,無內毒素的PBS洗滌SA兩次并重懸,用麥氏比濁儀測定SA菌液濃度,調整濃度至1×1010CFU/ml,倍比稀釋后,取3個連續梯度稀釋菌液10 μl劃至TSA平板,37℃培養24 h后,確定菌液活菌濃度。
1.3 小鼠肺炎模型[3]小鼠滴鼻接種前1 d,抗TLR2抗體組小鼠尾靜脈注射抗TLR2抗體(2 μg/只,用無菌生理鹽水稀釋至100 μl)[4],正常組和SA肺炎組尾靜脈注射無菌生理鹽水100 μl。滴鼻接種當天4%水合氯醛麻醉小鼠,將SA菌液50 μl(約含5×108CFU),接種于SA肺炎組及抗TLR2抗體組小鼠鼻尖處,而對照組為無菌PBS 50 μl滴鼻,鼠本能性吸入,保持小鼠直立放置1 min,以利于細菌遷移到肺泡。
1.4 血清獲取及處理 水合氯醛快速麻醉小鼠,摘除右側眼球,采血0.8~1 ml,離心,取上清置-70℃凍存待測。
1.5 支氣管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)獲取及處理 取血后,鋪巾,頸部及胸部備皮,消毒,無菌條件行頸部手術分離氣管進行插管,以1 ml無菌PBS分3次灌洗,其回收率可達到60%~80%。搖勻回收的BALF,取100 μl BALF倍比稀釋后,分別涂布于3塊TSA平板,至37℃培養箱培養24 h后,計菌落數,并革蘭染色及生化鑒定。剩余BALF離心,取上清置-70℃凍存待測。100 μl生理鹽水重懸管底細胞后,用血細胞計數板計數白細胞。再次離心沉渣瑞氏染色進行細胞分類。
1.6 組織病理學觀察[5]實驗結束時,麻醉后處死小鼠,取左肺于4%多聚甲醛溶液充分固定,常規脫水、透明、包埋,制作4 μm連續切片,蘇木精-伊紅(HE)染色后于顯微鏡下觀察并評分。肺炎嚴重程度評分:0=無;1=輕度;2=中度;3=重度;4=極重度,肺炎范圍評分:0=無;1=小范圍;2=較大范圍;3=廣泛,將嚴重程度評分與范圍評分相加來評價肺炎病理程度。
1.7 酶聯免疫吸附測定(Enzyme-linked immunosorbent assay,ELISA) 取出凍存的BALF、血清,采用ELISA雙抗體夾心法,按照試劑盒說明書進行操作,計算出標準曲線回歸方程后,將樣品光密度值帶入標準曲線,得出KC、IL-10的含量(pg/ml)。
1.8 免疫組化 采用二步法,一抗為兔抗小鼠TLR2多克隆抗體(ab24192),稀釋濃度為1∶1 000,按試劑盒說明進行操作。
1.9 統計學方法 采用SPSS 19.0統計軟件包進行統計分析,計量資料,如正態分布,以表示,兩組間均數比較采用t檢驗;多組間均數比較采用方差分析,組間兩兩比較,方差齊性應用LSD-t法,方差不齊采用Games-Howell法;非正態資料,采用秩和檢驗,計數資料采用χ2檢驗。P<0.05認為有顯著性差異。
2 結果
2.1 生存率及體重 正常對照組小鼠均存活,SA肺炎組和抗TLR2抗體組間生存率比較無顯著差異(同為P=1.0,圖1A)。體重比為小鼠滴鼻接種造模后每天體重與造模當天(即第0天)體重比值,SA肺炎組和抗TLR2抗體組(3 d或8 d亞組)小鼠滴鼻接種后體重較正常組低(各天P<0.05);比較SA肺炎組與抗TLR2抗體組小鼠間體重比,各天均無明顯統計學差異。見圖1B。
2.2 BALF載菌量 小鼠BALF分離培養,觀察菌落特點,并做革蘭染色和生化鑒定,分離出非金黃色葡萄球菌,疑為操作污染,不列入統計范圍。正常組、SA肺炎組及抗TLR2抗體組,第3天n分別為7、6、6,第 8 天 n 分別為 8、7、7。正常組小鼠未分離到SA,比較SA肺炎組與抗TLR2抗體組小鼠BALF載菌量,在感染后第3天,抗TLR2抗體組較SA肺炎組增高(P<0.05,圖2A);在感染后第8天,3組間差異無統計學意義。
2.3 BALF白細胞計數及中性粒細胞比值 第3天,SA肺炎組小鼠BALF中白細胞計數較正常組高(P<0.01),抗 TLR2抗體組較正常組高(P<0.01),但較SA肺炎組低(P<0.05,圖2B)。感染后第8天,抗TLR2抗體組分別和正常組、SA肺炎組比較,均無統計學差異(分別P=0.281和P=0.191,圖2B)。中性粒細胞比值,在感染后第3天,SA肺炎組(53.14±8.57)、抗 TLR2 抗體組(38.13±9.17)與正常組(12.50±3.66)比較差異有統計學意義(P<0.01),抗TLR2抗體組較SA肺炎組低(P<0.01),感染后第8天,BALF中性粒細胞百分值SA肺炎組(20.57±4.50)較正常組(13.80±3.52)高(P<0.05),見圖2C。
2.4 BALF中KC、IL-10水平 SA感染后第3天,SA肺炎組和抗TLR2抗體組小鼠BALF中KC濃度較正常組表達明顯升高(P<0.01和P<0.05),但抗TLR2抗體組明顯低于SA感染組(P<0.01)。SA肺炎組小鼠和抗TLR2抗體組小鼠BALF中IL-10濃度較正常組表達升高(P<0.01和P<0.01),但SA肺炎組小鼠和抗TLR2抗體組相比無統計學差異(P=0.389)。在SA感染后第8天,3組間 KC和IL-10在BALF中均無統計學差異,見表1。
2.5 血清中KC、IL-10水平 SA肺炎組和抗TLR2抗體組小鼠血清中KC濃度較正常組表達明顯升高(P<0.01和P<0.01),抗TLR2抗體組低于SA感染組(P<0.05)。SA肺炎組和抗TLR2抗體組小鼠血清中IL-10濃度較正常組表達升高(P<0.01和P<0.01),但SA肺炎組小鼠血清中IL-10和抗TLR2抗體組相比無統計學差異(P=0.479)。在SA感染后第8天,3組間KC和IL-10在BALF及血清中均無統計學差異,見表2。
2.6 組織病理學 正常組小鼠氣管、肺泡腔內無炎性分泌物及出血,肺泡結構完整(圖3A);在第3天,SA肺炎組小鼠肺部可見支氣管管腔充滿炎性滲出物,肺泡正常結構消失,肺泡腔可見以嗜中性粒細胞為主的炎性細胞浸潤(圖3B);抗TLR2抗體組小鼠支氣管管腔、肺泡腔可見出血及少量炎性細胞,肺泡壁充血增厚(圖3D、E)。SA肺炎組和抗TLR2抗體組小鼠第8天仍存在炎性病理改變(分別為圖3C、F),但明顯輕于第3天炎性改變。肺炎的病理評分為嚴重度評分+擴散范圍評分,在滴鼻接種后第3天和第8天,抗TLR2抗體組小鼠HE病理評分均低于SA肺炎組小鼠,差異有統計學意義(P=0.019和P=0.025)。
2.7 免疫組化 免疫組化染色示正常組小鼠TLR2陽性表達細胞主要是氣管、支氣管上皮細胞(圖4A),感染后第3天,SA肺炎組可見TLR2陽性表達的中性粒細胞、巨噬細胞等炎癥細胞出現在肺泡腔、支氣管腔以及肺間質,氣管、支氣管上皮細胞TLR2陽性表達(圖4B);抗TLR2抗體組可見肺間質少量陽性炎癥細胞浸潤,氣管、支氣管上皮陽性表達TLR2(圖4C)。感染后第8天,SA肺炎組肺泡腔、支氣管腔以及肺間質仍有TLR2陽性細胞(圖4D);抗TLR2抗體組肺泡腔、支氣管腔以及肺間質有少量TLR2陽性細胞(圖4E)。
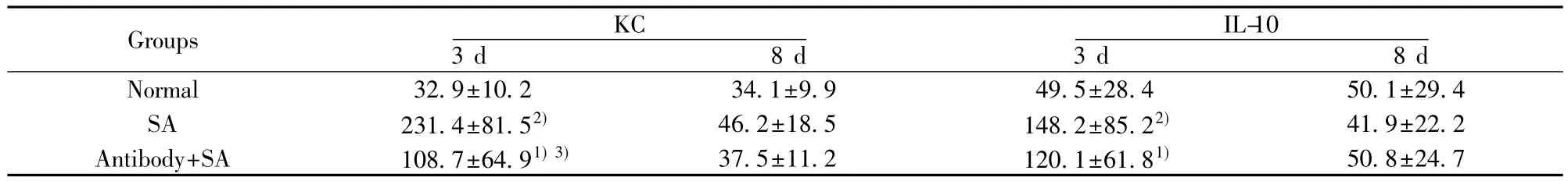
表1 抗TLR2抗體對SA肺炎小鼠BALF中KC、IL-10水平的影響Tab.1 Effects of anti-TLR2 antibody on expression KC and IL-10 of BALF in SA pneumonia mice
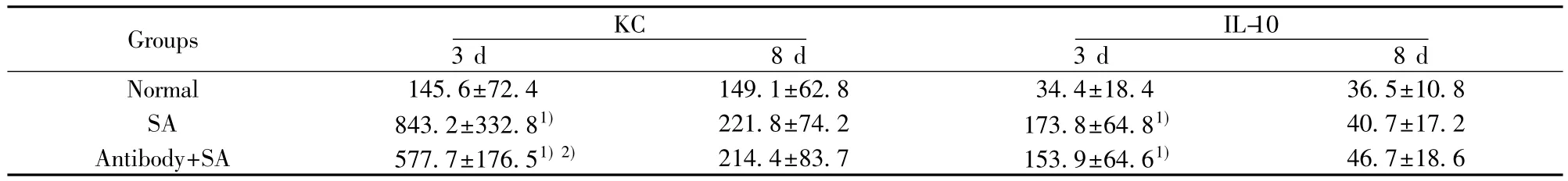
表2 抗TLR2抗體對SA肺炎小鼠血清中KC、IL-10水平的影響Tab.2 Effects of anti-TLR2 antibody on expression KC and IL-10 of serum in SA pneumonia mice
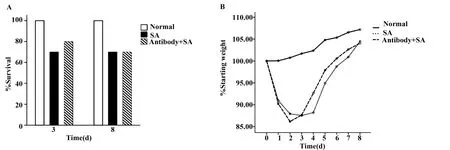
圖1 抗TLR2抗體對SA肺炎小鼠生存率及體重比的影響Fig.1 Effects of anti-TLR2 antibody on survival rate and weight ratio in SA pneumonia mice
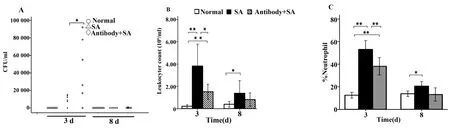
圖2 抗TLR2抗體對SA肺炎小鼠肺泡灌洗液CFU計數、白細胞計數及中性粒細胞百分值的影響Fig.2 Effects of anti-TLR2 antibody on bronchoalveolar lavage fluid CFU count,leukocytes count and neutrophil percentage in SA pneumonia mice
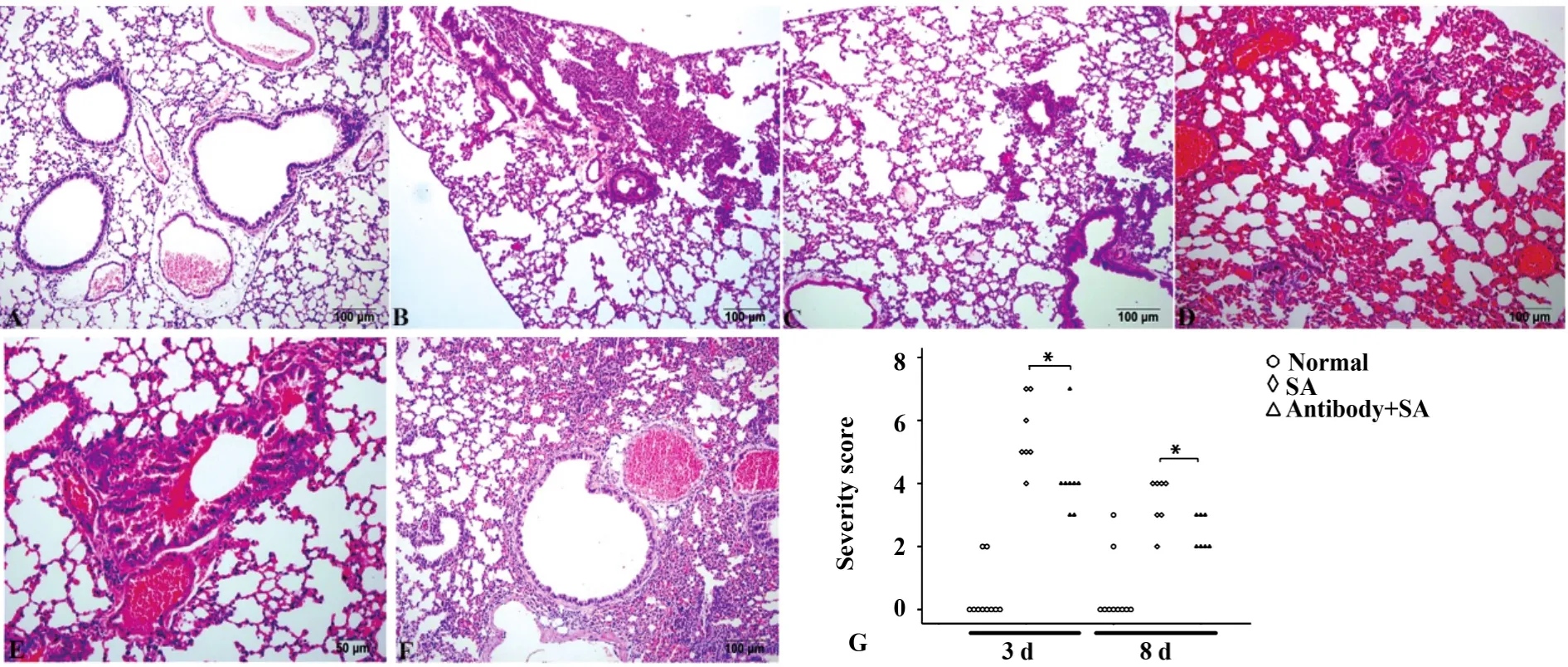
圖3 抗TLR2抗體對SA肺炎小鼠肺組織炎癥反應及病理評分的影響(HE染色)Fig.3 Effects of anti-TLR2 antibody on pulmonary inflammation response and pathological scores in SA pneumonia mice(HE staining)

圖4 各組小鼠肺組織TLR2免疫組化染色結果Fig.4 Expression of TLR2 in pulmonary of SA pneumonia mice,analyzed by immunohistochemical staining
3 討論
SA能產生多種胞壁成分、毒素及侵襲性酶,包括肽聚糖、脂蛋白、溶血素、凝固酶等,肺部感染時常引起強烈的炎癥反應,可致肺組織損傷,甚至出現肺膿腫及膿胸[6]。急性炎性反應表現為血管內白細胞透過血管壁進入感染部位以消滅病原體,同時釋放大量炎癥因子,過強炎性反應可造成周圍組織損傷[7]。中性粒細胞是抵抗化膿性細菌入侵的重要免疫細胞,分泌彈性蛋白酶和活性氧是組織炎性損傷的重要因素[8]。因此,適當減少中性粒細胞浸潤,可減輕炎癥反應損傷,加快機體恢復。TLR2和TLR1或TLR6形成異二聚體,可識別SA的重要抗原成分脂磷壁酸和脂蛋白,激活下游的NF-κB和MAPK信號通路,啟動炎癥反應[9]。TLR2主要表達于單核吞噬細胞、中性粒細胞及上皮細胞等。本實驗通過免疫組化證實:TLR2在中性粒細胞、氣管及支氣管上皮細胞高表達。Zivkovic等[5]通過滴鼻接種SA外毒素,發現野生型C57BL/6小鼠肺部有中性粒細胞浸潤,細胞因子如 IL-1β、TNF-α及 KC等升高,而TLR2基因敲除小鼠(TLR2-/-)無上述炎癥反應表現,說明TLR2可能在介導SA炎癥反應方面起著重要作用。SA結構成分激活氣管、支氣管上皮細胞TLR2信號通路,招募中性粒細胞涌入肺組織,并激活中性粒細胞上的TLR2信號通路,啟動炎癥因子的級聯效應及炎性風暴。
抗體作為藥物具有特異性強、持續性久和療效顯著等特點,在抗腫瘤、器官移植、自身免疫性疾病及感染性疾病治療中發揮重要作用[10,11],具有廣闊應用前景。本研究采用抗TLR2抗體結合呼吸道上皮細胞及中性粒細胞等細胞膜上的TLR2,阻止其與SA的多種PAMP結合,從而抑制炎癥反應和減輕炎性損傷。本實驗觀察到,在滴鼻接種3 d后,抗TLR2抗體組小鼠較SA肺炎組BALF及血清中的炎性因子KC明顯降低,但對抑制性炎性因子IL-10表達無顯著影響,同時肺部HE病理評分明顯降低,但死亡率無明顯統計學差異,提示抗TLR2抗體不能降低SA肺炎小鼠死亡率,但可明顯減輕肺部的炎性反應。Meng等報道[2],抗TLR2抗體能阻止配體與細胞TLR2結合,腹腔注射抗TLR2抗體能提高枯草桿菌敗血癥小鼠生存率并抑制TNF-α、KC及IL-6等炎性反應。有研究報道,抗TLR2抗體能阻斷博來霉素導致的肺部炎癥反應及纖維化,也說明其在抑制肺部炎癥反應方面有著重要作用[12]。
本實驗發現,在滴鼻接種3 d后,抗TLR2抗體組小鼠較SA肺炎組BALF載菌量高,存活率及體重恢復情況無明顯差異,可能與肺部招募免疫細胞較少、SA清除減慢有關,HE病理改變以肺間隔水腫、出血,支氣管腔出血為主要表現,考慮與SA分泌溶血素、苯酚可溶解的調控蛋白(Phenol-soluble modulins,PSMs)及葡萄球菌蛋白 A等有關。Robertson等[13]報道:抗中性粒細胞單克隆抗體耗盡小鼠中性粒細胞,在SA肺部感染后,小鼠SA清除能力和生存率明顯降低,說明中性粒細胞在SA肺部清除中起著重要作用。α-溶血素和PSMs是SA重要致病毒素,具有細胞毒性及溶血活性,攻擊肺組織上皮、血管壁細胞及中性粒細胞等,可致肺部水腫及出血[3,14]。在滴鼻接種 8 d后,抗 TLR2 抗體組和 SA肺炎組小鼠BALF載菌量與正常對照組比較無統計學差異,提示肺炎小鼠肺部細菌基本被清除。抗TLR2抗體組和SA肺炎組小鼠BALF白細胞計數及中性粒細胞比值、血清細胞因子KC及IL-10與正常對照組比較,均無統計學差異,抗TLR2抗體組小鼠HE病理評分低于SA肺炎組小鼠,但兩組均高于正常組,提示肺炎小鼠肺部炎癥較前好轉,抗TLR2抗體組肺部炎癥病理改變較 SA肺炎組輕,可能與TLR2信號通路受阻斷后,肺部炎癥浸潤減少有關。
綜上所述,抗TLR2抗體可阻止SA與TLR2結合,抑制小鼠SA肺炎炎癥介質釋放,減少炎癥細胞浸潤,減輕肺部炎癥反應。本研究為抗TLR2抗體在抑制SA肺炎炎癥反應方面的作用提供理論依據。
[1]Fournier B.The function of TLR2 during staphylococcal diseases[J].FrontCellInfectMicrobiol,2012,doi:10.3389/fcimb.2012.00167.eCollection 2012.
[2]Meng G,Rutz M,Schiemann M,et al.Antagonistic antibody prevents toll-like receptor 2-driven lethal shock-like syndromes[J].J Clin Invest,2004,113(10):1473-1481.
[3]Bubeck Wardenburg J,Patel RJ,Schneewind O.Surface proteins and exotoxins are required for the pathogenesis of staphylococcus aureus pneumonia[J].Infect Immun,2007,75(2):1040-1044.
[4]Yang HZ,Cui B,Liu HZ,et al.Targeting TLR2 attenuates pulmonary inflammation and fibrosis by reversion of suppressive immune microenvironment[J].J Immunol,2009,182(1):692-702.
[5]Zivkovic A,Sharif O,Stich K,et al.TLR2 and CD14 mediate innate immunity and lung inflammation to staphylococcal Panton-Valentine leukocidin in vivo[J].J Immunol,2011,186(3):1608-1617.
[6]Carrillo-Marquez MA,Hulten KG,Hammerman W,et al.Staphylo coccus aureus pneumonia in children in the era of communityacquired methicillin-resistance at Texas Children's Hospital[J].Pediatr Infect Dis J,2011,30(7):545-550.
[7]Si-Tahar M,Touqui L,Chignard M.Innate immunity and inflammation--two facets of the same anti-infectious reaction[J].Clin Exp Immunol,2009,156(2):194-198.
[8]Smith JA.Neutrophils,host defense,and inflammation:A doubleedged sword[J].J Leukoc Biol,1994,56(6):672-686.
[9]Pietrocola G,Arciola CR,Rindi S,et al.Toll-like receptors(TL Rs)in innate immune defense against Staphylococcus aureus[J].Int J Artif Organs,2011,34(9):799-810.
[10]Adler MJ,Dimitrov DS.Therapeutic antibodies against cancer[J].Hematol Oncol Clin North Am,2012,26(3):447-481.
[11]Wesolowski J,Alzogaray V,Reyelt J,et al.Single domain antibod ies:Promising experimental and therapeutic tools in infection and immunity[J].Med Microbiol Immunol,2009,198(3):157-174.
[12]Yang HZ,Cui B,Liu HZ,et al.Targeting TLR2 attenuates pulmonary inflammation and fibrosis by reversion of suppressive immune microenvironment[J].J Immunol,2009,182(1):692-702.
[13]Robertson CM,Perrone EE,McConnell KW,et al.Neutrophil depletion causes a fatal defect in murine pulmonary Staphylococcus aureus clearance[J].J Surg Res,2008,150(2):278-285.
[14]Hongo I,Baba T,Oishi K,et al.Phenol-soluble modulin alpha 3 enhances the human neutrophil lysis mediated by Panton-Valentine leukocidin[J].J Infect Dis,2009,200(5):715-723.

