肝細胞肝癌中SALL4蛋白表達及其臨床病理意義
馬從乾 王 雅 趙 星 楊 軻 (南陽市中心醫院血管外科,河南 南陽 473000)
肝細胞癌(HCC)是世界最常見的惡性腫瘤之一,近年來手術切除治療HCC的效果并沒有取得明顯進展,易發生肝內外轉移,預后較差,HCC發生、發展的分子生物學機制仍有待進一步研究〔1〕。婆羅雙樹樣基因4(SALL4)是一種新發現的原癌基因,具有C2H2鋅指結構的蛋白轉錄因子,在維持胚胎干細胞功能方面起著重要作用。SALL4基因突變常常導致畸形或腫瘤的發生,其在急性髓系白血病、生殖細胞腫瘤、骨髓增生異常綜合征和肝樣胃癌中表達增高。本實驗通過蛋白免疫印跡方法檢測SALL4蛋白在HCC中的表達情況,并分析其臨床意義。
1 材料和方法
1.1 臨床資料 收集2010年1月至2013年1月我院普外科手術切除的肝癌30例,病理檢測確定為HCC,并取相應的癌旁組織30例作為對照。其中男25例,女5例;年齡28~65〔平均(56.5±8.9)〕歲。有乙肝25例,無乙肝5例。按照肝癌的臨床病理分級(Sugihala分級)高分化癌12例,中分化癌8例,低分化癌10例。腫瘤直徑≤5 cm 19例,>5 cm 11例。甲胎蛋白(AFP)≤400 μg/L 12 例,>400 μg/L 18 例。腫瘤有包膜14 例,無包膜16例。門靜脈有癌栓8例,無癌栓22例。
1.2 主要試劑 一抗兔抗人甘油醛-3-磷酸脫氫酶(SALL4)多克隆抗體(Santa Cruz),一抗兔抗人GAPDH多克隆抗體(康為世紀),二抗山羊抗兔IgG標記辣根過氧化物酶(HRP)購于康為世紀公司,SuperSignal West Pico化學發光底物(Thermo Scientific),RIPA裂解液購于康為世紀,二喹啉甲酸(BCA)蛋白濃度測定試劑盒購于碧云天公司。
1.3 蛋白免疫印跡 取組織100 mg,按照RIPA裂解液說明書進行操作,提取組織蛋白;使用BCA蛋白濃度測定試劑盒測定新提取的蛋白濃度;加入十二烷基硫酸鈉(SDS)上樣緩沖液,煮沸5 min;制備10%的SDS-聚丙烯酰胺分離膠,每個泳道加入20 μg蛋白,進行電泳、轉膜,5%脫脂奶粉封閉聚偏氟乙烯(PVDF)膜,加入一抗兔抗人SALL4多克隆抗體(1∶1 000)和一抗兔抗人GAPDH多克隆抗體(1∶5 000)4℃過夜,Tris鹽酸緩沖液(TBST)洗膜,加入二抗山羊抗兔IgG(1∶5 000)室溫孵育1 h,TBST洗膜,最后加入發光液孵育5 min,進暗室膠片曝光。
1.4 統計學分析 應用SPSS10.0軟件。樣本率的比較采用χ2檢驗及配對四格表的χ2檢驗,蛋白表達采用非參數檢驗。
2 結果
2.1 肝癌中SALL4蛋白表達水平 90%的肝癌組織中SALL4蛋白表達水平顯著高于癌旁組織。見圖1。
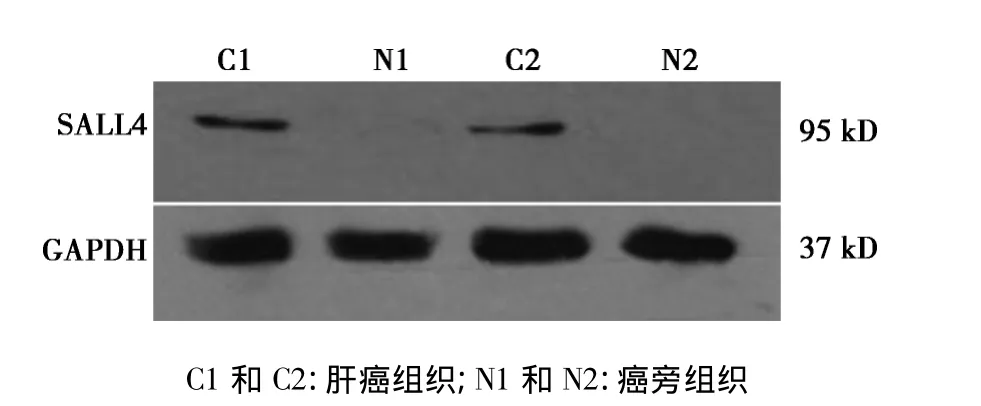
圖1 蛋白免疫印跡檢測SALL4在肝癌組織和癌旁組織中的蛋白表達
2.2 肝癌中SALL4蛋白表達水平與臨床病理特征的關系 肝癌組織中SALL4蛋白表達水平與性別、年齡、腫瘤大小、乙肝、病理分級、腫瘤包膜和門脈癌栓差異均無顯著性,而與AFP有關。見表1。
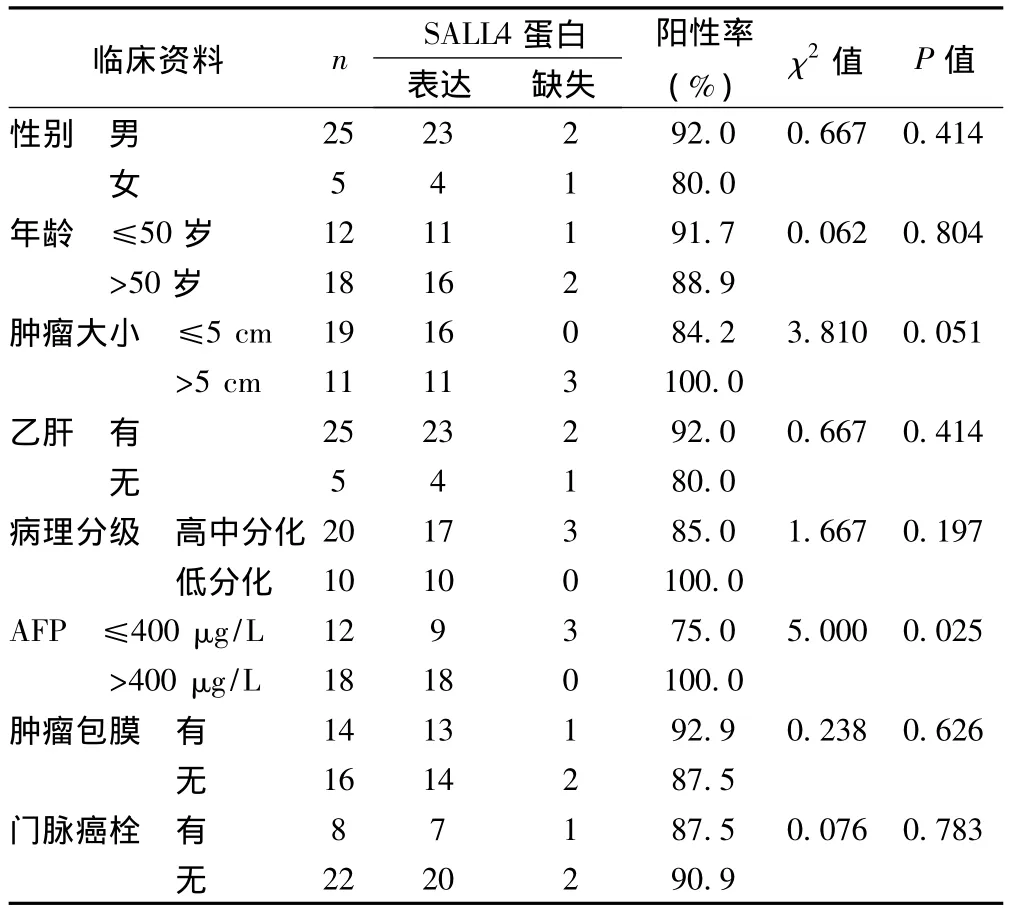
表1 肝癌中SALL4蛋白表達水平與臨床病理特征的關系
3 討論
SALL基因是果蠅Spalt的同源異型基因具有高度保守性,目前包括SALL1、SALL2、SALL3和SALL4,屬于C2H2型鋅指轉錄因子〔2〕。SALL4是一種新發現的原癌基因。研究〔3〕發現LEF1和TCF4F能有效激活SALL4轉錄,從而激活經典的Wnt信號轉導通路,e-myc、細胞周期蛋白D1(Cyclin D1)、基質金屬蛋白酶7(MMP-7)為Wnt信號的靶基因在腫瘤發生、發展過程中起重要的作用,提示SALL4基因具有導致腫瘤發生的潛能。同時SALL4具有維持干細胞特性的作用和致瘤的潛能。在白血病的研究中證實,SALL4至少通過與組蛋白脫乙酰酶(HDAC)的反應,來抑制PTEN,從而促進白血病的進展;通過活性肽來競爭SALL4與HDAC的反應,能解除SALL4對PTEN的抑制,導致SALL4高表達惡性腫瘤細胞的死亡;體內外實驗均證實這種活性肽具有抗白血病的作用〔4〕。因此,以SALL4為靶點治療腫瘤具有很好的前景。
在乳腺癌中,86.1%(31/36)的腫瘤組織中SALL4 mRNA高表達,但與臨床病理特征沒有明顯相關,盡管如此在乳腺癌進展的早期階段SALL4 mRNA表達較高;體外實驗中,siRNA干擾SALL4表達,可抑制乳腺癌細胞系(MCF7)細胞的增殖,導致細胞周期停止在G1期〔5〕。在肺癌中,93%的腫瘤組織中SALL4 mRNA高表達,跟乳腺癌中的作用相似〔6〕。在胃癌中,SALL4表達增高,同時跟淋巴結轉移相關;增高SALL4表達,可增強人胃癌細胞的增殖和遷移;siRNA敲低SALL4,可降低人胃癌細胞的增殖和遷移能力;SALL4過表達可誘導胃癌細胞的上皮間充質轉換;SALL4可通過誘導Bmi-1和Lin28B,促使胃癌細胞獲得干性〔7〕。SALL4基因可被檢測,并且具有高敏感性和特異性,所以對于惡性腫瘤的診斷、評價預后和治療中有很大的價值。
SALL4是胚胎干細胞維持多能性和自我更新的關鍵因子。在鼠類的肝臟中,SALL4的表達隨著長大而逐漸減低,成年后就沉默了;這提示SALL4促進胎兒期肝臟從早期發育到中期的重要作用〔8〕。HCC類祖細胞亞型通常認為有較差的預后。本文發現SALL4的蛋白表達在HCC中增高〔9〕。推測肝細胞中SALL4的重新表達是正常肝細胞向癌細胞轉變的標志,或肝癌干細胞的SALL4表達促進HCC形成。
雖然SALL4是最新研究發現的致癌基因,但對于其功能和引起肝細胞癌發生機制的研究目前還處于起步階段,仍需要進行更多的實驗以證實。SALL4在HCC干細胞上的異常表達提示與HCC的發生密切相關,深入地研究SALL4基因功能將有助于闡明HCC的發病機制,進而為今后更準確地診斷和靶向治療HCC提供一條新的途徑。
1 Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008〔J〕.Int J Cancer,2010;127(12):2893-917.
2 Zhang J,Tam WL,Tong GQ,et al.SALL4 modulates embryonic stem cell pluripotency and early embryonic development by the transcriptional regulation of Pou5f1〔J〕.Nat Cell Biol,2006;8(10):1114-23.
3 Bohm J,Sustmann C,Wilhelm C,et al.SALL4 is directly activated by TCF/LEF in the canonical Wnt signaling pathway〔J〕.Biochem Biophys Res Commun,2006;348(3):898-907.
4 Gao C,Dimitrov T,Yong KJ,et al.Targeting transcription factor SALL4 in acute myeloid leukemia by interrupting its interaction with an epigenetic complex〔J〕.Blood,2013;121(8):1413-21.
5 Kobayashi D,Kuribayshi K,Tanaka M,et al.SALL4 is essential for cancer cell proliferation and is overexpressed at early clinical stages in breast cancer〔J〕.Int J Oncol,2011;38(4):933-9.
6 Kobayashi D,Kuribayashi K,Tanaka M,et al.Overexpression of SALL4 in lung cancer and its importance in cell proliferation〔J〕.Oncol Rep,2011;26(4):965-70.
7 Zhang L,Xu Z,Xu X,et al.SALL4,a novel marker for human gastric carcinogenesis and metastasis〔J〕.Oncogene,2013;4:95.
8 Oikawa T,Kamiya A,Kakinuma S,et al.SALL4 regulates cell fate decision in fetal hepatic stem/progenitor cells〔J〕.Gastroenterology,2009;136(3):1000-11.
9 Lee JS,Heo J,Libbrecht L,et al.A novel prognostic subtype of human hepatocellular carcinoma derived from hepatic progenitor cells〔J〕.Nat Med,2006;12(4):410-6.

