紅細胞冷凝集對血細胞分析檢驗的影響及處理方法
孫建偉
遼寧省撫順礦務局總醫院檢驗科,遼寧撫順 113008
血細胞分析儀是臨床實驗室檢查常用的檢驗儀器之一,血細胞分析結果的質量直接關系到對病人的診斷和分析,但在血常規的日常檢測中經常會遇到很多影響因素,例如:血小板假性減少癥,紅細胞凝集(冷凝集),脂血/溶血,有核紅細胞,白細胞增多,瘧疾,采樣、抗凝不當等。因此,在血常規的檢測過程中做好質量控制是至關重要的。在血細胞分析中我們發現有些患者的紅細胞極容易發生凝集,使RBC、 HCT 假性降低,MCV、MCH、MCHC 假性升高。造成血常規的檢驗結果不正常,對臨床做出錯誤的引導。為了及時發現和準確排除紅細胞冷凝集對血細胞分析儀的影響,該實驗選擇了從2013年1月—2014年5月共20例紅細胞冷凝集的標本在3 種不同條件下檢測: ①普通室溫(20℃);②37 ℃水浴30 min 后立即檢測;③25 ℃條件下37 ℃水浴30 min 后立即檢測,現報道如下。
1 資料與方法
1.1 一般資料
1.1.1 儀器與試劑日本Sysmex 公司生產的XE-5000 全自動血液分析儀及配套原裝試劑、日本奧林巴斯光學株式會社生產的雙筒顯微鏡。原廠配套正常濃度和高濃度質控品。
1.1.2 標本 從2013年1月—2014年5月撫順礦務局醫院住院患者血常規標本中,通過鏡檢篩選出20例紅細胞冷凝集標本。所有標本均按常規全血細胞檢測,血細胞分析儀每半年校準一次。每日測定正常濃度和高濃度2 個濃度的質控品,結果均在控。標本通過靜脈采血2 mL,加入EDTA-K2 抗凝的真空管內,輕輕地顛倒混勻。于采集后4 h 內,在XE-5000 全自動血液分析儀檢測完畢。其中男性12 人,女性8 人。其中包括肺炎支原體10例,傳染性單核細胞增多癥3例,多發性骨髓瘤2例,肺癌1例,白血病2例,惡性淋巴瘤2例。
1.2 方法
將20例紅細胞冷凝集的標本采用不同的方法處理后,在日本Sysmex 公司生產的XE-5000 全自動血液分析儀檢測。血液分析儀所使用的試劑為原廠配套。顯微鏡為日本奧林巴斯光學株式會社生產。瑞士吉姆薩染液由貝索生物技術公司提供。①普通室溫(20 ℃); ②37 ℃水浴30 min; ③25 ℃條件下,37 ℃水浴30 min。記錄3 種不同條件下紅細胞﹑紅細胞壓積、血紅蛋白﹑紅細胞各項參數﹑白細胞﹑血小板的值。該儀器以半導體激光器流式細胞技術結合熒光染色技術檢測白細胞,電阻抗法測定紅細胞和血小板,比色法測定血紅蛋白。以上3 種方法檢測的同時觀察管壁紅細胞聚集的情況,檢測各推兩張血涂片,瑞士吉姆薩染色,雙筒顯微鏡鏡檢。
1.3 統計方法
使用SPSS17.0 軟件對數據進行處理分析,計量資料以均數±標準差(±s)表示,采用t 檢驗。
2 結果
紅細胞冷凝集的標本在3 種不同的環境下檢測時可發現:普通室溫時,紅細胞、白細胞、血小板均有異常報警(Agglut 和Turb/Hb)。紅細胞直方圖可見異常的大紅細胞峰。管壁上有細砂粒樣凝集顆粒;血涂片發現血膜上有許多細小顆粒,顯微鏡下可見紅細胞大量聚集在一起。
37 ℃水浴30 min 后,15例標本未發現抗凝管管壁有凝集顆粒,試管壁上的小片狀凝塊消失,紅細胞分布圖形正常,無報警信息。鏡檢血涂片,可見紅細胞均勻分布。其余5例標本仍然提示紅細胞、白細胞、血小板有異常報警(Agglut 和Turb/Hb),紅細胞直方圖異常。
表1 普通室溫(20 ℃)和37 ℃水浴30 min 后及25 ℃條件下,37 ℃水浴30 min 20例測定結果(±s)
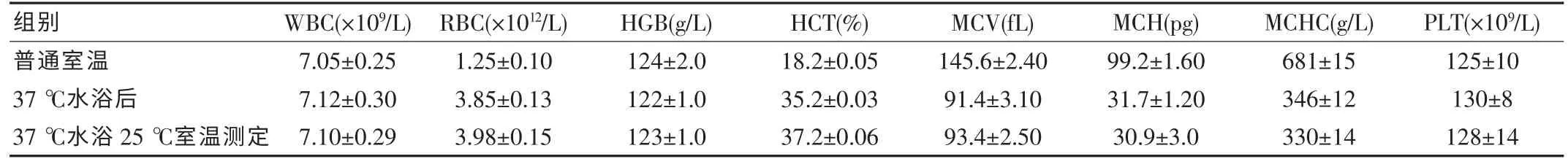
表1 普通室溫(20 ℃)和37 ℃水浴30 min 后及25 ℃條件下,37 ℃水浴30 min 20例測定結果(±s)
普通室溫37 ℃水浴后37 ℃水浴25 ℃室溫測定組別7.05±0.25 7.12±0.30 7.10±0.29 WBC(×109/L)1.25±0.10 3.85±0.13 3.98±0.15 RBC(×1012/L)124±2.0 122±1.0 123±1.0 HGB(g/L)18.2±0.05 35.2±0.03 37.2±0.06 HCT(%)145.6±2.40 91.4±3.10 93.4±2.50 MCV(fL)99.2±1.60 31.7±1.20 30.9±3.0 MCH(pg)681±15 346±12 330±14 125±10 130±8 128±14 MCHC(g/L) PLT(×109/L)
室溫25 ℃時,標本37 ℃水浴30 min 后,20例標本均未出現報警信息。管壁無凝集顆粒,鏡檢血涂片,可見紅細胞均勻分布。
從表1 可以看出,①普通室溫(20 ℃)和37 ℃水浴30 min 的結果比較,WBC、HGB、PLT 差異無統計學意義(P>0.05)。而紅細胞、紅細胞壓積(HCT)、平均紅細胞體積(MCV)、平均紅細胞血紅蛋白含量(MCH)、平均紅細胞血紅蛋白濃度(MCHC)的差異有統計學意義(P<0.05);②37℃水浴30 min 和25 ℃條件下37 ℃水浴30 min 的結果比較,WBC、HGB、PLT 差異無統計學意義 (P>0.05)。而紅細胞、紅細胞壓積(HCT)、平均紅細胞體積(MCV)、平均紅細胞血紅蛋白含量(MCH)、平均紅細胞血紅蛋白濃度(MCHC)的差異有統計學意義(P<0.05)。
3 討論
冷凝集素是冷反應型抗紅細胞抗體,在受冷后可使紅細胞出現聚集[1]。在0~4 ℃時最易和紅細胞膜抗原結合,是較強的使紅細胞凝集的一種自身免疫性抗體, 可存在于正常人的血清中,抗體多數是IgM 型。低效價的冷凝集素一般無臨床意義,通常16 ℃以下可使紅細胞發生凝集,30 ℃以上不發生凝集[2]。這種自身凝集反應是可逆的,當環境溫度升高后,凝集的紅細胞可自行解聚[3]。正常人血液中都有一定量的冷凝素抗體,但滴度較低,在1∶16 以下。正常情況下,不會導致不良反應。但當機體處于感染等病理情況時,機體的冷凝素的含量增加,可以引起凝集反應[4]。很多疾病如多發性骨髓瘤、巨球蛋白血癥、淋巴系統增殖性疾病、自身免疫性疾病、某些病毒和支原體感染、癌癥、白血病、妊娠等都可以出現冷凝集反應[5]。
該實驗中,20例標本在普通室溫 (20 ℃),37 ℃水浴30 min和25 ℃條件下37 ℃水浴30 min 3 種條件測定時,WBC﹑PLT﹑HGB 的計數結果差異無統計意義(P>0.05)。在研究中發現,當標本出現冷凝集時,數個紅細胞凝集在一起,血細胞分析儀只對體積相當的紅細胞或小紅細胞進行了分析,而大紅細胞團塊完全被忽略,這就導致了不合邏輯的紅細胞計數降低和高MCV。而HGB 是紅細胞溶解后采用比色方法測定,故冷凝集對HGB 無影響。對于由RBC、HGB、HCT 計算的參數MCV、MCH、MCHC 則造成假性偏高。很多文獻[6-7]報道了標本發生冷凝集時的處理方法,如經37 ℃水浴不同時間后立即進行檢測,進行血漿置換,重新采血后立即測定。37 ℃水浴后在不同的儀器上檢測。對試劑和樣本進行雙重加溫,這些方法使冷凝集的標本得到了很好地處理。在本實驗中,37 ℃水浴30 min 糾正了15例冷凝集標本,但仍存在5例標本出現冷凝集現象。而在水浴的同時提高室內溫度到25 ℃,對于5例冷凝集素效價高﹑紅細胞聚集程度強的標本得到了很好地處理。從表中可以看出,20例標本在37 ℃水浴30 min和25 ℃條件下37 ℃水浴30 min 兩種條件檢測時,紅細胞、紅細胞壓積(HCT)、平均紅細胞體積(MCV)、平均紅細胞血紅蛋白含量(MCH)、平均紅細胞血紅蛋白濃度(MCHC)的差異有統計學意義(P<0.05)。這與石恩榮在冷凝集對血液分析儀檢測結果的影響的報道是一致的。在該實驗中WBC、HGB、PLT 差異無統計學意義(P>0.05)。由于XE-5000 是以半導體激光器流式細胞技術結合熒光染色技術檢測白細胞,故對WBC 沒有影響。冷凝集對PLT的影響報道并不一致,該實驗顯示PLT 計數未受影響。在冷凝集的標本檢測中,重新采血不但增加了患者的壓力,而且病房標本立即檢測很難做到。進行血漿置換可造成血小板和白細胞的丟失,置換次數越多丟失現象越嚴重。這可能與吸棄血漿時WBC﹑PLT 被一起吸掉有關。在該實驗中,水浴的同時升高溫度避免了讓患者重新采血的壓力,避免了血漿置換WBC﹑PLT 的丟失,且操作簡單,對冷凝集的處理效果較好。一般的實驗室很容易做到。
綜上所述當遇到疑似冷凝集標本,如RBC,HGB 比例嚴重不符時(正常人HGB 和RBC 的比例為30∶1),首先觀察試管內標本狀態,仔細觀察紅細胞分布的直方圖和出現的報警信息,同時檢測冷凝素的效價。當標本確定為冷凝集后,37 ℃水浴30 min 后,可以利用空調提高室內的溫度到25 ℃以上,此方法可以消除冷凝集素的影響。在日常工作中,尤其是冬天溫度較低的時候,經常會遇到標本發生冷凝集情況。正確識別和處理冷凝集標本的異常檢測結果,對臨床準確評估患者的病情非常重要。可避免發出錯誤的檢驗報告,影響臨床檢驗治療
[1]程魯京,薛華月,王卉.寒冷凝集素對血細胞分析干擾的排除[J].武警醫學院學報,2000,9(4):280.
[2]陳忠,張莉尼.7例抗IgM 國內文獻綜合分析[J].臨床檢驗雜志,2002,20(2):93.
[3]林軍,單衛民,趙勝.冷凝集素綜合征引起配血困難一例分析[J].臨床檢驗雜志,2000,18(2):112.
[4]齊順貞,楊宗城,何保斌,等.吸入一氧化氮對犬煙霧吸入性損傷血液流變學的影響[J].現代診斷與治療,2006,9(3):148.
[5]叢玉隆,王淑娟.今日臨床檢驗學[M].北京:中國科學技術出版社,1997:40-41.
[6]徐健,周到銀,俞靖龍,等.冷凝集對血常規檢測的影響及處理方案探討[J].現代檢驗醫學雜志,2011,26(6):105-108.
[7]楊宏霞,江政松,焦連亭.一例紅細胞冷凝集在2 臺血液分析儀上檢驗結果的分析[J].檢驗醫學,2012,27(1):75-76.

