氧化釔對磷酸根的吸附及機理研究
孔祥武,姜恒,宮紅
(遼寧石油化工大學 化學化工與環境學部,遼寧 撫順 113001)
工業生產過程中排放出的廢水、殘渣中常含有一定量的磷,磷是造成水體富營養化的主要元素之一[1]。由于在某些水體中即使含有低濃度的磷也將誘發水華,如何有效地將磷濃度控制在極低水平已是待解決的技術難題[2]。
大量研究表明,稀土氧化物和稀土鹽類具有良好的吸附能力。近年來以稀土元素為主要吸附成分的新型吸附劑的研究成為國內外研究的熱點之一[3-7]。氧化釔價格低廉,用途廣泛,Li Yongxiu等[8]研究表明,氧化釔超細顆粒焙燒后具有大的比表面積和多孔結構,因此將氧化釔應用在廢水除磷中切實可行。王芳芳等[9]用殼聚糖/氧化釔復合材料對Cr(Ⅵ)的吸附研究表明,對Cr(Ⅵ)的去除達到了很好的效果。本實驗采用800 ℃焙燒后的氧化釔作為吸附劑,研究對磷酸鹽的吸附效果及吸附機理。
1 實驗部分
1.1 試劑與儀器
氧化釔(Y2O3,800 ℃焙燒3 h);磷酸二氫鉀、抗壞血酸、四水合鉬酸銨、氫氧化鈉、濃硫酸、鹽酸均為分析純;半水酒石酸銻鉀,化學純。
Spectrum GX 傅里葉變換紅外光譜儀;722S 型分光光度計;D/max-RB 型X 射線衍射儀;4-10 型馬弗爐;FA2104 型電子天平;JJ-1 型精密增力電動攪拌器;80-2 型臺式離心機;DF-101S 集熱式恒溫加熱磁力攪拌器。
1.2 實驗方法
1.2.1 靜態吸附將200 mL 磷酸二氫鉀溶液倒入錐形瓶中,用NaOH (6 mol/L)和HCl (1∶1)調節pH 值。加入Y2O3,在恒溫條件下均勻攪拌。每隔一段時間取樣,離心,吸取上清液于50 mL 容量瓶中,然后加入2 mL 鉬酸銨和1 mL 抗壞血酸,定容,搖勻,靜止反應10 min 后測其吸光度,根據標準曲線計算出磷酸根的濃度。計算吸附率和吸附量。
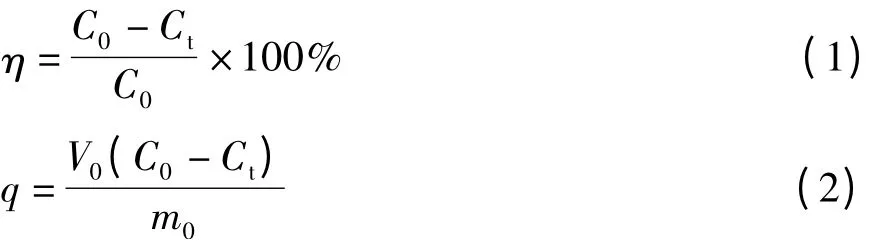
式中 η——吸附率,%;
C0——溶液中磷酸根的初始濃度,mg/L;
Ct——吸附后溶液中磷酸根的剩余濃度,mg/L;
V0——待吸附溶液的體積,mL;
m0——吸附劑的質量,mg。
1.2.2 動態吸附稱取一定體積的Y2O3裝入夾套吸附柱中(1 cm×30 cm)作為固定相,將KH2PO4以一定的流速流過固定相,接取流出液,當流出液的磷酸鹽濃度為10 mg/L(Ct/C0=0.1)為穿透,當流出液的磷酸鹽濃度為90 mg/L(Ct/C0=0.9)為飽和,流出液每10 mL 為一份,測定每份流出液磷酸根的濃度。按Thomas 動態吸附模型[10]計算動態吸附的飽和吸附量和速率常數。
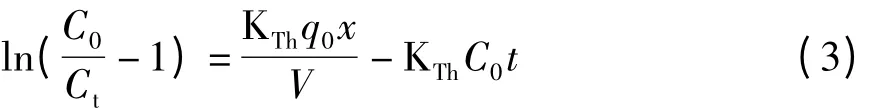
式中 KTh——Thomas 速率常數,mL/(mg·h);
q0——吸附平衡時單位質量的Y2O3吸附磷酸鹽的質量,mg/g;
x——吸附柱中吸附劑的質量,g;
V——流速,mL/h;
t——時間,h;
Ct,C0——t 時刻流出液的質量濃度和原溶液的質量濃度,mg/L。
2 結果與討論
2.1 不同稀土氧化物靜態吸附磷酸鹽效果
在溫度為35 ℃,pH = 2,初始濃度C0=100 mg/L 的200 mL 磷酸鹽溶液,吸附時間為90 min,稀土氧化物的投加量為0.1 g 的條件下,用一系列稀土氧化物對磷酸鹽進行吸附,結果見表1。
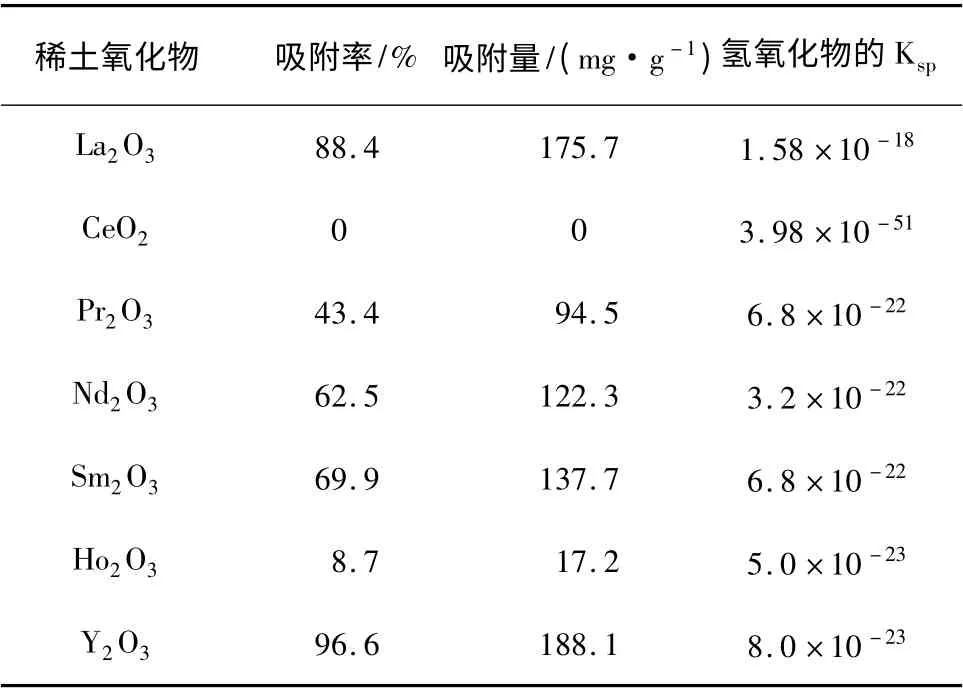
表1 不同稀土氧化物吸附磷酸根效果Table 1 Effects of different rare earth on phosphate adsorption
由表1 可知,氧化釔的吸附效果最好。其中氧化鑭在水溶液中不穩定,生成了氫氧化鑭,主要通過氫氧化鑭對磷酸鹽進行吸附[11]。氧化釔在水溶液中不生成氫氧化釔。
2.2 靜態吸附中pH 值對吸附量的影響
向初始濃度100 mg/L 的200 mL 磷酸鹽溶液中加入0.1 g Y2O3,溫度為35 ℃,700 r/min 下恒溫攪拌吸附2 h。圖1 為pH 值對Y2O3吸附磷酸鹽的影響。
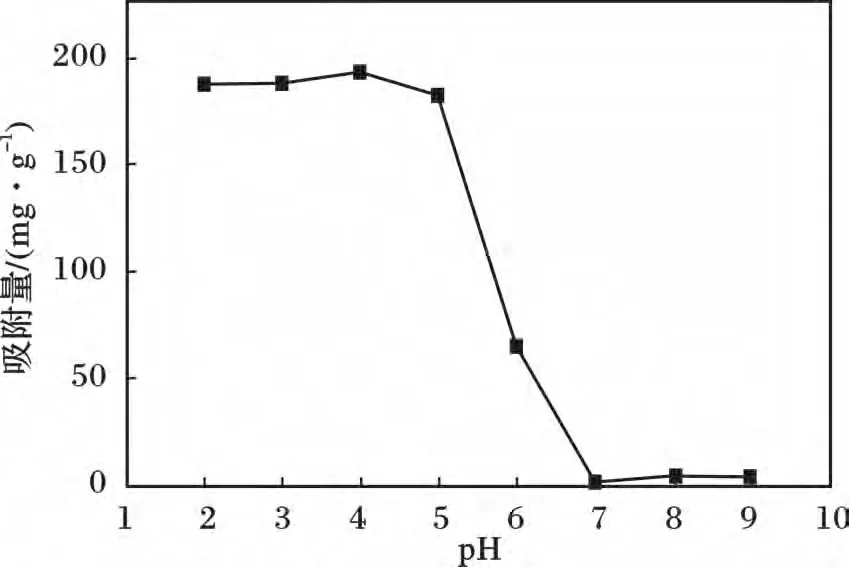
圖1 pH 值變化對Y2O3 吸附磷酸鹽的影響Fig.1 Effect of pH on phosphate adsorption by Y2O3
由圖1 可知,在pH 2 ~5 時,Y2O3對磷酸鹽表現出很強的吸附能力,pH=4 時吸附量達到最大,為193.2 mg/g,隨著pH 的增大,吸附量明顯降低。
2.3 吸附動力學分析
在Y2O3投加量為0.08 g,磷酸鹽溶液pH =3,溫度為35 ℃條件下,采用準一級、準二級和顆粒內擴散動力學模型,對不同初始濃度的磷酸鹽進行靜態吸附除磷動力學過程分析,結果見表2。
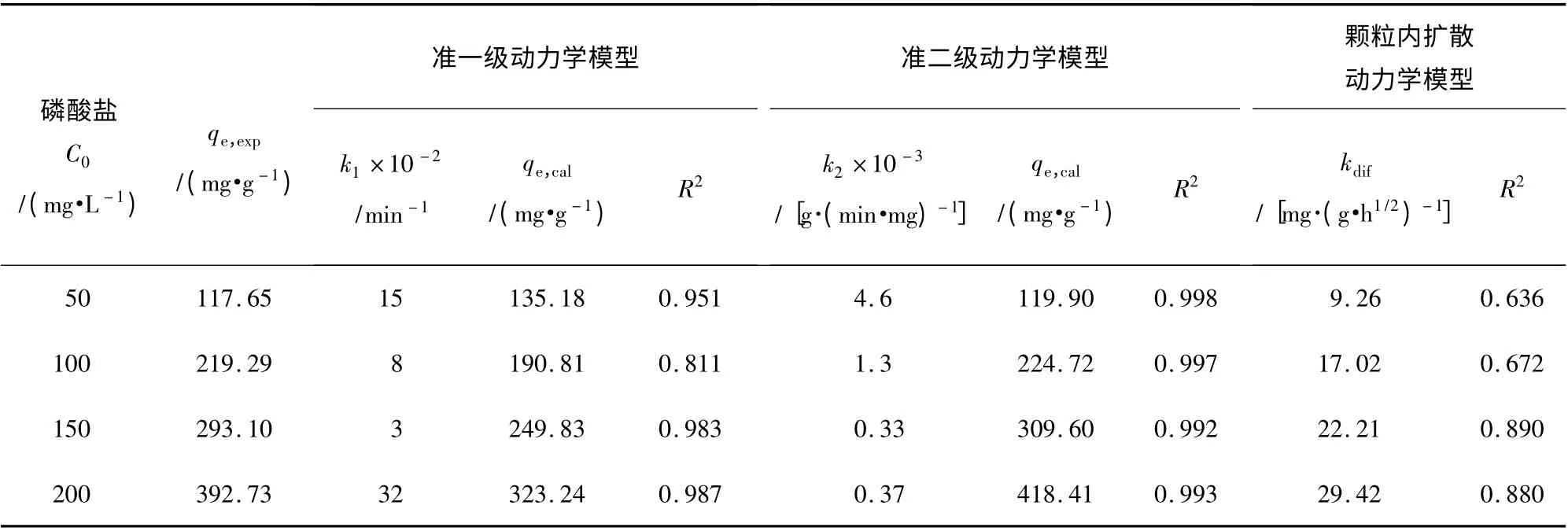
表2 不同初始磷酸鹽濃度下的Y2O3 吸附除磷動力學參數及相關系數Table 2 Kinetics parameters and correlation coefficients for phosphate adsorption onto Y2O3 at different initial phosphate concentrations
由表2 可知,吸附過程更加符合準二級吸附動力學,說明磷酸鹽在Y2O3表面主要發生了化學吸附[12]。
2.4 氧化釔對磷酸鹽的動態吸附
稱取1 cm3的Y2O3裝入夾套吸附柱中作為固定相,將pH = 3 濃度為100 mg/L 的KH2PO4以20 mL/h的流速流過固定相,此時體積空速為20 h-1,并且保持夾套吸附柱的溫度為35 ℃,流出液每10 mL 為一份,測定每份流出液磷酸根的濃度,結果見圖2。
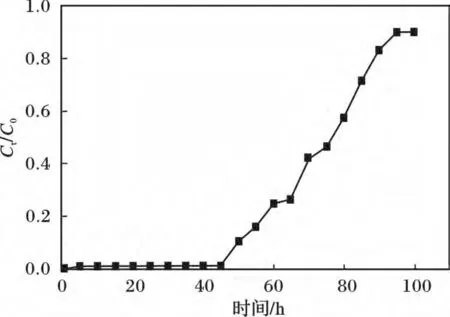
圖2 Y2O3 去除PO43-的動態吸附穿透曲線Fig.2 The breakthrough curves of-by Y2O3
由圖2 可知,前40 h 內Ct/C0均小于0.1,在50 h 時達到穿透點,90 h 時到達飽和點。說明在體積空速為20 h-1時,Y2O3對磷酸鹽的動態吸附效果很好。
圖3 為Y2O3動態吸附PO43-Thomas 模型模擬圖,通過Thomas 模型對氧化釔動態吸附磷酸鹽實驗數據進行擬合,得到KTh=0.872 7 mL/(mg·h),q0=150.46 mg/g,R2=0.929 6,Thomas 模型對Y2O3動態吸附擬合結果較好,在體積空速為20 h-1時,動態吸附的飽和吸附量可達到150.46 mg/g。
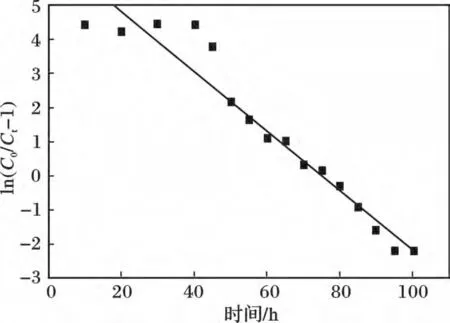
圖3 Y2O3 動態吸附PO43-Thomas 模型模擬Fig.3 Dynamic adsorption process of PO43- by Y2O3 were fitted by the Thomas model
2.5 磷酸鹽靜態吸附放大實驗
將5 g Y2O3加入到pH =2 的200 mL 的5 g/L磷酸鹽溶液中,在溫度35 ℃條件下吸附90 min,吸附磷酸鹽后的產物記為Y2O3-P。測得吸附后溶液的磷酸根濃度為1.588 g/L,計算吸附磷酸根的質量為0.752 4 g。通過過濾、水洗、甲醇洗,100 ℃烘干2 h,得到5.642 9 g 產物。另外,為探究Y2O3在酸性溶液的穩定性,將5 g Y2O3加入到pH =2(用稀鹽酸調節)的20 mL 水中,在80 ℃烘干24 h,所得產物記為Y2O3-W。Y2O3-P、Y2O3掃描電鏡分析結果見圖4。

圖4 氧化釔吸附前(a)及吸附后(b)的電鏡圖Fig.4 SEM photograph of Y2O3 before phosphate adsorption(a)and SEM photograph of Y2O3 after phosphate adsorption (b)
由圖4 可知,吸附前孔隙多,表面粗糙;吸附后,氧化釔表面較為平坦,表面空隙被填滿。可見磷酸鹽通過物理吸附或化學吸附,從溶液中轉移到氧化釔表面。
Y2O3、Y2O3-W 和Y2O3-P 紅外光譜見圖5。
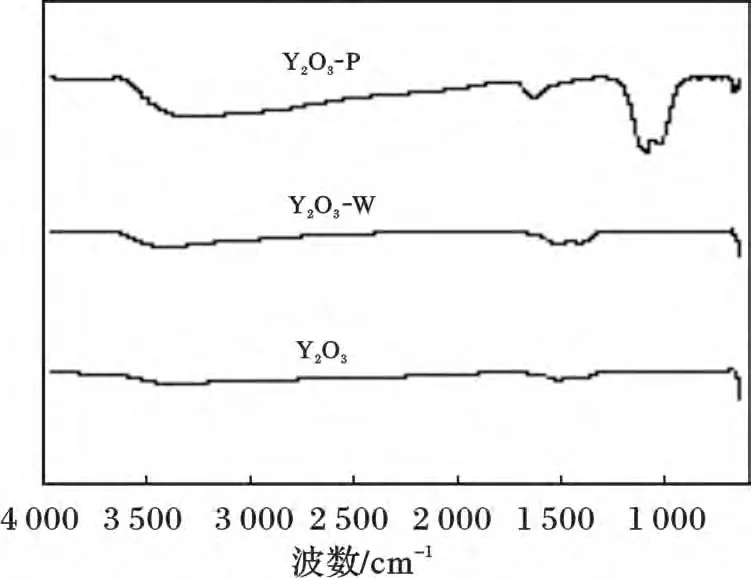
圖5 Y2O3、Y2O3-W、Y2O3-P 的IR 譜圖Fig.5 The IR curves of Y2O3,Y2O3-W and Y2O3-P
由圖5 可知,Y2O3和Y2O3-W 的譜圖沒有明顯變化,Y2O3-P 的1 076 cm-1處有強而寬PO43-彎曲振動峰,并且在1 007 cm-1處出現了肩峰,說明Y2O3對磷酸鹽具有較強的吸附能力。
圖6 為Y2O3-P、Y2O3-W、Y2O3的XRD。
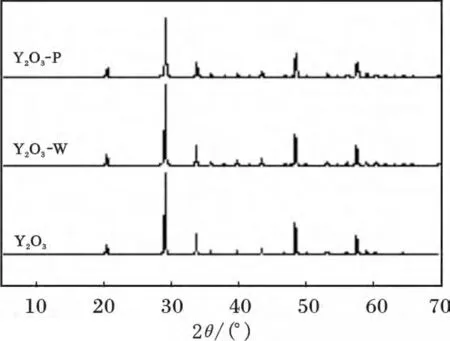
圖6 Y2O3、Y2O3-W、Y2O3-P 的XRD 譜圖Fig.6 XRD curves of Y2O3,Y2O3-W and Y2O3-P
由圖6 可知,Y2O3在酸性條件的水中及吸附磷酸鹽后未發現其他物相,說明Y2O3在酸性的水溶液中是一種穩定的化合物,且吸附過程中并不是通過生成氫氧化釔或直接生成磷酸釔進行吸附。
2.6 吸附機理探討
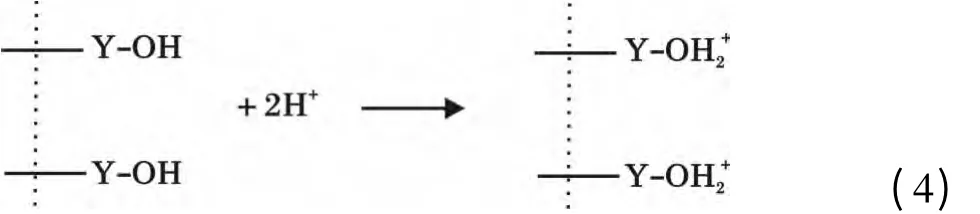
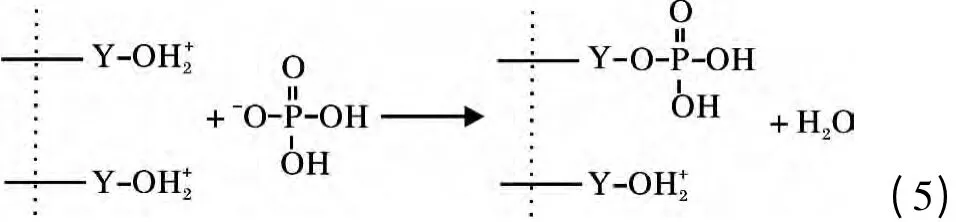
將0.08 g Y2O3投入到150 mg/L 的200 mL 磷酸鹽溶液,溶液pH =3,待吸附完全后,用6 mol/L的NaOH 調溶液pH=14,解吸4 h,計算出解吸率僅為3.69%,說明Y2O3與磷酸鹽結合很牢固,吸附的主要過程并非發生物理吸附而是化學吸附,并不是通過生成氫氧化釔或直接生成磷酸釔進行吸附。和很多氧化物一樣,Y2O3存在表面羥基[13],在吸附過程中Y2O3在磷酸鹽溶液中與水分子接觸后表面立即與水結合,相界面發生荷電離子轉移,使得氧化釔表面羥基化,表面羥基可離子化而表現出Lewis 酸堿性,進而可與溶液中的配體進行反應。在pH <7時,Y2O3的表面羥基被質子化,與H2PO4
-和HPO42-生成單齒單核和雙齒雙核表面絡合物[14],其機理如下:
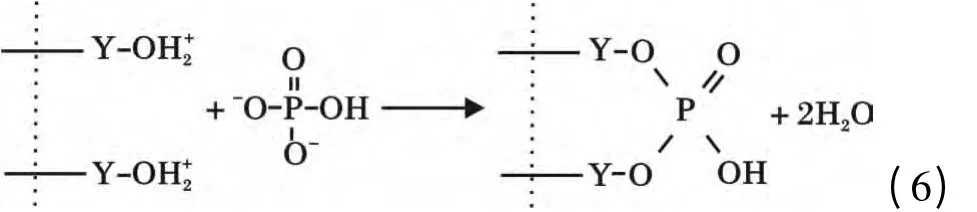
隨著pH 的增大,Y2O3表面電性由正變負,磷酸鹽更多的轉變為PO43-,二者間的斥力很大,不利于磷酸根離子與Y2O3的結合,故吸附量明顯降低。
3 結論
(1)在靜態吸附中,在pH 較低時,Y2O3表現出很強的吸附能力,pH=4 時吸附效果最好,吸附量為193.2 mg/g,隨著pH 的增大,吸附量明顯降低。
(2)用Thomas 模型對Y2O3動態吸附擬合的結果較好,在體積空速為20 h-1時,動態吸附的飽和吸附量可達到150.46 mg/g。
(3)Y2O3對磷酸鹽有較高的吸附速率,吸附屬于準二級動力學模型,吸附過程主要為化學吸附。
(4)Y2O3在酸性水溶液中是一種穩定的化合物,吸附過程中并不是通過生成氫氧化釔或直接生成磷酸釔進行吸附。Y2O3在磷酸鹽溶液中表面羥基化,在pH <7 時表面羥基質子化,與和生成單齒單核和雙齒雙核表面絡合物。
[1] 梁語燕,李元慈,董歲明.煤爐渣對污水中磷離子吸附作用研究[J].應用化工,2013,42(10):1870-1872.
[2] 印露,雷國元,李陳君,等. 焙燒態鎂鋁鐵類水滑石對磷酸根離子的吸附[J].環境化學,2012,31(7):1049-1056.
[3] 郭會超,李文軍,王環穎,等. 幾種水合金屬氧化物的磷酸根吸附性能[J]. 環境科學與技術,2011,34(3):15-18.
[4] 丁文明,黃霞,張力平. 水和氧化鑭除磷的試驗研究[J].環境科學,2003,24(5):110-113.
[5] 焦中志,張昱,楊敏,等. 稀土鈰基無機吸附劑對氟的吸附性能[J].環境化學,2002,21(4):365-370.
[6] Zhang Ling,Wan Lihua,Chang Ning,et al. Removal of phosphate from water by activated carbon fiber loaded with lanthanum oxide[J]. Journal of Hazardous Materials,2011,190:848-855.
[7] 趙春紅,任卿,寧平,等.稀土吸附劑在水處理方面的研究進展[J].中國稀土學報,2005,23(S1):90-93.
[8] Li Yongxiu,Lin Xiaoyun,Wang Yizheng,et al.Preparation and characterization of porous yttrium oxide powders with high specific surface area[J]. Journal of Rare Earth,2006,24:34-38.
[9] 王芳芳,葛明橋,王亞洲,等.有機-無機復合材料殼聚糖/氧化釔對Cr(Ⅵ)的吸附動力學與熱力學研究[J].化工新型材料,2012,40(8):97-106.
[10] 鄒衛華,韓潤平,陳宗璋,等. 錳氧化物/石英砂(MOCS)對銅和鉛離子的動態吸附[J]. 應用化學,2006,23(3):299.
[11]羅芳,詹鳳平,江映翔,等.固定化活性氧化鑭除磷的實驗研究[J].工業水處理,2010,30(6):11-14.
[12]Ho Y S,McKay G.Pseudo-second order model for sorption processes[J]. Process Biochemistry Biochemistry,1999,34(5):451-465.
[13]趙雷洪,鄭小明,費金華.稀土氧化物固體堿催化劑的表面性質[J].催化學報,1996,17(3):227-231.
[14]夏漢平,高子勤.磷酸鹽在土壤中的競爭吸附與解吸機制[J].應用生態學報,1993,4(1):89-93.

