無癥狀性腦動脈粥樣硬化與大動脈粥樣硬化性卒中患者血漿微小RNA表達分析
楊淑娜,馬愛軍,潘旭東,仲倩維,王蘭,張璋,龐萌
微小核糖核苷酸(microribonucleic acid,miRNA)是一類長20~24 nt的內源性非編碼核糖核酸(ribonucleic acid,RNA)分子,主要通過識別靶基因3’非翻譯區的靶位點介導mRNA降解或者翻譯抑制發揮作用[1]。已有研究提示miRNAs在血管內皮細胞炎性反應和衰老[2]、血管平滑肌細胞增殖和遷移[3]、單核細胞黏附及其向巨噬細胞分化[4]、血管完整性維持[5]及膽固醇代謝[6]等過程中發揮調控作用,并且在腦缺血后神經元凋亡及缺血性卒中病理生理過程中起到重要調控作用[7-9]。目前認為大動脈粥樣硬化(large artery atherosclerotic,LAA)性卒中比較明確地由無癥狀性腦動脈粥樣硬化(asymptomatic cerebral atherosclerosis,AS)所致[10],但在AS的發生發展過程和LAA性卒中形成過程中,miRNA的變化尚不完全明確。研究證實,miRNA能夠在血漿中穩定存在[11],本研究采用Solexa高通量測序技術建立AS患者及LAA性卒中患者血漿miRNA差異表達譜,并對差異miRNA調控的靶基因進行初步預測和功能分析,為進一步研究AS和LAA性卒中的發生發展機制提供新線索。
2 對象和方法
2.1 研究對象 連續選入2013年1月~2013年2月于青島大學醫學院附屬醫院神經內科就診的首次發病72 h內的缺血性卒中患者或健康體檢者,所有參與者均為長期生活在本地區的漢族人,并簽署知情同意書。該研究經過醫院倫理委員會批準。
2.1.1 LAA組患者 按照急性卒中治療低分子肝素試驗病因分型法(Trial of Org 10172 in Acute Stroke Treatment,TOAST分型)[12]屬于LAA性卒中患者8例。
入組標準:首次發病且72 h內就診的LAA性卒中患者,年齡50~80歲。
排除標準:心源性栓塞、其他病因或不明原因型卒中,心臟疾病及近期發生的急性心肌梗死、心絞痛,嚴重的肝、腎功能不全,嚴重感染、腫瘤、血栓性疾病,以及發病前2周內服用抗凝、抗血小板藥物者。
2.1.2 AS組患者 本研究納入AS腦血管動脈粥樣硬化狹窄程度≥50%的受試者8例。
入組標準:既往無腦血管病發作史,顱腦電子計算機體層掃描(computerized tomograthy,CT)或磁共振成像(magnetic resonance imaging,MRI)證實無腦梗死灶;影像學檢查顯示腦血管存在動脈粥樣硬化斑塊且導致血管中、重度狹窄(狹窄率≥50%),年齡50~80歲。
排除標準:近2周內服用抗凝劑、抗血小板藥物者,其余同LAA組。
2.1.3 對照組 本研究納入同期體檢的健康對照且腦血管未見明顯狹窄或動脈粥樣硬化斑塊者8例。
入組標準:既往無腦血管病發作史,顱腦CT或MRI證實無腦梗死灶;影像學檢查顯示腦血管未見明顯狹窄或動脈粥樣硬化斑塊;年齡50~80歲。
排除標準:近2周內服用抗凝劑、抗血小板藥物者,其余同LAA組。
2.2 標本收集 所有受試者均于入院后次日凌晨5點空腹抽取前臂靜脈血5 ml置于乙二胺四乙酸二鈉(edetate disodium,EDTA)抗凝管,室溫固定2 h,常溫下3000 r/min離心10 min,收集上清液置于Eppendof管中,-80℃凍存待測。
2.3 研究方法方法
2.3.1 收集資料 收集所有研究對象的基本人口學信息、高血壓、糖尿病、吸煙史、飲酒史等資料,所有研究對象均經顱腦CT和(或)MRI證實有無缺血性卒中,并行經顱多普勒(transcranial Doppler,TCD)、心臟超聲、顱腦磁共振血管成像(magnetic resonance angiography,MRA)、頸部CT血管造影(computed tomograthy angiography,CTA)和(或)數字減影血管造影(digital subtraction angiography,DSA)等檢查明確腦血管病變情況。缺血性卒中患者診斷符合中國急性缺血性卒中診治指南2010中的診斷標準[13];TOAST分型中的LAA性卒中。采用北美癥狀性頸動脈內膜切除試驗(North American Symptomatic Carotid Endarterectomy Trial,NASCET)法計算血管狹窄率[14],血管狹窄率=(狹窄遠端正常直徑-狹窄段最窄直徑)/狹窄遠端正常直徑×100%。
2.3.2 RNA提取及高通量測序 用mirVana PARIS試劑盒提取總RNA,采用Ambion’s miRNA分離試劑盒(美國Ambion公司)分離富集miRNAs,具體操作步驟嚴格按照試劑盒說明書進行。然后在RNA的5’和3’端加上接頭后,進行逆轉錄和聚合酶鏈反應(polymerase chain reaction,PCR),最終得到的PCR純化產物用于高通量測序(深圳華大基因)。通過與miRNA數據庫(miRBase)中指定范圍的miRNA進行比對,鑒定樣品中的已知miRNAs。
2.3.3 數據處理及分析 將測序量進行歸一化處理后進行miRNAs的聚類分析和篩選。歸一化表達量=miRNA表達量/樣品總miRNA表達量×歸一量級;采用MeV 4.6軟件進行miRNAs的聚類分析;Fold-change法篩選差異表達的miRNAs:差異表達的miRNA定義為P≤0.05且表達量差異倍數>2或<0.5。
2.3.4 預測差異miRNAs的靶基因并進行功能分析 利用Miranda、Pictar、Targetscan軟件預測差異miRNAs的靶基因,取至少2個軟件預測到的基因為靶基因,并將這些靶基因投射到Gene Ontology數據進行GO分析(分別描述基因的分子功能、所處的細胞位置、參與的生物過程)。以校正后P<0.01為顯著性閾值。
2.3.5 實時熒光定量PCR驗證 根據高通量測序結果,選取歸一化表達量較高的miRNAs(miR-146b-5p、miR-23a-3p、miR-10b-5p)進行實時熒光定量PCR驗證,采用SYBR PrimeScript miRNA RT-PCR試劑盒(TAKARA公司)進行miRNAs Poly(A)加尾反應、逆轉錄和PCR。miRNA的特異性上游引物購買于TAKARA公司。Poly(A)加尾反應和逆轉錄反應條件為37℃ 60 min,85℃5 s,產物-20℃保存。實時定量PCR條件為,95℃ 30 s,95℃ 5 s,60℃ 30 s,共40個循環。反應體系均為20 μl,按照說明書配制反應液,具體操作步驟嚴格按照說明書進行。PCR儀和結果分析軟件分別為RotorGENE-3000、RotorGene6(美國Corbett Research公司)。選用U6snRNA作為內參,采用2-△△Ct法計算血漿中miRNA的相對表達量。
2.5 統計分析 采用SPSS 17.0統計軟件,計量資料用(s)表示;計數資料用百分數(%)表示。多樣本均數比較采用單因素方差分析,差異有顯著性時采用LSD檢驗進行兩兩比較。率的比較采用χ2檢驗。
3 實驗結果
3.1 高通量測序入組者一般臨床資料比較 3組樣本參與者的年齡、高血壓病史、糖尿病史、吸煙史、飲酒史水平差異無顯著性(表1)。
3.2 已知miRNA聚類分析結果 將高通量測序得到的miRNA標準值進行聚類分析,關系近的miRNA會聚到一起(圖1),由于全圖較長,所以只能截取部分呈現,紅色表示上調,綠色表示下調,黑色表示差異無顯著性。
3.3 3組比較差異表達的miRNAs AS組與LAA組表達差異無顯著性(P>0.05或/且0.05<表達量差異倍數<2),并較對照組差異表達的miRNAs(P≤0.05且表達量差異倍數>2或<0.05)有41個(表2),血漿中的含量是control組高于LAA組和AS組。3組兩兩比較均有差異的miRNAs(P≤0.05且表達量差異倍數>2或<0.05)有26個(表2),在血漿中的含量是對照組高于LAA組,LAA組高于AS組。
3.4 差異表達的miRNA靶基因預測及功能分析結果
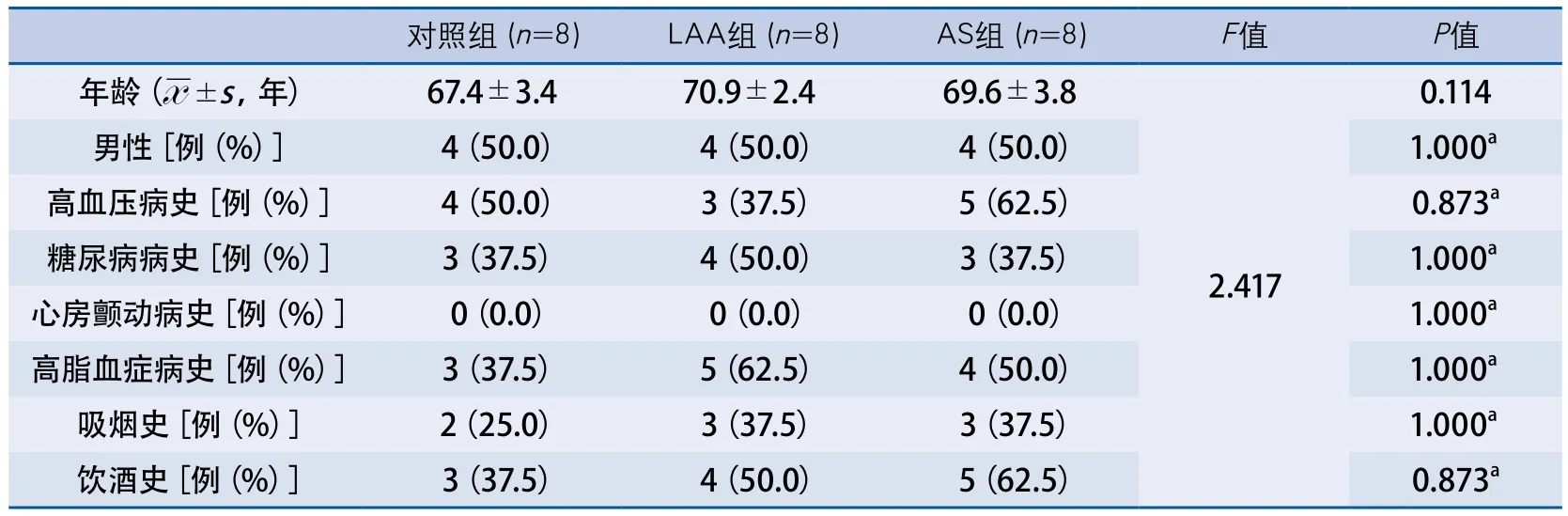
表1 高通量測序入組者一般臨床資料比較

圖1 已知miRNA的聚類分析圖(部分)注:miRNA:微小核糖核苷

表2 3組比較差異表達的miRNAs
3.4.1 靶基因預測結果 3個靶基因預測軟件,取至少2個軟件預測到的基因為靶基因,得到的靶基因很多,表2中只列出部分預測到的靶基因。
3.4.2 靶基因功能分析 LAA組和AS組表達一致,且較對照組差異表達的miRNA的靶基因生物學過程主要富集在轉運、定位、神經系統發育、細胞黏附和生物調控。3組表達均有差異的miRNA的靶基因生物學過程主要富集在生物調節、機體發育、代謝過程的調節和細胞分化(圖2)。
3.5 實時熒光定量PCR驗證結果 采用實時熒光定量PCR對miR-146b-5p、miR-23a-3p、miR-10b-5p進行驗證。3種miRNAs的PCR擴增峰均在35個循環之內,溶解曲線顯示單峰,提示擴增產物特異性良好。檢測結果顯示,miR-146b-5p和miR-23a-3p在3組間表達均有差異(P<0.05),相對表達量為對照組高于LAA組,LAA組高于AS組;miR-10b-5p在AS組和LAA組表達差異無顯著性(P>0.05),但較對照組表達下降(P<0.05)(圖3),結果與Solexa高通量測序結果一致。
4 討論
Solexa高通量測序技術是近年來發展的新測序技術,具有所需樣品量少、高通量和高精確性等優點,正逐漸代替傳統的Northern blot、陣列平臺檢測技術、熒光定量PCR技術和第一代基因芯片技術等成為miRNAs檢測的有效手段[15-16]。本研究采用該技術檢測血漿miRNAs的差異表達譜。
已有文獻報道miRNAs在AS和LAA性卒中的發生、發展過程中發揮著關鍵作用。Hergenreider等[17]研究發現,內皮細胞釋放含有miR-143的微泡,平滑肌細胞將這種微泡吸收,引起平滑肌細胞表型改變,進一步在動物實驗中證明對患有AS的小鼠注射miR-143微泡,能減少小鼠體內動脈粥樣硬化病變的形成。Cheng等[18]通過細胞實驗研究證明,miR-143作用于Krupppel樣因子(Krupppel like factor,KLF)2、心肌蛋白等轉錄因子,促進血管平滑肌細胞的分化和抑制增殖。本研究檢測人血漿中miRNA,發現miR-143在AS和LAA性卒中患者表達水平與健康對照者不同。已有研究證實[19],血管細胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)是miR-126的一個靶基因,可介導白細胞與內皮細胞的黏附,在人和小鼠中,miR-126低表達會上調VCAM-1表達而增強巨噬細胞黏附于血管內皮的能力。Long等[20]檢測miR-126在健康人和LAA性卒中患者血漿中的表達水平,結果顯示miR-126在LAA性卒中患者血漿中表達量低于健康人,提出miR-126可作為LAA性卒中的血漿標志物。而本研究同時檢測健康人、AS患者和LAA性卒中患者血漿中miR-126的表達水平,結果顯示miR-126在AS患者與LAA性卒中患者血漿中的表達水平差異無顯著性,提示血漿miR-126表達水平的下降主要與AS有關,而非梗死后腦組織損傷所致,因此,推測miR-126有可能是腦動脈粥樣硬化的潛在血漿標志物,這有待于大樣本實驗進一步的探究。

表3 靶基因預測的部分結果
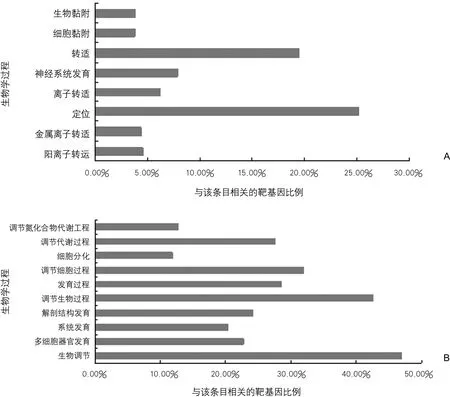
圖2 差異miRNAs靶基因參與的生物學過程注:A:LAA組和AS組表達一致,且較對照組差異表達的miRNAs的靶基因生物學過程(P<0.01);B:3組表達均有差異的miRNAs的靶基因的生物學過程(P<0.01)。miRNA:微小核糖核酸;LAA:大動脈粥樣硬化性卒中;AS:無癥狀性腦動脈粥樣硬化

圖3 選擇的3種miRNAs相對表達水平注:*:P<0.05。MiRNA:微小核糖核酸;LAA:大動脈粥樣硬化性卒中;AS:無癥狀性腦動脈粥樣硬化
本研究結果顯示3組表達均有差異的miRNAs,在血漿中的含量是對照組高于LAA組,LAA組高于AS組。研究顯示,卒中發生后,神經細胞及血管壁細胞壞死,胞質內miRNAs釋放入血,導致卒中后血漿miRNAs水平較卒中前有所升高[21];缺血急性期氧化應激、炎癥和凋亡反應也會導致miRNA水平較卒中前有所升高[22-23],這可能是miRNAs在LAA組含量高于AS組的可能原因。而LAA組與AS組含量都低于對照組,我們考慮是與AS的發生發展過程有關,其中的發生發展機制有待于進一步基礎實驗研究。
本研究通過生物學軟件對差異性表達的miRNAs進行靶基因預測和功能分析。靶基因預測結果顯示,SMAD1為miR-26a潛在的作用靶點,Leeper等[24]研究發現miR-26a可通過轉化生長因子β(transforming growth factor β,TGF-β)信號通路調控平滑肌細胞的功能,SMAD1為其靶基因之一,而SMAD1是骨形態生成蛋白通路的重要轉錄因子[25]。骨形態生成蛋白對多種細胞(如內皮細胞)的增殖、分化、凋亡具有調控作用[26],AS是動脈壁對血管內皮細胞損傷的一種慢性炎癥過程[27]。因此miR-26a可能通過調節其下游靶基因SMAD1的表達在AS的發生發展過程中發揮重要作用。GO分析從生物學過程、細胞組分和分子功能三個方面對靶基因進行功能分析,結果顯示差異miRNA的靶基因參與的生物學過程主要包括離子轉運、定位、神經系統發育、細胞黏附、細胞分化、細胞增殖。這些生物學過程中很多都與內皮細胞生物學特性及AS的發生發展和急性缺血后細胞死亡相關[27-28]。
本研究采用高通量測序技術檢測患者血漿miRNA的差異表達譜,結果顯示AS患者及LAA性卒中患者血漿miRNA表達譜既有差別又有相同之處,但本研究僅通過生物信息學技術對miRNA的靶基因進行預測和功能分析,具體的機制仍需進一步基礎和臨床實驗研究。
1 Alvarez-Garcia I, Miska E. MicroRNA functions in animal development and human disease[J].Development, 2005, 132:4653-4662.
2 Ito T, Yagi S, Yamakuchi M. MicroRNA-34a regulation of endothelial senescence[J]. Biochem Biophys Res Commun, 2010, 398:735-740.
3 Cordes KR, Sheehy NT, White MP, et al. miR-145 and miR-143 regulate smooth muscle cell fate and plasticity[J]. Nature, 2009, 460:705-710.
4 Li T, Morgan MJ, Choksi S, et al. MicroRNAs modulate the noncanonical transcription factor NF-[kappa] B pathway by regulating expression of the kinase IKK alpha during macrophage differentiation[J]. Nat Immunol, 2010, 11:799-805.
5 Wang S, Aurora AB, Johnson BA, et al. The endothelial-specific microRNA miR-126 governs vascular integrity and angiogenesis[J]. Developmental cell, 2008, 15:261-271.
6 Rayner KJ, Suárez Y, Dávalos A, et al. MiR-33 contributes to the regulation of cholesterol homeostasis[J]. Science, 2010, 328:1570-1573.
7 Ruberti F, Barbato C, Cogoni C. Targeting microRNAs in neurons:tools and perspectives[J]. Exp Neurol, 2012,235:419-426.
8 McNeill E, Van VD. MicroRNAs shape the neuronal landscape[J]. Neuron, 2012, 75:363-379.
9 顧亞麗, 褚克曇, 羅本燕. 微核糖核酸在腦缺血中的作用研究進展[J]. 中國卒中雜志, 2012, 7:817-821.
10 Humphries SE, Morgan L. Genetic risk factors for stroke and carotid atherosclerosis:insights into pathophysiology from candidate gene approaches[J].Lancet Neurol, 2004, 3:227-235.
11 Li Y, Kowdley KV. Method for microRNA isolation from clinical serum samples[J]. Anal Biochem, 2012,11:007.
12 Adams HP, Bendixen BH, Kappelle LJ, et al.Classification of subtype of acute ischemic stroke.Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment[J]. Stroke, 1993, 24:35-41.
13 劉鳴, 張蘇明, 郝子龍, 等. 中國急性缺血性卒中診治指南2010版的制定及解讀[J]. 中華神經科雜志, 2011,44:369-374.
14 Lee KW, Park YJ, Rho YN, et al. Measurement of carotid artery stenosis:correlation analysis between B-mode ultrasonography and contrast arteriography[J].J Korean Surg Soc, 2011, 80:348-54.
15 Git A, Dvinge H, Salmon-Divon M, et al. Systematic comparison of microarray profiling, real-time PCR, and next-generation sequencing technologies for measuring differential microRNA expression[J]. RNA, 2010,16:991-1006.
16 湯海明, 陳紅, 張靜, 等. 新一代測序技術應用于microRNA檢測[J]. 遺傳, 2012, 34:784-792.
17 Hergenreider E, Heydt S, Tréguer K, et al.Atheroprotective communication between endothelial cells and smooth muscle cells through miRNAs[J]. Nat Cell Biol, 2012, 14:249-256.
18 Cheng Y, Liu X, Yang J, et al. MicroRNA-145, a novel smooth muscle cell phenotypic marker and modulator,controls vascular neointimal lesion formation[J]. Circ Res, 2009, 105:158-166.
19 Harris TA, Yamakuchi M, Ferlito M, et al.MicroRNA-126 regulates endothelial expression of vascular cell adhesion molecule 1[J]. Proc Natl Acad Sci U S A, 2008, 105:1516-1521.
20 Long G, Wang F, Li H, et al. Circulating miR-30a, miR-126 and let-7b as biomarker for ischemic stroke in humans[J]. BMC Neurol, 2013, 13:178.
21 Mayr M, Zampetaki A, Kiechl S. MicroRNA biomarkers for failing hearts?[J]. Euro Heart J, 2013,34:2782-2783.
22 Dharap A, Bowen K, Place R, et al. Transient focal ischemia induces extensive temporal changes in rat cerebral microRNAome[J]. J Cereb Blood Flow Metab,2009, 29:675-687.
23 Jeyaseelan K, Lim KY, Armugam A, et al. MicroRNA expression in the blood and brain of rats subjected to transient focal ischemia by middle cerebral artery occlusion[J]. Stroke, 2008, 39:959-966.
24 Leeper NJ, Raiesdana A, Kojima Y, et al. MicroRNA-26a is a novel regulator of vascular smooth muscle cell function[J]. J Cell Physiol, 2011, 226:1035-1043.
25 Miyazono K, Kamiya Y, Morikawa M. Bone morphogenetic protein receptors and signal transduction[J]. J Biochem, 2010, 147:35-51.
26 Ehrlich M, Horbelt D, Marom B, et al. Homomeric and heteromeric complexes among TGF-β and BMP receptors and their roles in signaling[J]. Cell Signal,2011, 23:1424-1432.
27 Ross R. Atherosclerosis-an inflammatory disease[J]. N Engl J Med, 1999, 340:115-126.
28 Koutsis G, Siasos G, Spengos K. The emerging role of microRNA in stroke[J]. Curr Top Med Chem, 2013,13:1573-1588.
【點睛】
采用高通量測序技術建立無癥狀性腦動脈粥樣硬化及大動脈粥樣硬化性卒中患者血漿微小RNA差異表達譜。

