自噬
——腦缺血損傷中的雙刃劍
李巍巍,王群,郭安臣,王擁軍,李俊發
卒中具有高患病率、高復發率、高致殘率和高死亡率的特點,目前已成為世界公認的第三大致死性疾病[1-2]。卒中分為出血性和缺血性兩大類,其中發病率較高的為缺血性卒中,占卒中總數的60%~80%[3]。近20年監測結果顯示,我國約有700萬缺血性卒中患者,年死亡人數逾200萬,且年增長速率達8.7%。缺血性卒中急性期治療的主要有效手段為發病4.5 h內給予重組組織型纖溶酶原激活劑(recombinant tissue plasminogen activator,rt-PA)溶栓,但由于受時間窗限制,即使像美國這樣醫療發達的國家,也只有3.4%~5.2%缺血性卒中患者有機會接受rt-PA溶栓治療[4]。此外,到目前為止已超過2000種神經保護性藥物臨床前期試驗失敗。為此,開發用于缺血性卒中治療的新藥物、新靶點是一項亟待解決的工作。Wen等[5]研究表明,細胞自噬在腦缺血后激活且可能成為一種治療缺血性卒中的新靶點。但自噬和腦缺血之間的關系仍存在爭議,如Carloni等[6]研究表明,自噬的激活可以對抗神經元死亡,但Koike等[7]則發現細胞自噬具有更大的破壞性作用。據此,本文主要介紹細胞自噬在腦缺血/低氧損傷中的作用及其可能的信號轉導通路。
1 細胞自噬及其信號通路簡述
自噬是真核細胞廣泛存在的降解/再循環系統,細胞通過自身形成的囊泡,吞噬胞質內變性蛋白質和細胞器,通過微管相關蛋白,以動力依賴性的方式轉運至溶酶體并與之融合,降解其所包裹的內容物,是一種通過蛋白質和受損細胞器重復利用來維持細胞穩態的過程[8-9]。根據細胞內底物運送到溶酶體腔方式的不同,哺乳動物細胞自噬可分為3種主要方式:巨自噬、微自噬和分子伴侶介導的自噬[10-11]。巨自噬指細胞受到信號誘導后,在胞內產生雙層膜,膜包裹部分細胞質和需要降解的細胞器及蛋白質形成自噬體,雙膜結合囊泡與溶酶體融合形成自噬溶酶體隨后降解蛋白質。微自噬指溶酶體直接吞噬胞質成分的一種方式。分子伴侶介導的自噬指通過一些分子伴侶如熱休克蛋白70(hot shock protein,HSP70)幫助未折疊蛋白轉位入溶酶體,參與自噬。分子伴侶介導的自噬具有高度選擇性,不能降解細胞器,只能降解特定蛋白,如HSP70識別底物蛋白分子的特定氨基端序列并與之結合,分子伴侶-底物復合物與溶酶體膜上的受體溶酶體相關膜蛋白2A(lysosome-associated membrane protein 2a,LAMP-2A)結合后,底物去折疊,溶酶體腔中的另外一種分子伴侶介導底物在溶酶體膜的轉位,進入溶酶體腔中的底物在水解酶作用下分解為其組成成分,被細胞再利用(圖1)。
2 自噬與腦缺血損傷
自噬在腦缺血后數小時內發生,Zhu等[13]在小鼠低氧暴露及缺血(hypoxic ischemia,HI)損傷8 h后,檢測到自噬體標志分子微管相關蛋白1輕鏈3(microtubule-associated protein 1 light chain 3,LC3-Ⅱ)表達的增加及大量自噬體形成,24~72 h尤為明顯。Xia等[14]在大鼠腦缺血預適應(ischemic preconditioning,IPC)模型中發現IPC可通過誘導細胞自噬來減輕缺血損傷,而3-甲基腺嘌呤(3-methyladenine,3-MA)可通過抑制細胞自噬,解除IPC的神經保護作用。同樣Yan等[15]也發現,細胞自噬參與高壓氧預適應對大鼠缺血腦組織的保護作用。Yang等[16]也發現傳統中藥雷公藤甲素在大鼠局灶腦缺血后的神經保護作用也是通過上調自噬水平而實現。
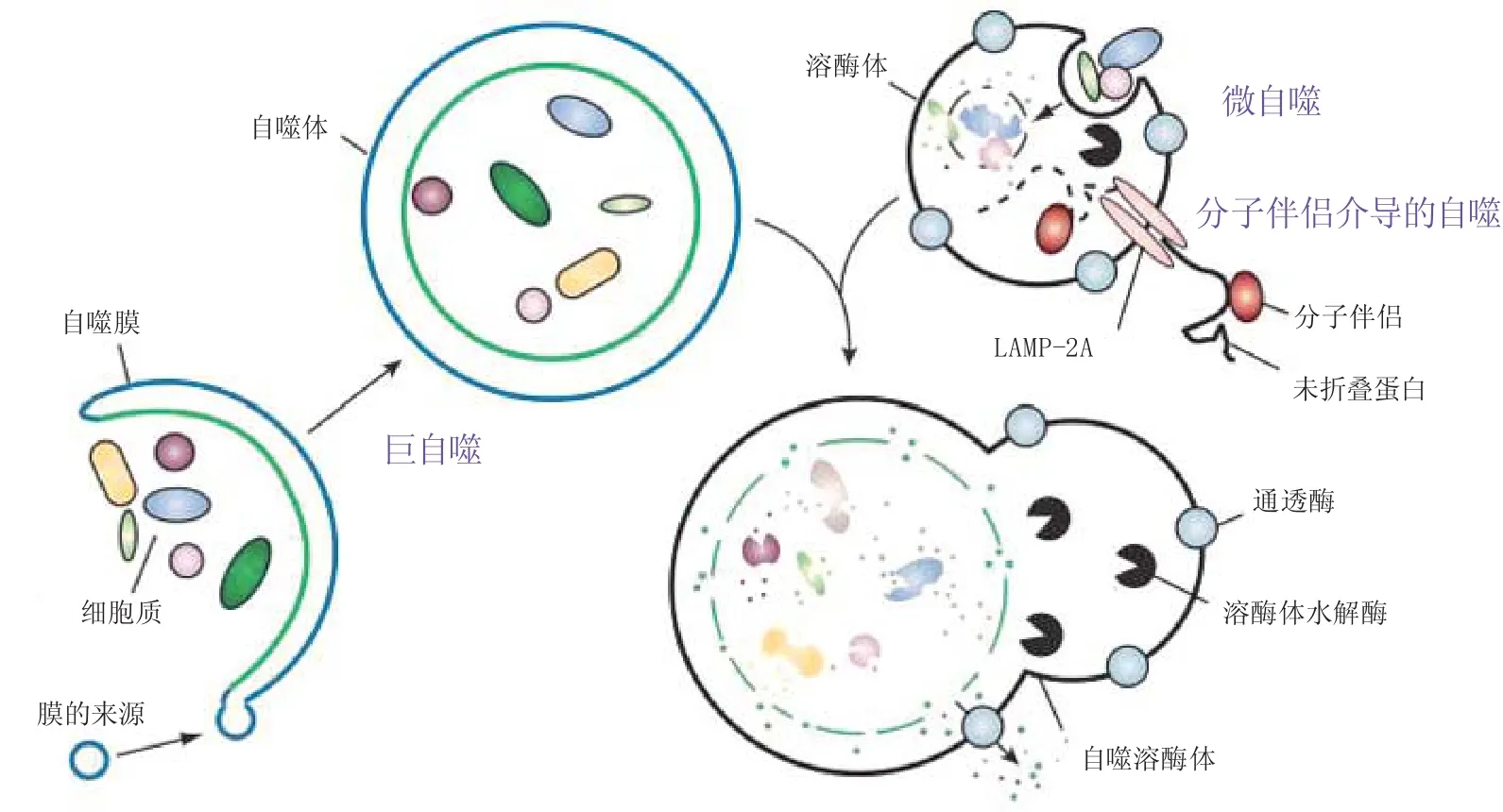
圖1 自噬的3種方式[12]注:LAMP-2A:溶酶體相關膜蛋白
但也有研究提出相反的結論認為細胞自噬加重缺血性卒中的損傷。Gao等[17]在大鼠缺血后適應模型中使用雷帕霉素誘導自噬,發現雷帕霉素抑制了缺血后適應誘導的腦保護作用。Puyal等[18]在大鼠腦局灶性缺血再灌注3 h內注射3-MA,梗死體積明顯減小,因此,該研究認為局灶性腦缺血再灌注后,抑制自噬可以保護神經組織。Zheng等[19]運用核糖核酸干擾技術((ribonucleic acid interference,RNAi),采用側腦室注射連結有Beclin-1干擾片段的慢病毒載體技術,發現缺血大鼠腦內自噬相關分子Beclin-1表達下調,可減輕缺血性腦損傷。Koike等[7]證明,在小鼠缺血低氧模型中發現,LC3-II蛋白水平顯著升高,海馬錐體細胞層自噬體的形成和海馬神經元廣泛死亡,而Atg7基因(誘導自噬的必需基因)缺陷小鼠的神經元死亡顯著減少,由此認為自噬導致神經元損傷。Yang等[20]在小鼠局灶缺血模型中抑制小膠質細胞自噬可減輕神經炎癥反應,改善小鼠神經功能缺失的評分,該研究同樣支持自噬加重神經元損傷的觀點。Wu等[21]報道也指出,電針刺預適應所產生的對缺血損傷的耐受性也是因為自噬被抑制。近年來關于自噬的研究逐年增加,它在腦缺血中發揮的作用已引起廣泛關注,盡管其作用可能是對神經元的保護也可能是加重損傷,但無論如何,基于自噬的研究都將為卒中治療提供新思路。
3 自噬在腦缺血損傷中可能參與的信號通路
腦缺血可以激活多條信號通路并隨之伴發自噬。哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一種分子量為289kDa的絲氨酸/蘇氨酸蛋白激酶,通過與不同的輔助分子結合參與調控轉錄、細胞骨架組裝、細胞生長和存活等功能。Chong等[22]研究表明,PI3K/Akt/mTOR信號通路參與調控腦缺血過程中的急性神經損傷,PI3K磷酸化激活Akt使其磷酸化,抑制結節硬化復合物(tuberous sclerosis complex 1/2,TSC1/2)活化,TSC1/2失活后激活Ras蛋白腦組織同源類似物(Ras homolog enriched in brain,Rheb),mTOR隨之被激活,自噬被活化的mTOR所抑制,PI3K由組件Ⅰ、組件Ⅱ和組件Ⅲ三部分組成,Beclin-1是組件Ⅲ中的組成成分,在自噬的起始階段發揮重要作用,并通過與PI3K信號通路中的其他組分相互作用在腦缺血過程中激活自噬[23-24]。過氧化物酶體增殖物激活受體γ(peroxisome proliferatoractivated receptor-γ,PPAR-γ)作為核激素受體超家族中的一員,是配體激活的轉錄因子。PPAR-γ活化通過上調B淋巴細胞瘤相關蛋白2(B-cell lymphoma-2,BCL-2)/B淋巴細胞瘤特大型蛋白(B-cell lymphoma-extra large,BCL-XL)表達拮抗Beclin-1介導的自噬[25]。Bcl-2磷酸化激活自噬并減輕線粒體損傷[26]。
AMP活化蛋白激酶[adenosine 5’-monophosphate(AMP)-activated protein kinase,AMPK]是一種絲氨酸/蘇氨酸蛋白激酶,由3個亞基組成:α催化亞基、β和γ調節亞基。目前研究認為,α催化亞基包含的一個蘇氨酸磷酸化位點,當其磷酸化時,激活AMPK,AMPK的激活抑制mTOR活性以誘導自噬[27-28]。
核因子κB(nuclear factor kappa B,NF-κB)是一種轉錄因子,調節多種基因的表達[29]。Li等報道,在腦缺血過程中NF-κB1(p50)敲除可抑制mTOR活性而增強自噬[30]。NF-κB依賴的p53信號轉導途徑也與腦缺血再灌后的自噬和細胞凋亡相關[31]。MAPK是mTORC1的上游調節因子,腦缺血/再灌注過程中 MAPK-mTOR信號通路也可誘導自噬[32]。
低氧誘導因子1(hypoxia-inducible factor 1,HIF-1)是由一個組成型表達的HIF-1β亞基和一個可誘導表達的HIF-1α亞基構成,在腦缺血期間響應于低氧激活的關鍵轉錄因子[33]。由于泛素化在低氧條件下被抑制,HIF-1α可與HIF-1β形成二聚體,這些二聚體激活低氧反應的若干下游基因,如血管內皮生長因子(vascular endothelial growth factor,VEGF)、促紅細胞生成素(erythropoietin,EPO)、葡萄糖轉運蛋白1和糖酵解酶等[34]。Bcl-2和腺病毒E1B 19 kDa的相互作用蛋白3(Bcl-2 and adenovirus E1B 19 kDa interacting proteins 3,BNIP3)具有一個Bcl-2的同源結構域3(BH3),是Bcl-2家族的亞家族,也是HIF-1α的重要靶基因[35]。BNIP3可以和Beclin-1競爭結合Bcl-2,而Beclin-1則被釋放出來而觸發自噬[23]。BNIP3也可抑制mTOR的上游活化劑Rheb,最終通過抑制mTOR活性激活自噬。然而,這些因子的相關作用仍然需要在體內試驗中證明[36]。HIF-1α也可通過上調另一靶基因——腫瘤蛋白p53在局部缺血后自噬激活中發揮重要作用[34]。
自噬樣細胞死亡在神經系統氧化應激情況下被激活[37]。氧化應激發生在腦缺血過程,可引起活性氧自由基增多如超氧化物、羥基自由基和過氧化氫。Mehta等[38]研究報道,硒通過保護線粒體功能,減少活性氧生產和自噬而提供神經保護。自噬也被興奮性毒性誘導[39]。雖然可興奮性谷氨酸可阻斷自噬,但也可能在海馬神經元誘導自噬[40]。Ouyang[41]報道,腦缺血過程中內質網應激,當內質網周圍的興奮性神經遞質達到毒性水平,鈣離子通過蘭尼堿受體和IP3R的激活而釋放,從而導致線粒體內Ca2+超載,激活細胞凋亡,期間內質網應激,鈣內流也可能激活自噬。
綜上,總結自噬在腦缺血損傷過程中可能參與的信號通路如圖2。
自噬是一把雙刃劍:一方面過度的自噬可誘導自噬性細胞死亡,并與凋亡信號存在交互作用;另一方面自噬作為自體修復的重要過程,適度激活可能在受損細胞幫助清除受損的細胞器和異常蛋白、防止蛋白聚集,從而對細胞損傷起保護作用。盡管自噬在腦缺血損傷中的作用仍存在爭議,但與自噬相關聯的信號通路可能為制訂新的神經保護策略提供潛在靶點。
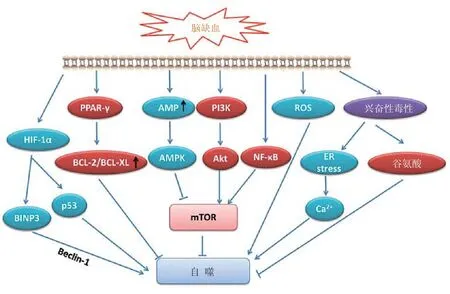
圖2 腦缺血/低氧損傷過程中可能參與自噬的信號通路注:HIF-1α:低氧誘導因子1;BNIP3:Bcl-2和腺病毒E1B 19 kDa的相互作用蛋白3;Beclin-1:哺乳動物同源的酵母自噬相關基因Atg6;p53:腫瘤蛋白p53;PPAR-γ:過氧化物酶體增殖物激活受體γ;BCL-2:B淋巴細胞瘤相關蛋白2;BCL-XL:B淋巴細胞瘤特大型蛋白;AMP:腺苷-5’-單磷酸;AMPK:AMP活化蛋白激酶;PI3K:磷酸肌醇3-激酶;Akt:蛋白酶B;NF-κB:核因子κB;ROS:活性氧自由基,ER stress:內質網應激;mTOR:哺乳動物雷帕霉素靶蛋白
1 Marsh JD, Keyrouz SG. Stroke prevention and treatment[J]. J Am Coll Cardiol, 2010, 56:683-691.
2 Stemer A, Lyden P. Evolution of the thrombolytic treatment window for acute ischemic stroke[J]. Curr Neurol Neurosci Rep,2010, 10:29-33.
3 Go AS, Mozaffarian D, Roger VL, et al. Heart disease and stroke statistics--2014 update:a report from the American Heart Association[J].Circulation, 2014, 129:e28-e292.
4 Adeoye O, Hornung R, Khatri P, et al.Recombinant tissue-type plasminogen activator use for ischemic stroke in the United States:a doubling of treatment rates over the course of 5 years[J]. Stroke, 2011, 42:1952-1955.
5 Wen YD, Sheng R, Zhang LS, et al. Neuronal injury in rat model of permanent focal cerebral ischemia is associated with activation of autophagic and lysosomal pathways[J]. Autophagy, 2008, 4:762-769.
6 Carloni S, Buonocore G, Balduini W.Protective role of autophagy in neonatal hypoxia-ischemia induced brain injury[J].Neurobiol Dis, 2008, 32:329-339.
7 Koike M, Shibata M, Tadakoshi M, et al.Inhibition of autophagy prevents hippocampal pyramidal neuron death after hypoxic-ischemic injury[J]. Am J Pathol, 2008, 172:454-469.
8 Kuma A, Hatano M, Matsui M, et al. The role of autophagy during the early neonatal starvation period[J]. Nature, 2004, 432:1032-1036.
9 Mizushima N, Klionsky DJ. Protein turnover via autophagy:implications for metabolism[J].Annu Rev Nutr, 2007, 27:19-40.
10 Klionsky DJ. The molecular machinery of autophagy:unanswered questions[J]. J Cell Sci,2005, 118:7-18.
11 Massey AC, Zhang C, Cuervo AM. Chaperonemediated autophagy in aging and disease[J].Curr Top Dev Biol, 2006, 73:205-235.
12 Mizushima N, Levine B, Cuervo AM, et al.Autophagy fights disease through cellular self-digestion[J]. Nature, 2008, 451:1069-1075.13 Zhu C, Wang X, Xu F, et al. The influence of age on apoptotic and other mechanisms of cell death after cerebral hypoxia-ischemia[J].Cell Death Differ, 2005, 12:162-176.
14 Xia DY, Li W, Qian HR, et al. Ischemia preconditioning is neuroprotective in a rat cerebral ischemic injury model through autophagy activation and apoptosis inhibition[J]. Brazi J Med Biol Res, 2013,46:580-588.
15 Yan W, Zhang H, Bai X, et al. Autophagy activation is involved in neuroprotection induced by hyperbaric oxygen preconditioning against focal cerebral ischemia in rats[J].Brain Res, 2011, 1402:109-121.
16 Yang Y, Gao K, Hu Z, et al. Autophagy upregulation and apoptosis downregulation in DAHP and triptolide treated cerebral ischemia[J]. Mediators Inflamm, 2015,2015:120198.
17 Gao L, Jiang T, Guo J, et al. Inhibition of autophagy contributes to ischemic postconditioning-induced neuroprotection against focal cerebral ischemia in rats[J].PLoS one, 2012, 7:e46092.
18 Puyal J, Vaslin A, Mottier V, et al.Postischemic treatment of neonatal cerebral ischemia should target autophagy[J]. Ann Neurol, 2009, 66:378-389.
19 Zheng YQ, Liu JX, Li XZ, et al. RNA interference-mediated downregulation of Beclin1 attenuates cerebral ischemic injury in rats[J]. Acta Pharmacol Sin, 2009, 30:919-927.
20 Yang Z, Zhong L, Zhong S, et al. Hypoxia induces microglia autophagy and neural inflammation injury in focal cerebral ischemia model[J]. Exp Mole Pathol, 2015,98:219-224.
21 Wu Z, Zou Z, Zou R, et al. Electroacupuncture pretreatment induces tolerance against cerebral ischemia/reperfusion injury through inhibition of the autophagy pathway[J]. Mol Med Rep, 2015, 11:4438-4446.
22 Chong ZZ, Shang YC, Wang S, et al. A critical kinase cascade in neurological disorders:PI3K,Akt, and mTOR[J]. Future Neurol, 2012, 7:733-748.
23 Glick D, Barth S, Macleod KF.Autophagy:cellular and molecular mechanisms[J]. J Pathol, 2010, 221:3-12.
24 Xingyong C, Xicui S, Huanxing S, et al.Upregulation of myeloid cell leukemia-1 potentially modulates beclin-1-dependent autophagy in ischemic stroke in rats[J]. BMC Neurosci, 2013, 14:56.
25 Xu F, Li J, Ni W, et al. Peroxisome proliferator-activated receptor-gamma agonist 15d-prostaglandin J2 mediates neuronal autophagy after cerebral ischemia-reperfusion injury[J].PLoS One, 2013, 8:e55080.
26 Qi Z, Dong W, Shi W, et al. Bcl-2 phosphorylation triggers autophagy switch and reduces mitochondrial damage in limb remote ischemic conditioned rats after ischemic stroke[J]. Transl Stroke Res, 2015, Mar 7. [Epub ahead of print].
27 Poels J, Spasic MR, Callaerts P, et al.Expanding roles for AMP-activated protein kinase in neuronal survival and autophagy[J]. Bioessays,2009, 31:944-952.
28 Li J, McCullough LD. Effects of AMP-activated protein kinase in cerebral ischemia[J]. J Cereb Blood Flow Metab, 2010, 30:480-492.
29 Chen AC, Arany PR, Huang YY, et al. Low-level laser therapy activates NF-κB via generation of reactive oxygen species in mouse embryonic fibroblasts[J]. PLoS One, 2011, 6:e22453.
30 Li WL, Yu SP, Chen D, et al. The regulatory role of NF-kappaB in autophagy-like cell death after focal cerebral ischemia in mice[J]. Neuroscience,2013, 244:16-30.
31 Cui DR, Wang L, Jiang W, et al. Propofol prevents cerebral ischemia-triggered autophagy activation and cell death in the rat hippocampus through the NF-kappaB/p53 signaling pathway[J].Neuroscience, 2013, 246:117-132.
32 Wang PR, Wang JS, Zhang C, et al. Huang-Lian-Jie-Du-Decotion induced protective autophagy against the injury of cerebral ischemia/reperfusion via MAPK-mTOR signaling pathway[J].J Ethnopharmacol, 2013, 149:270-280.
33 Althaus J, Bernaudin M, Petit E, et al.Expression of the gene encoding the proapoptotic BNIP3 protein and stimulation of hypoxia-inducible factor-1alpha (HIF-1alpha)protein following focal cerebral ischemia in rats[J]. Neurochem Int, 2006, 48:687-695.
34 Xin XY, Pan J, Wang XQ, et al.2-methoxyestradiol attenuates autophagy activation after global ischemia[J]. Can J Neurol Sci, 2011, 38:631-638.
35 Cho B, Choi SY, Park OH, et al. Differential expression of BNIP family members of BH3-only proteins during the development and after axotomy in the rat[J]. Mol Cells, 2012, 33:605-610.
36 Zhang J, Ney PA. Mechanisms and biology of B-cell leukemia/lymphoma 2/adenovirus E1B interacting protein 3 and Nip-like protein X[J].Antioxid Redox Signal, 2011, 14:1959-1969.
37 Kubota C, Torii S, Hou N, et al. Constitutive reactive oxygen species generation from autophagosome/lysosome in neuronal oxidative toxicity[J]. J Biol Chem, 2010, 285:667-674.
38 Mehta SL, Kumari S, Mendelev N, et al.Selenium preserves mitochondrial function,stimulates mitochondrial biogenesis, and reduces infarct volume after focal cerebral ischemia[J]. BMC Neurosci, 2012, 13:79.
39 Puyal J, Ginet V, Grishchuk Y, et al.Neuronal autophagy as a mediator of life and death:contrasting roles in chronic neurodegenerative and acute neural disorders[J]. Neuroscientist, 2012, 18:224-236.
40 Kulbe JR, Mulcahy Levy JM, Coultrap SJ, et al.Excitotoxic glutamate insults block autophagic flux in hippocampal neurons[J]. Brain Res,2014, 1542:12-19.
41 Ouyang YB, Giffard R. ER-mitochondria crosstalk during cerebral ischemia:molecular Chaperones and ER-mitochondrial calcium transfer[J]. Int J Cell Biol, 2012, 2012:493934.
【點睛】
本文對自噬在腦缺血/低氧神經損傷中雙重作用及其可能的信號通路進行綜述。

敬請關注!《中國卒中雜志》公共微信平臺訂閱號:CJStroke(安紐醫學)