三陰性與非三陰性乳腺癌的臨床病理分類與病理特征研究
楊 猛,戴殿祿,崔國忠,陳 亮,丁明劍
(河北省滄州市中心醫院,河北 滄州 061001)
三陰性與非三陰性乳腺癌的臨床病理分類與病理特征研究
楊 猛,戴殿祿,崔國忠,陳 亮,丁明劍
(河北省滄州市中心醫院,河北 滄州 061001)
目的 探討三陰性乳腺癌與非三陰性乳腺癌臨床病理分類與臨床病理特征的關系,并分析其對于個體病理特征與預后的價值。方法 回顧性分析417例乳腺癌患者病理資料,將乳腺癌腫瘤組織中雌激素受體(Estrogenreceptor,ER)、孕激素受體(Progestronereceptor,PR)和表皮生長因子受體(Humanepidermalgrowthfactorreceptor2,HER2)同時表達陰性定義為三陰性乳腺癌。并采用2檢驗和非參數檢驗進行統計學分析。結果 417例乳腺癌患者,發病患者中位就診時間30d(0~3600d),中位年齡50歲(25~83歲),平均腫瘤直徑2.02cm(0.3~6.5cm),平均淋巴結轉移數為4.0個(0~25個)。研究中ER陰性157例(37.7%),PR陰性198例(47.5%),HER2陰性193例(46.3%),三陰型55例(13.2%),非三陰型362例(86.8%),三陰型患者和非三陰型患者在發病時間、淋巴結轉移、乳頭浸潤、病理分型、TNM分期和病理組織分級中的分布比較差異均有統計學意義(P均<0.05);相關性分析顯示三陰性和非三陰性乳腺癌分型與發病時間、病理TNM分期、淋巴結轉移等因素呈顯著正相關,與腫瘤病理分級呈顯著負相關。結論 三陰型乳腺癌有其獨特的病理特征,其針對乳腺癌的精準的病理分類方法需要進一步研究。
乳腺腫瘤;免疫組織化學;病理;三陰性乳腺癌
乳腺癌是女性最常見的惡性腫瘤之一,僅次于子宮癌,發病率占全身各種惡性腫瘤的7%~10%,發病常與遺傳有關,主要發生于絕經前后。乳腺癌腫瘤組織雌激素受體(Estrogenreceptor,ER)、孕激素受體(ProgestronereceptorPR)和表皮生長因子受體(Humanepidermalgrowthfactorreceptor2,HER2)表達對預后的判斷及治療方案的選擇具有重要的指導意義。三陰性乳腺癌(triple-negativebreastcancer,TNBC)是指ER、PR、HER2均表達缺失的乳腺癌[1],其侵襲性強且不易早期診斷,與其他原發性乳腺癌亞型相比,缺乏治療靶點,內分泌治療及靶向治療無效,預后最差[2-3]。三陰性乳腺癌患者只有化療是有效的全身治療手段[4]。本研究針對我院2013年1月—2014年1月收治的417例乳腺癌患者的病理及臨床資料進行回顧性分析,以期為臨床個體化治療提供理論依據。
1 臨床資料
1.1 一般資料 回顧性分析上述時期我院收治的經手術后證實為乳腺癌的417例患者資料,均符合下列條件:①術后病理證實為原發的乳腺癌;②臨床病理資料完整,可進行TNM分期、組織分級及免疫組化檢查。免疫組織化學檢測ER陰性157例,PR陰性198例,HER2陰性193例;三陰型55例,非三陰型362例。
1.2 組織學評價 常規對乳腺癌術后病理組織進行免疫組織化學檢測ER、PR和HER2水平。ER及PR陽性定義為≥1%腫瘤細胞核內表達激素受體標記陽性;HER2呈()時為陽性:>10%的腫瘤細胞呈現強的完整的細胞膜著色;(-)/(+)陰性,()表示>10%的腫瘤細胞呈現弱至中等程度的完整的細胞膜著色,此時需行熒光原位雜交(FISH)確定[5]。判斷標準:HER2<1.8為陰性;HER2>2.0為陽性;HER-2介于1.8~2.0應增加計數細胞數或重復檢驗。熒光信號分布不均勻時,應當客觀評價HER2基因擴增異質性[6]。病理判定由3名病理科醫生分別進行評估。腫瘤TNM分期標準:參照第7版AJCCTNM分期進行[7]。病理組織學分級標準:采用改良Scarff-Bloom-Richardson分級系統(Nottingham方案),評估參數包括腫瘤腺管結構、細胞核多形性和核分裂數3個指標[8]。
1.3 統計學方法 應用SPSS18.0統計軟件進行數據分析,組間比較采用非參數檢驗和2檢驗,P<0.05為差異有統計學意義。
2 結 果
2.1 臨床及病理特征 417例乳腺癌患者中女415例,男2例。發病患者中位就診時間30d(0~3 600d),中位年齡50歲(25~83歲),平均腫瘤直徑2.02cm(0.3~6.5cm),平均腋窩淋巴結轉移數為3.90個(0~25個)。本研究中病理組織分類:浸潤性導管癌合并小葉癌36例(8.6%),浸潤性導管癌302例(72.4%),小葉癌26例(6.2%),導管內癌29例(7.0%),髓樣癌9例(2.2%)。乳頭浸潤的22例(5.3%),未浸潤的395例(94.7%)。病理分型:ER陰性157例(37.7%),PR陰性198例(47.5%),HER2陰性193例(46.3%);三陰型55例(13.2%),非三陰型362例(86.8%)。病理分級:浸潤型導管癌中Ⅰ~Ⅱ級281例(93.0%),Ⅲ級21例(7.0%);TNM分期:0期24例(5.8%),Ⅰ期158例(37.9%),Ⅱ期213例(51.1%),Ⅲ期29例(7.0%)。
2.2 病理組織學特征分布 發病時間、淋巴結轉移、乳頭浸潤、病理分型、TNM分期和病理組織分級等因素在三陰型患者和非三陰型患者中的分布均有明顯不同(P均<0.05);而發病年齡、是否絕經、發病部位、直徑等因素在三陰與非三陰型乳腺癌中的分布均無明顯不同(P均>0.05)。見表1。相關性分析顯示:三陰性和非三陰性乳腺癌分型與發病時間、病理TNM分期、淋巴結轉移等因素與呈顯著正相關(P均<0.05),與腫瘤病理分級呈顯著負相關(P<0.05)。見表2。
3 討 論
乳腺癌是臨床常見的惡性腫瘤, 其生物學特征具有高度異質性的特點,不同病理表現、分子生物學以及治療方案上存在很大的差別。其中NTBC約占所有乳腺癌的10%~17%[9-10]。目前,最好的分型方法是在基因水平對乳腺癌進行分子分型,但是由于昂貴的費用和較高的技術,使得無法推廣。臨床病理分類簡便、實用,在臨床廣泛應用。NTBC是指ER、PR和HER-2均陰性,ER和PR的陽性表達提示腫瘤分化較好、增生指數低、復發轉移率低,內分泌治療敏感,預后好;但是HER2高表達提示細胞核增殖能力強、侵襲和轉移能力強的特點。近年來的研究證明3個受體陰性是乳腺癌預后不良的可靠指標[11]。
國內研究表明NTBC有年齡較輕、乳腺癌家族史、臨床分期晚、淋巴結轉移率高、腫瘤直徑大、組織學分級高、易復發和遠處轉移、無病生存率和總生存率低等特點,然而年齡和淋巴結轉移對判斷預后有重要意義[12]。本研究NTBC患者發病時間、淋巴結轉移、乳頭浸潤、病理分型、TNM分期和病理組織分級等因素中的分布具有明顯不同,并且與發病時間、病理TNM分期、淋巴結轉移呈正相關,與病理分級呈負相關,提示這3種因素是影響乳腺癌患者預后的重要因素,是評估和治療關鍵參考指標。
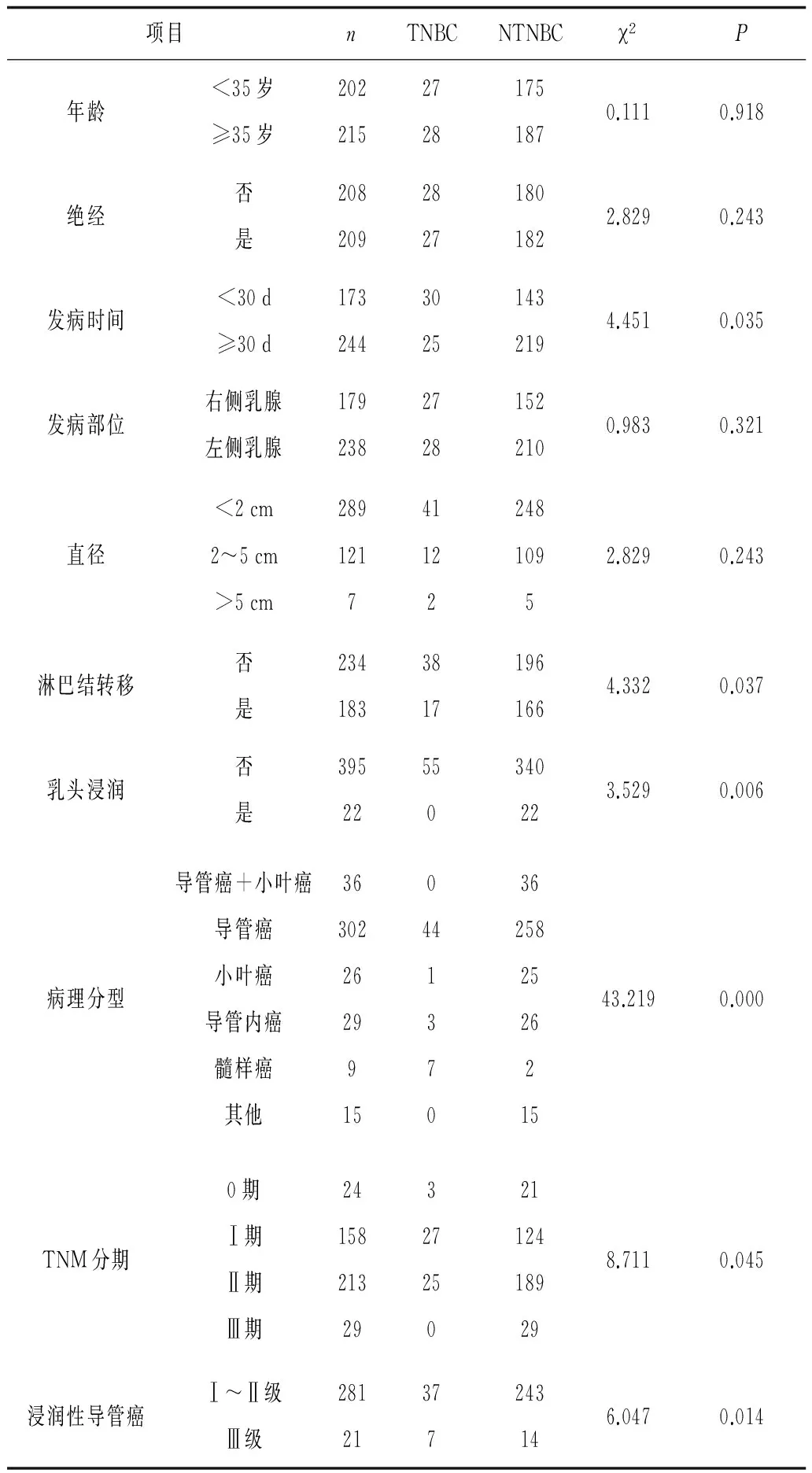
表1 三陰性與非三陰性乳腺癌臨床病理特征比較 例
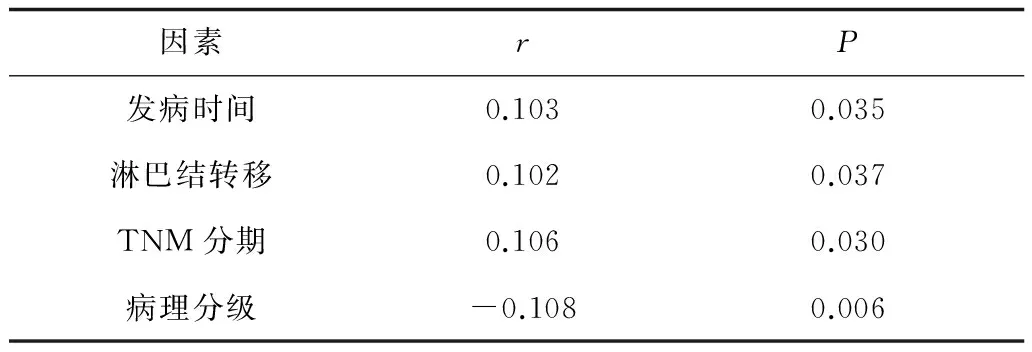
表2 三陰性與非三陰性乳腺癌臨床病理因素相關性分析
NTBC沒有明確的治療靶點,常用的分子靶向治療并非特異針對NTBC,其他治療包括針對表皮生長因子受體(EGFR)的單克隆抗體西妥昔單抗及多靶點的小分子EGFR1/2酪氨酸激酶抑制劑拉帕替尼等。Ki-67是檢測腫瘤細胞增殖活性可靠的指標之一[13-14],缺乏特異性,作為乳腺癌治療可靠的有利指標,有待進一步報道。目前,憑借免疫組化指標對乳腺癌進行精準的分類,并設計有力的治療方案,因影響因素多,需要進一步深入研究。
[1]ThikeAA,CheokPY,Jara-LazaroAR,etal.Triple-negativebreastcancer:clinic-pathologicalcharacteristicsandrelationshipwithbasal-likebreastcancer[J].ModPathol,2010,23(1):123-133
[2] 張毅,張穎,修海清,等. 三陰性乳腺癌TNM分期的臨床特點及影響預后的危險因素[J]. 中華乳腺病雜志,2012,6(2):168-177
[3]GoldhirschA,WoodWC,CoatesAS,etal.Strategiesforsubtypes-dealingwiththediversityofbreastcancer:highlightsoftheSt.GallenInternationalExpertConsensusonthePrimaryTherapyofEarlyBreastCancer[J].AnnOncol,2011,22(8):1736-1747
[4]WolffAC,HammondME,SchwartzJN,etal.SocietyofClinicalofAmericanOncology/CollegePathologistsguidelinerecommendationsforhumanfactorepidermalgrowthreceptorinbreast[J].ArchPatholLabMed,2007,131(1):18-43
[6]KayE,GradyA,MorganJM,etal.UseoftissuemicroarrayforinterlaboratoryvalidationofHER2immunocytochemicalandFISHtesting[J].JClinPathol,2004,57(11):1140-1144
[7]ComptonCC.Compton7theditionoftheAJCCcancermanualandtheCancer:thestagingfutureofTNM[J].AnnSurgOncol,2010,17(6):1471-1474
[8]ZhangR,ChenHuJ,WeiB,etal.ReproducibilityNottinghamofthemodificationoftheScarff-Bloom-RichardsonhistologicalgradingsystemandthecomplimentaryvalueofKi-67tothesystem[J].ChinMedJ,2013,123(15):1976-1982
[9]Reis-FilhoJS,TuttAN.Triplenegativetumours:acriticalreview[J].Histopathology,2008,52(1):108-118
[10] 歐江華,蔣威華,倪多,等. 新疆地區三陰性乳腺癌病理特征及預后分析[J]. 中國腫瘤臨床,2011,38(18):1159-1162
[11]SchwentnerL,WoltersR,KoretzK,etal.Triple-negativebreastcancer:theimpactofguideline-adherentadjuvanttreatmentonsurvival-aretrospectivemulti-centrecohortstudy[J].BreastCancerResTreat,2012,132(3):1073-1080
[12] 邱鏡丹,馬振海,馬金輝,等. 三陰與非三陰性乳腺癌臨床病理特征與預后比較[J]. 中華內分泌外科雜志,2012,6(5):313-317
[13]JonesRL,SalterJ,AhemR,etal.PrognosticsignificanceofKi67beforeandafterneoadjuvantchemotherapyinbreastcancer[J].BreastCancerResTreat,2009,116(1):53-68
[14]VialeG,Giobbie-HurderA,ReganMM,etal.PrognosticandpredictivevalueofcentrallyreviewedKi-67labelingindexinpostmenopausalwomenwithendocrine-responsivebreastcancer:resultsfromBreastInternationalGroupTrial1-98comparingadjuvanttamoxifenwithletrozole[J].JClinOncol,2008,26(34):5569-5575
10.3969/j.issn.1008-8849.2015.24.037
R737.9
B
1008-8849(2015)24-2713-03
2014-07-05

