嗜血桿菌屬CODEHOP PCR檢測方法的建立及在樹鼩檢測中的應用
邢 進,馮育芳,岳秉飛,賀爭鳴,孫曉梅,代解杰
嗜血桿菌屬CODEHOP PCR檢測方法的建立及在樹鼩檢測中的應用
邢 進1,馮育芳1,岳秉飛1,賀爭鳴1,孫曉梅2,代解杰2
目的 建立樹鼩中嗜血桿菌的CODEHOP PCR快速檢測方法,為樹鼩微生物質量控制提供參考。方法 應用CODEHOP在線簡并引物設計工具,比對NCBI中6株嗜血桿菌的外膜蛋白序列設計簡并引物。通過4株嗜血桿菌標準菌株和24株它屬菌株進行特異性和敏感性評價,將建立CODEHOP PCR檢測方法,應用于樹鼩嗜血桿菌的檢測。結果 簡并引物HF1/HR8和HF3/HR3擴增標準菌株副雞嗜血桿菌(ATCC 29545)、溶血嗜血桿菌(ATCC 33390)、流感嗜血桿菌(ATCC 33391)、副流感嗜血桿菌(ATCC 33392)的目的片段分別為506 bp~535 bp和344 bp~390 bp,經測序和NCBI Blast比對,結果準確。兩對引物組合,能夠有效的區分嗜血桿菌屬菌株與它屬菌株,檢測限最低可達2.1 pg/μL。在受試的野生樹鼩呼吸道樣本中嗜血桿菌陽性率為33.3%(20/60)。結論 所建立的方法具有較好的特異性和敏感性,操作簡便,能夠用于動物樣品的嗜血桿菌檢測。
嗜血桿菌;CODEHOP PCR;樹鼩;簡并引物;檢測
Supported by the Standardization of Experimental Tree Shrews and the Integrated Demonstration of Creation and Application of Major Human Disease Models of Tree Shrews (No. 2014BAI01B01) Corresponding author: He Zheng-ming, Email: zhengminghe57@163.com
嗜血桿菌屬(Haemophilus.spp)是一群革蘭氏陰性,不抗酸、不運動、無芽孢的短桿菌或球桿菌,絕大部分存在于人和動物的呼吸道粘膜[1]。引起人感染的主要有流感嗜血桿菌、副流感嗜血桿菌、溶血嗜血桿菌、副溶血嗜血桿菌、杜克雷嗜血桿菌等[2],其中流感嗜血桿菌的致病性最強,能夠引起人,特別是嬰幼兒的腦膜炎、呼吸道和生殖道感染[3]。副流感嗜血桿菌能夠引起肺炎和細菌性心內膜炎,杜克雷嗜血桿菌能夠引起軟性下疳等[4]。引起動物疾病的嗜血桿菌中,副豬嗜血桿菌能夠引起豬格拉澤氏病[5],副雞嗜血桿菌能夠引起傳染性鼻炎,引發急性呼吸道疾病、關節炎及敗血癥[6]。如果能夠同時檢測嗜血桿菌的多種菌株,對于有效的防止疾病和感染的發生具有重要意義。但是某些動物源性的嗜血桿菌會轉變為巴斯德菌或放線桿菌[4],某些嗜血桿菌的培養條件苛刻,需要X、V因子和二氧化碳。因此在檢測中,將嗜血桿菌與巴斯德菌科的其它菌屬相區別十分困難。
共有序列簡并雜合寡核苷酸引物(Consensus Degenerate Hybrid Oligonucleotide Primers,CODEHOP)PCR方法能夠擴增相同功能的蛋白基因。該方法通過網絡數據庫(http://blocks.fhcrc.org/codehop.html),將已知的不同微生物的同源蛋白進行比對,設計出高擴增效率的簡并引物,實現對同源目的蛋白基因的擴增[7-8],解決了某些菌株沒有已知蛋白編碼基因序列的限制。
樹鼩作為一種新型的實驗動物,已經廣泛的應用于微生物感染模型、呼吸系統、內分泌、神經系統疾病和腫瘤等方面的研究[9]。本研究旨在利用CODEOP PCR檢測樹鼩中嗜血桿菌的攜帶情況,為樹鼩的進一步實驗動物化和微生物質量控制奠定基礎。
1 材料與方法
1.1 菌株 副雞嗜血桿菌(ATCC 29545),溶血嗜血桿菌(ATCC 33390),流感嗜血桿菌(ATCC 33391)副流感嗜血桿菌(ATCC 33392)等4株嗜血桿菌購自美國標準生物品收藏中心(ATCC)。另有24株對照菌株用于檢測方法的特異性測定,見表2。
1.2 設備及試劑 上海安亭WGP-600恒溫培養箱,德國Hettich22R離心機、美國Thermo Nanodrop超微量分光光度計、美國ABI veriti96 PCR儀,美國Bio-Rad Powerpac HC電泳儀,美國Kodak GL212pro紫外凝膠成像系統。DNA提取試劑盒購自德國Qiagen公司,PCR試劑購自寶生物工程(大連)有限公司。
1.3 引物設計 將流感嗜血桿菌(GenBank登錄號AAF97580.1)、副豬嗜血桿菌(GenBank登錄號ADJ38784.1)、副溶血嗜血桿菌(GenBank登錄號WP_005706527.1)、副流感嗜血桿菌(GenBank登錄號WP_014064876.1)、溶血嗜血桿菌(GenBank登錄號EIJ73911.1)和杜克雷嗜血桿菌(GenBank登錄號EIJ73911.1)的外膜蛋白(OMP)氨基酸序列在CODEHOP在線引物設計工具中進行比對,并設計簡并引物[10]。在所得引物中選擇分數較高,簡并度低的引物,由生工生物工程(上海)股份有限公司合成,見表1。共選擇了5條上游引物(HF1~HF5)和8條下游引物(HR1~HR8)進行配對組合,根據特異性、敏感性測定,確定最佳引物對。
1.4 樣本來源及DNA提取 受試樣品來自昆明郊區采集的60只滇西亞種野生樹鼩咽拭子及氣管。用Qiagen DNA提取試劑盒(Cat.No.69504)提取上述樣品的DNA,提取步驟根據試劑盒說明進行。本研究中所用菌株的DNA同樣按此方法提取。
1.5 PCR反應體系和條件 PCR反應體系定為20 μL,其中10×PCR Buffer 2 μL,10 mmol/L dNTP Mix 1.6 μL,5 U/μL Taq HS DNA聚合酶0.2 μL,10 μmol/L上下游引物各0.5 μL,模板DNA 0.5 μL,無核酸酶水14.7 μL。擴增條件經過退火溫度和反應時間優化后確定為如下反應條件:94 ℃預變性3 min;94℃變性30 s,54℃退火30 s,73 ℃延伸45 s,35個循環;最后72 ℃延伸7 min。PCR產物用1%瓊脂糖在0.5%TBE中,以120V/60 mA電泳40 min。擴增產物經瓊脂糖電泳后送北京擎科新業生物技術有限公司測序。
1.6 特異性測定 將所選上下游簡并引物兩兩配對組合,對4株嗜血桿菌及24株它屬菌株基因組DNA進行擴增,檢測各引物對的特異性優劣。
1.7 敏感性測定 將4株嗜血桿菌的DNA分別做10倍系列稀釋至10-6。用上述PCR方法進行擴增,檢測該方法的最低檢測限。
2 結 果
2.1 檢測方法的建立和特異性 經引物的配對組合,兩組引物HF1/HR8和HF3/HR3均能對4株嗜血桿菌擴增出單一的目的條帶,引物對HF1/HR8擴增4株嗜血桿菌標準菌株目的片段大小分別為:流感嗜血桿菌535 bp,副雞嗜血桿菌506 bp,副流感嗜血桿菌529 bp,溶血嗜血桿菌520 bp。引物對HF3/HR3擴增4株嗜血桿菌標準菌株目的片段大小分別為:流感嗜血桿菌345 bp,副雞嗜血桿菌368 bp,副流感嗜血桿菌344 bp,溶血嗜血桿菌390 bp。目的片段經測序,流感嗜血桿菌ATCC33391的產物片段經Blast比對(http://blast.ncbi.nlm.nih.gov/Blast.cgi),結果準確無誤,與GenBank中序列(登錄號為LN831035.1)相似度為99%。其他3株標準菌株的產物片段經比對,未得出高相似度序列結果。
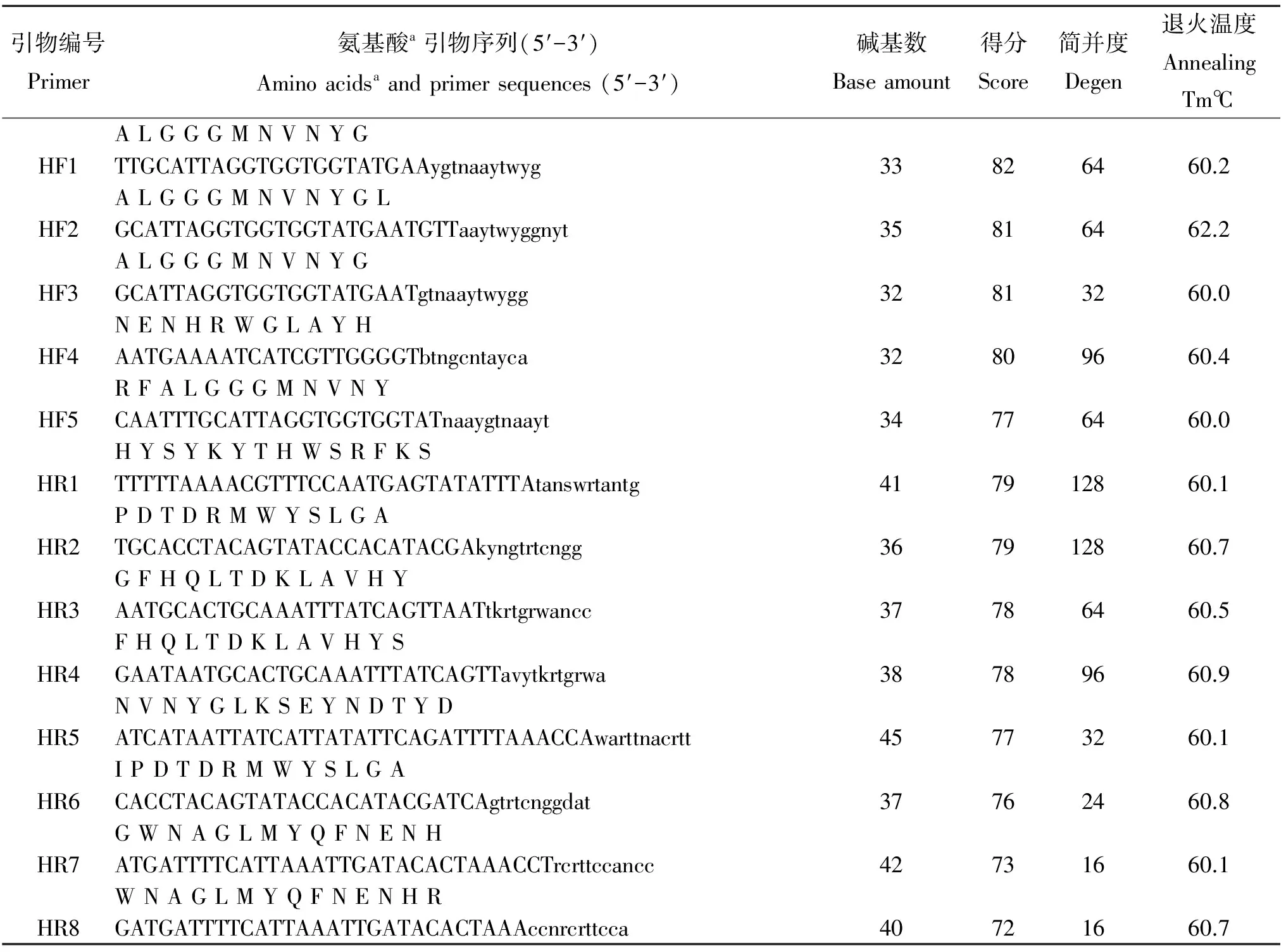
表1 本研究中的CODEHOP引物序列及其編碼氨基酸序列Tab.1 Degenerate primers designed by CODEHOP used in this study
注:a, 下游引物HR1~HR8的堿基序列與氨基酸序列相反。
Note: a, the sequence of downstream primers HR1-HR8 with the animo acids are reverse.
2.2 所有配對引物擴增其它參考菌株,沒有引物對能夠實現對嗜血桿菌完全的特異性擴增。其中引物對HF1/HR8和HF3/HR3擴增的交叉反應最少,HF1/HR8與4株它屬菌株有交叉反應,包括多殺巴斯德桿菌、達科馬巴斯德桿菌、肉芽腫巴斯德桿菌和小鼠放線桿菌。HF3/HR3與產氣巴斯德桿菌和鳥巴斯德桿菌存在交叉反應。因此利用兩對引物擴增結果相組合的形式能夠實現對嗜血桿菌的區分和檢測,結果見表2。

1. 100 bp DNA Marker; 2-6. HF1/HR8擴增副雞嗜血桿菌ATCC29545、溶血嗜血桿菌ATCC33390、流感嗜血桿菌ATCC33391和副流感嗜血桿菌ATCC33392的目的片段; 7-11. HF3/HR3擴增副雞嗜血桿菌ATCC29545、溶血嗜血桿菌ATCC33390、流感嗜血桿菌ATCC33391和副流感嗜血桿菌ATCC33392的目的片段.
1: 100 bp DNA Marker; 2-6: Target fragments of HF1/HR8 amplifiedH.paragallinarumATCC29545,H.haemolyticusATCC33390,H.influenzaeATCC33391andH.parainfluenzaeATCC33392; 7-11: Target fragments of HF3/HR3 amplifiedH.paragallinarumATCC2954,H.haemolyticusATCC33390,H.influenzaeATCC33391 andH.parainfluenzaeATCC33392.
圖1 HF1/HR8和HF3/HR3擴增嗜血桿菌陽性目的片段
Fig.1 Positive fragments of HF1/HR8 and HF3/HR3 primers amplified 4 Haemophilus strains respectively

1. 100 bp DNA Marker; 2-25. 引物對HF1/HR8擴增它屬參考菌株結果,依次為嗜肺巴斯德桿菌ATCC12555、ATCC35149、多殺巴斯德桿菌ATCC43137、支氣管鮑特桿菌ATCC19395、產氣巴斯德桿菌ATCC27883、鳥巴斯德桿菌ATCC29546、溶血曼海姆桿菌ATCC33369、達科馬巴斯德桿菌ATCC43325、肉芽腫巴斯德桿菌ATCC49244、糞產堿桿菌ATCC8750、雞白痢沙門氏菌CMCC50047、奇異變形桿菌DJ150030、蠟樣芽胞桿菌CMCC63301、綠膿桿菌ATCC47085、假結核耶爾森氏菌CMCC53518、念珠狀鏈桿菌ATCC14647、鼠棒狀桿菌CMCC65013、肺炎鏈球菌CMCC36001、乙型溶血性鏈球菌CMCC32210、大腸桿菌CMCC44110、泰澤氏菌RJ株、肺支原體PG34株、 痢疾志賀菌CMCC51252、小鼠放線桿菌ATCC49577.
1: 100 bp DNA Marker; 2-25: Results of primer pair HF1/HR8 amplified other species strains. From lanes 2 to 25, in order, isP.pneumotropicabiotypeHeyl ATCC12555,P.pneumotropicabiotypeJawetzATCC35149,P.multocidaATCC43137,B.bronchisepticaATCC19395,P.aerogenesATCC27883,P.aviumATCC29546,M.haemolyticaATCC33369,P.dagmatisATCC43325,M.granulomatisATCC49244,A.faecalisATCC8750,S.pullorumCMCC50047,P.mirabilisDJ150030,B.cereusCMCC63301,P.aeruginosaATCC47085,Y.pseudotuberculosisCMCC53518,S.moniliformisATCC14647,C.KutscheriCMCC65013,S.pneumoniaeCMCC36001,S.pyogenesCMCC32210,E.coliCMCC44110,C.piliformeStrain RJ,M.pulmonisStrainPG34,S.dysenteriaeCMCC51252,A.murisATCC49577.
圖2 引物對HF1/HR8擴增參考菌株結果
Fig.2 Result of HF1/HR8 primers amplified reference strains

1. 100bp DNA Marker; 2-25. 引物對HF3/HR3擴增它屬參考菌株結果,依次為嗜肺巴斯德桿菌ATCC12555、ATCC35149、多殺巴斯德桿菌ATCC43137、支氣管鮑特桿菌ATCC19395、產氣巴斯德桿菌ATCC27883、鳥巴斯德桿菌ATCC29546、溶血曼海姆桿菌ATCC33369、達科馬巴斯德桿菌ATCC43325、肉芽腫巴斯德桿菌ATCC49244、糞產堿桿菌ATCC8750、雞白痢沙門氏菌CMCC50047、奇異變形桿菌DJ150030、蠟樣芽胞桿菌CMCC63301、綠膿桿菌ATCC47085、假結核耶爾森氏菌CMCC53518、念珠狀鏈桿菌ATCC14647、鼠棒狀桿菌CMCC65013、肺炎鏈球菌CMCC36001、乙型溶血性鏈球菌CMCC32210、大腸桿菌CMCC44110、泰澤氏菌RJ株、肺支原體PG34株、 痢疾志賀菌CMCC51252、小鼠放線桿菌ATCC49577.
1: 100 bp DNA Marker; 2-25: Results of primer pair HF3/HR3 amplified other species strains. From lanes 2 to 25, in order, isP.pneumotropicabiotypeHeylATCC12555,P.pneumotropicabiotypeJawetzATCC35149,P.multocidaATCC43137,B.bronchisepticaATCC19395,P.aerogenesATCC27883,P.aviumATCC29546,M.haemolyticaATCC33369,P.dagmatisATCC43325,M.granulomatisATCC49244,A.faecalisATCC8750,S.pullorumCMCC50047,P.mirabilisDJ150030,B.cereusCMCC63301,P.aeruginosaATCC47085,Y.pseudotuberculosisCMCC53518,S.moniliformisATCC14647,C.KutscheriCMCC65013,S.pneumoniaeCMCC36001,S.pyogenesCMCC32210, E.coli CMCC44110,C.piliformeStrain RJ,M.pulmonisStrain PG34,S.dysenteriaeCMCC51252, A.muris ATCC49577.
圖3 引物對HF3/HR3擴增參考菌株結果
Fig.3 Result of HF3/HR3 primers amplified reference strains

表2 引物對HF1/HR8和HF3/HR3擴增參考菌株的結果Tab.2 Result of HF1/HR8 and HF3/HR3 primers amplified reference strains

表2(續表1)

表2(續表2)
注:“+”表示擴出目的片段,“—”表示未擴出目的片段。
Note: Symbols “+”, PCR result is positive; “—”, negative. b -- ATCC, American Type Culture Collection;CMCC, National Center for Medical Culture Collection.

1. 100 bp DNA marker;2-8. 由左至右為引物HF1/HR8擴增副雞嗜血桿菌、溶血嗜血桿菌、流感嗜血桿菌和副流感嗜血桿菌1~10-6梯度DNA模板的敏感性;9. 空白對照。
1. 100bp DNA marker; 2-8. Sensitivity results of HF1/ HR8 primers amplified a series 10-fold dilutions of Haemophilus genomic DNA from 1 to 10-6in four picture from left to right, in order, areH.paragallinarum,H.haemolyticus,H.influenzaandH.parainfluenzae; 9. Blank control.
圖4 HF1/HR8引物對擴增4株嗜血桿菌的敏感性
Fig.4 Sensitivity results of HF1/ HR8 primers amplified 4Haemophilusstrains

1. 100 bp DNA marker;2-8. 由左至右為引物HF3/HR3擴增副雞嗜血桿菌、溶血嗜血桿菌、流感嗜血桿菌和副流感嗜血桿菌1~10-6梯度DNA模板的敏感性;9.空白對照。
1. 100 bp DNA marker; 2-8. Sensitivity results of HF3/ HR3 primers amplified a series 10-fold dilutions of Haemophilus genomic DNA from 1 to 10-6in four picture from left to right, in order, areH.paragallinarum,H.haemolyticus,H.influenzaandH.parainfluenzae; 9. Blank control.
圖5 HF3/HR3引物對擴增4株嗜血桿菌的敏感性
Fig.5 Sensitivity results of HF3/ HR3 primers amplified 4Haemophilusstrains
2.3 敏感性 本研究中所提取的4株嗜血桿菌(副雞嗜血桿菌、溶血嗜血桿菌、流感嗜血桿菌和副流感嗜血桿菌)的初始濃度不同,分別為56 ng/μL,210 ng/μL,73 ng/μL,67 ng/μL。由此所得HF1/HR8引物對擴增4株嗜血桿菌的檢測限為0.56 ng/μL,2.1 pg/μL,0.73 ng/μL,67 pg/μL;HF3/HR3引物對擴增4株嗜血桿菌的檢測限為0.56 ng/μL,0.21 ng/μL,0.73 ng/μL,0.67 ng/μL。
2.4 樣品檢測 利用所建立的CODEHOP簡并引物PCR檢測方法,對60份野生樹鼩呼吸道樣品DNA進行檢測。結果顯示HF1/HR8 單獨擴增陽性的有46份,HF3/HR3單獨擴增為陽性的有23份。HF1/HR8和HF3/HR3兩組引物對擴增片段均為陽性的有20份,即在受試的60份樹鼩呼吸道樣品中,嗜血桿菌的陽性率為33.3%。
3 討 論
本研究利用CODEHOP簡并引物PCR方法,實現了對嗜血桿菌OMP基因的有效擴增。雖然所設計的簡并引物中,沒有單獨的引物能實現對嗜血桿菌的檢測。但將HF1/HR8和HF3/HR3兩組引物相結合,能夠區分巴斯德菌科中的交叉菌株,如多殺巴斯德桿菌、產氣巴斯德桿菌、小鼠放線桿菌等,可有效的識別嗜血桿菌的存在。本方法的最低檢測限根據嗜血桿菌菌株的不同而有所區別,HF1/HR8引物的檢測限為2.1 pg/μL~0.73 ng/μL,HF3/HR3引物的檢測限可達0.5 ng/μL。
所建立的CODEHOP PCR方法對60份野生樹鼩呼吸道樣品的檢測結果陽性率為33.3%(20/60),此前對同一片樣品,采用培養法檢測出4株溶血嗜血桿菌,陽性率為6.7%(4/60)[11]。用SPSS19.0進行配對卡方檢驗,兩種方法的結果差異有統計學意義(χ2=8.571,P=0.003<0.01)。目的片段進一步進行測序驗證,發現能夠獲得Blast比對結果的均為流感嗜血桿菌,其它產物均未能獲得比對結果,與標準菌株目的片段的比對結果相同。表明GenBank數據庫中還未收錄這幾株嗜血桿菌的OMP編碼序列。在受試的標準菌株中,除流感嗜血桿菌外,其它3株菌的OMP目的片段同樣未獲得序列比對結果,我們已將其基因序列提交至GenBank。本方法具有很好的特異性和穩定性,敏感性高,能夠快速篩查樣品中的嗜血桿菌。對樹鼩這類新型實驗動物的微生物質量控制方面具有良好的應用前景,在保障人類疾病動物模型的研究中具有重要的意義。
[1]Kilian M. Haemophilus[M]. In: Murray PR, Baron EJ, Jorgensen JH, et al. Manual of clinical microbiology 8th ed,(vol1). Washington DC: ASM, 2003, 623-634.
[2]Yang ZS, Fang H. Human and animal pathogenic bacteriology[M]. Shijiazhuang: Hebei Science and Technology Press, 2003:705-716.(in Chinese) 楊正時,房海. 人及動物病原細菌學[M]. 石家莊:河北科技出版社,2003:705-716.
[3]Bruant G,Gousset N,Quentin R, et al. Fimbrial ghf gene cluster of genital strains ofHaemophilusspp[J]. Infect Immun,2002, 70(10): 5438-5445. DOI: 10.1128/IAI.70.10.5438-5445.2002.
[4]Tian GZ, Zhang LJ, Wang XL, et al. Rapid detection ofHaemophilusinfluenzaeandHaemophilusparainfluenzaein nasopharyngeal swabs by multiplex PCR[J]. Biomed Environ Sci, 2012, 25(3): 367-371. DOI: 10.3967/0895 3988.2012.03.016
[5]Nedbalcova K, Satran P, Jaglic Z, et al.Haemophilusparasuisand Glasser’s disease in pigs: a review[J]. Veterinarni Medicina, 2006, 51(5): 168-179.
[6]Blackall P. Infectious coryza: overview of the disease and new diagnostic options[J]. Clin Microbiol Rev, 1999, 12(4): 627-632. DOI: 10.1016/S0006-8993(01)02897-9
[7]Rose TM, Schultz ER, Henikoff JG, et al. Consensus-degenerate hybrid oligonucleotide primers for amplification of distantly related sequences[J]. Nucleic Acids Res, 1998, 26(7): 1628-1635.
[8]Rose TM, Henikoff JG, Henikoff S. CODEHOP (COnsensus-DEgenerate Hybrid Oligonucleotide Primer) PCR primer design[J]. Nucleic Acids Res, 2003, 31(13): 3763-3766. DOI: 10.1093/nar/gkg524
[9]Huang XY, Xu J, Sun XM, et al. Development of application of tree shrew in human disease animal models research[J]. Lab Anim Sci, 2013, 30(2): 59-64. (in Chinese) 黃曉燕,徐娟,孫曉梅,等. 樹鼩在人類疾病動物模型中應用研究進展[J]. 實驗動物科學,2013,30(2):59-64.
[10]Staheli JP, Boyce R, Kovarik D, et al. CODEHOP PCR and CODEHOP PCR primer design[J]. Methods Mol Biol, 2011, 687: 57-73. DOI:10.1007/978-1-60761-944-4-5
[11]Xing J, Feng YF, Fu R, et al. The survey of culturable bacteria and fungi in wild tree shrews[J]. Lab Anim Sci, 2012, 29(3): 34-38. (in Chinese) 邢進,馮育芳,付瑞,等.野生樹鼩可培養細菌和真菌攜帶情況的調查[J]. 實驗動物科學,2012,29(3):34-38.
Establishment and application of CODEHOP PCR assay for detection ofHaemophilusspp. in tree shrews
XING Jin1,FENG Yu-fang1,YUE Bing-fei1,HE Zheng-ming1,SUN Xiao-mei2,DAI Jie-jie2
(1.NationalInstituteofFoodandDrugControl,InstituteofLaboratoryAnimalResources,Beijing100050,China;2.InstituteofMedicalBiology,ChineseAcademyofMedicineSciencesandPekingUnionMedicalCollege,Kunming650118,China)
We established a rapid detection method ofHaemophilusspp. in tree shrews, and provided a reference for tree shrews microbiological quality control. According to the outer membrane protein (OMP) multiple alignments of 6 differentHaemophilusspp. published in NCBI, a few pairs of degenerate primers were designed by CODEHOP designer online. Then, the specificity and sensitivity of designed CODEHOPs were evaluated by 4 standardHaemophilusstrains and 24 other genus strains. AndHaemophilusspp. in the tree shrews was detected by established CODEHOP PCR method. Results showed that degenerate primers HF-1/HR-8 and HF-3/HR3 could produce target fragments of 506 - 535 bp and 344 - 390 bp by amplifyingH.paragallinarum(ATCC29545),H.haemolyticus(ATCC33390),H.influenzae(ATCC33391),H.parainfluenzae(ATCC33392), respectively. Amplified nucleotides were sequenced and Blast in NCBI, which proved that results were accurate. It can effectively distinguishHaemophilusspp. and other genus together with two pairs of primers. The lowest detection limit of this method was 2.1 pg/uL. The 60 respiratory specimens of wild tree shrews were tested forHaemophilusspp. that positive rate was 20/60. In conclusion, the CODEHOP PCR performs well for detectionHaemophilusspp. in animal clinical specimens. It is easy to operate, with good specificity and sensitivity, and has practical application value.
Haemophilusspp.; CODEHOP PCR; tree shrew; degenerate primer; detection
國家科技支撐計劃項目(No.2014BAI01B01)資助
賀爭鳴,Email:zhengminghe57@163.com
1.中國食品藥品檢定研究院實驗動物資源研究所,北京 100050; 2.中國醫學科學院/北京協和醫學院醫學生物學研究所,昆明 650118
10.3969/j.issn.1002-2694.2015.11.002
R378
A
1002-2694(2015)11-0994-07
2015-05-22;
2015-07-16

