環介導等溫擴增技術及其在病原生物檢測中的應用
黃枝妙(綜述),翁育偉(審校)
環介導等溫擴增技術及其在病原生物檢測中的應用
黃枝妙(綜述),翁育偉(審校)
環介導等溫擴增(LAMP)技術是近年來發展起來的一種新型核酸擴增技術,具有操作簡便、快速、特異性高、靈敏性高等特點,自2000年開發以來,在短短的十幾年內被廣泛應用于細菌、病毒和寄生蟲等病原生物的檢測,在即時檢驗和基層實驗室推廣中有重要意義。
環介導等溫擴增;病原生物;檢測
病原生物的檢測有傳統分離培養、血清學檢測和核酸檢測等。傳統分離培養方法耗時長而且易出現污染和漏檢現象;血清學檢測方法會出現非特異性交叉反應,造成判斷困難,且在疾病較早期易出現假陰性;相比之下,以病原體核酸靶序列擴增為基礎的核酸檢測方法不但所需時間短而且敏感性、特異性強,已被廣泛應用于臨床檢驗醫學和新發傳染病檢測等領域。核酸擴增技術主要分為以常規PCR為基礎的變溫擴增以及等溫擴增兩大類。其中變溫擴增技術需要經過變性、退火、延伸等步驟多次循環,在此過程中反復升溫降溫,不但對儀器要求比較高,而且反應耗時較長,不利于節省時間成本。等溫擴增技術所需溫度恒定,利用水浴或金屬浴就可以實現,所需時間短。等溫擴增技術包括很多種:依賴于核酸序列的擴增技術(nucleic acid sequence-based amplification,NASBA)[1]、滾環擴增技術(rolling circle amplification,RCA)[2]、鏈替代擴增技術(strand displacement amplification,SDA)[3]和環介導等溫擴增技術(loop mediated isothermal amplification,LAMP)[4]等。其中,近些年來使用比較廣泛、發展比較快的是環介導等溫擴增,該技術操作簡便、快速、特異性高、靈敏性高,在短短十幾年內被廣泛應用于細菌、病毒、寄生蟲等病原生物的檢測,在即時檢驗和基層實驗室推廣中有重要意義。
1 LAMP技術介紹
1.1 LAMP技術原理 環介導等溫擴增技術是由日本的Notomi等[4]于2000年開發的一種新型核酸擴增技術,該技術使用了一種特殊的鏈置換型DNA聚合酶(Bst-DNA polymerase),該酶能夠在恒溫(60~65℃)條件下以雙鏈DNA中的一條鏈為模板合成新鏈,并將另外一條鏈替換掉。LAMP技術針對靶基因的六個區域設計兩條內引物和兩條外引物,可在15min~60min內對目的基因實現109~1010倍的擴增,如果同時采用兩條環狀引物,還可以促進目的片段的擴增,大大提高反應速度[5]。LAMP技術針對6個不同區域設計的4條特殊引物,分別為上游外引物F3、上游內引物FIP、下游外引物B3和下游內引物BIP,其中,內引物FIP包含F1c和F2,兩者可以直接相連或者以TTTT連接;內引物BIP包含B1c和B2,兩者可以直接相連或者以TTTT連接。
LAMP擴增過程主要分為兩個階段:起始階段和擴增循環階段。
起始階段:在LAMP擴增體系中,由于內引物的Tm值和濃度都大于外引物,所以內引物會先于外引物結合到模板上并延伸產生子鏈,之后外引物結合到模板,并通過子鏈的延伸將內引物鏈置換下來。經過FIP (F1c+F2)、F3、BIP (B1c+B2)、B3四個引物先后作用,最終被置換出的互補鏈結構為3′-F1-F2c-F1c……B1-B2-B1c-5′,其中F1和F1c互補,B1c和B1互補,形成兩端環狀的啞鈴狀模板結構,該結構是LAMP基因擴增循環的起始結構(見圖1)。
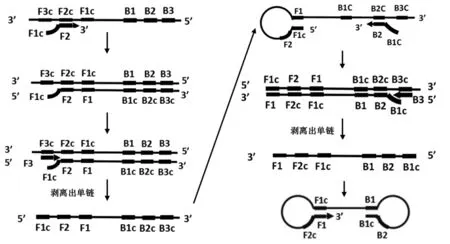
圖1 起始階段Fig.1 Starting material producing step
擴增循環階段:在這一階段中外引物不再起作用,內引物繼續引導鏈置換延伸。啞鈴狀結構以3′末端的F1區段為起點,以自身為模板,進行DNA合成延伸形成莖環狀結構,FIP(F1c+F2)中的F2區與莖環處的F2c區結合,開始鏈置換合成,解離出的單鏈核酸上也會形成環狀結構,迅速以3′末端的B1區段為起點,以自身為模板,進行DNA合成延伸及鏈置換,結果形成長短不一的2條新莖環狀結構的DNA,然后BIP(B1c+B2)引物上的B2區與其雜交,啟動新一輪擴增。每進行一次擴增產物DNA長度增加一倍,擴增的最后產物是具有不同個數莖環結構、不同長度DNA的混合物(見圖2)。
1.2 LAMP引物設計原則 LAMP是通過兩對引物對6個不同區域的識別進行擴增的,因此對引物設計要求比較高。影響LAMP引物設計的因素主要有Tm值、引物末端穩定性、GC含量、二級結構和引物間距。(1)Tm值采用Nearest-Neighbor算法,F1c和B1c的Tm值約65℃(64 ℃~66 ℃),F2、B2、F3和B3的Tm值約60 ℃(59 ℃~61 ℃),環引物的Tm值約65℃(64 ℃~66 ℃);(2)引物末端做為DNA合成的起始位點,需要有一定的穩定性,F2/B2,F3/B3和LF/LB的3′端以及F1c/B1c的5′端的自由能要≤-4 kcal/mol;(3)引物的GC含量要控制在40%~65%之間,以50%~60%為最佳;(4)設計引物時要避免二級結構產生,為了防止引物二聚體形成還要確保3′端不與其他序列互補并極力避免AT富集;(5)LAMP的擴增區域為F2~B2區段,最好在130 bp~200 bp之間,過長或過短都會影響擴增效率,最長300 bp,不可超過500 bp,否則會嚴重影響擴增效率。最理想的引物間距是:F2的5′端和B2的5′端相距120~160 bp,F2的5′端與F1c的3′端(B2的5′端與B1c的3′端)相距40~60 bp,F3的3′端和F2的5′端(B3的3′端和B2的5′端)相距0~60 bp。
目前,已經有針對LAMP引物設計的在線軟件出現。試驗者只要根據需要選擇合適的目的基因,在NCBI等數據庫中檢索出目的基因核苷酸序列,提交到Primer-Explorer V4(http://primerexplorer.jp/e/)設計相應的LAMP引物,然后通過Primer 5.0或oligo 7等軟件進行分析,確保引物之間無二聚體形成,最后再通過BLAST檢驗引物的特異性。
1.3 LAMP反應體系 LAMP反應體系:兩對內外引物、dNTP、甜菜堿、Tris-HCl(pH 8.8)、KCl、(NH4)2SO4、MgSO4、Triton X-100、模板、Bst-DNA聚合酶。體系中會對LAMP反應結果產生影響的幾個比較重要的因素有:(1)Bst-DNA聚合酶:具有鏈置換活性,在延伸新鏈的同時可以將下游舊鏈剝離。(2)內外引物濃度比例:內外引物濃度比對LAMP擴增體系影響重大,因此,除了引物Tm差異外,內引物的濃度要大于外引物濃度,這樣才能先于外引物結合到模板上。一般情況下外引物和內引物的濃度比在1/4~1/10之間。(3)甜菜堿濃度:甜菜堿可以使雙鏈DNA處于解鏈的動態平衡中,從而提高反應的擴增效率。(4)鎂離子濃度:鎂離子濃度太低會降低聚合酶活性,影響反應的進行,濃度太高又會降低反應的特異性。因此,反應必須對鎂離子濃度進行優化。(5)dNTP濃度:dNTP是核酸合成的底物,濃度低,底物不足,影響反應進行,濃度過高,過量的dNTP會與鎂離子螯合,影響酶活性。
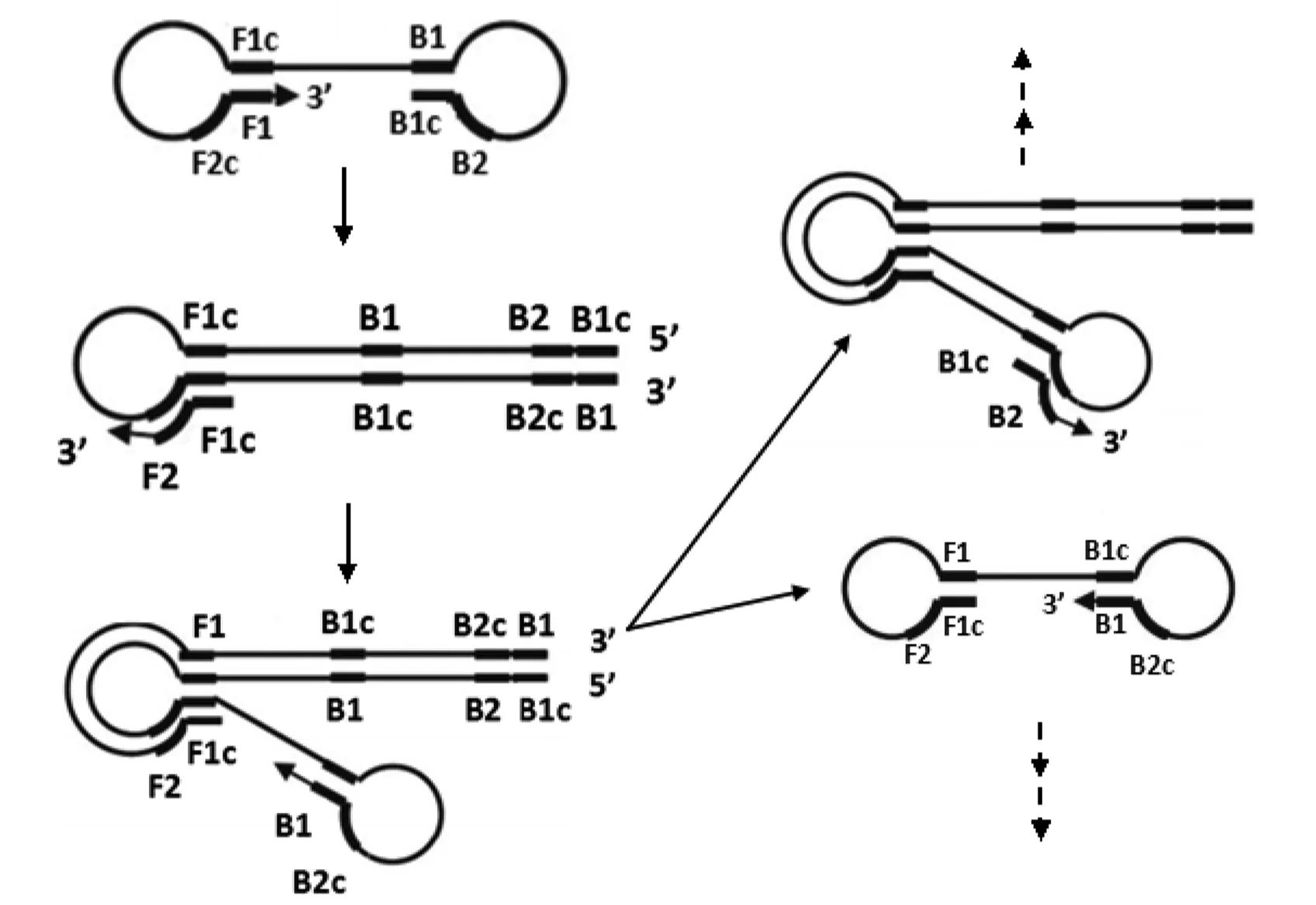
圖2 擴增循環階段Fig.2 Amplification and cycling step
1.4 LAMP產物鑒定方法
1.4.1 白色沉淀 DNA復制過程中,當一個dNTP結合到DNA鏈上的同時會解離下一個焦磷酸根離子,該離子與反應液中的鎂離子結合可產生白色焦磷酸鎂沉淀。由于環介導等溫擴增過程中,DNA進行大量復制,所產生的焦磷酸根離子與鎂離子結合可產生大量的焦磷酸鎂沉淀,因而在反應的末期通過肉眼就可以觀察到白色沉淀。但是通過肉眼觀察主觀性和不確定性較大,且陽性樣品的渾濁度維持的時間相對短暫,因而宜在反應結束后盡快進行觀察。此外,可以通過濁度儀,實時檢測管內的濁度變化。但由于焦磷酸鎂沉淀顆粒大小不均一,空間分布不均勻,樣品達到最高渾濁度前焦磷酸鎂顆粒可能重新溶解,這些因素同樣會影響實時濁度儀的檢測結果[6]。
1.4.2 金屬離子指示劑 LAMP反應過程中會解離出焦磷酸根離子,焦磷酸根離子又會與反應液中的鎂離子結合產生白色沉淀。因此,根據反應液中鎂離子或焦磷酸根離子濃度的變化可以間接判斷產物的擴增情況,這種間接染色法比較常用的是鈣黃綠素和羥基萘酚藍離子指示劑[7]。(1)鈣黃綠素:這種檢測方法是在反應液中加入鈣黃綠素和錳離子,擴增反應進行前鈣黃綠素與錳離子結合處于淬滅狀態,溶液為橙色,而在擴增反應過程中產生的焦磷酸離子可與錳離子結合,導致鈣黃綠素釋放,淬滅狀態解除發出黃綠色熒光。(2)羥基萘酚藍:反應前將羥基萘酚藍加入到反應液中,溶液呈紫羅蘭色,反應過程中鎂離子與反應副產物焦磷酸根離子結合產生大量沉淀,鎂離子濃度降低,pH發生變化,從而使羥基萘酚藍的顏色變為天藍色。金屬離子指示劑檢測的靈敏度比白色沉淀法高,但同樣要通過肉眼觀察判斷,同樣會存在一些主觀誤差,而且由于指示劑在反應前加入,會在一定程度上對擴增反應產生抑制。
1.4.3 DNA嵌入染料 DNA嵌入染料具有特定的分子結構,可以選擇性的結合到雙鏈DNA分子上,常見的DNA嵌入染料有SYBR Green I和溴化乙錠等。1)實時熒光檢測:游離的SYBRGreen I發出微弱的綠色熒光,但與DNA雙鏈結合后熒光會大大增強,熒光信號強度與雙鏈DNA的數量相關。反應前在體系中加入SYBRGreen I,通過實時熒光檢測儀可以檢測出體系中雙鏈DNA的擴增情況。這種方法可以實時快速地檢測反應情況,但SYBRGreen I會抑制LAMP反應。2)凝膠電泳檢測:溴化乙錠也是一種常用的核酸熒光染料,可嵌入核酸雙鏈的配對堿基之間,在紫外線激發下發出紅色熒光。LAMP產物與溴化乙錠結合進行凝膠電泳檢測,會出現特異性梯形條帶,由于可以對條帶大小進行判定,所以這種方法的特異性較高,但會加大工作量且容易造成污染。
1.4.4 隨著LAMP技術的快速發展,除了以上幾種比較常見的鑒定方法外,還出現了很多新的鑒定方法:橫向流動試紙條技術(LAMP-LFD)[8]、酶聯免疫吸附(LAMP-ELISA)[9]、電化學方法、NanoAu探針、場效應傳感器、表面等離子共振傳感器、擴增子吸光度、生物熒光、巨磁阻傳感器等。
1.5 LAMP技術優缺點
1)高效性:由于LAMP在等溫條件下進行,無需像常規PCR反應那樣反復升降溫造成時間損失,一般在1h內即可完成擴增,使靶序列達到109個拷貝[4]。如果使用環引物還可以縮短一半的擴增時間。這對臨床,尤其是應急檢測具有重要的意義。2)高靈敏度:LAMP反應對模板的要求不高,幾乎不受反應液中存在的大量外源DNA和其它雜質的影響,對模板DNA無需純化,甚至只要將樣品超聲裂解即可用來檢驗,檢出率比普通PCR高1~2個數量級。3)高特異性:針對靶基因的6個區域設計4條引物,6個區域中任一區域不匹配都無法進行擴增,這就決定了擴增的高特異性。4)成本低廉:LAMP反應溫度恒定,只需要水浴鍋或金屬浴就可以實現這個條件,所需儀器成本低,便于在基層單位進行推廣。5)實驗結果可視化:可直接用肉眼觀察擴增管的濁度,或者添加熒光染料通過顏色變化對實驗結果進行判定。6)通過與反轉錄技術結合,LAMP技術也可以高效擴增RNA序列。RT-LAMP方法可以先將RNA反轉錄成cDNA再進行LAMP擴增,也可以直接在LAMP反應液中直接加入逆轉錄酶。7)缺點:擴增靈敏度高,效率高,易受到污染產生假陽性,應盡量避免或減少開蓋;對引物要求高,有些基因序列比較難設計出合適的引物;擴增片段一般不超過300 bp,不能進行長片段DNA擴增。
2 LAMP技術在病原生物檢測中的應用
2.1 細菌檢測 甲類傳染病鼠疫和霍亂都是由細菌引起的,近些年來隨著衛生條件的改善,這兩種疾病在人類中已經比較罕見,但在世界范圍內的自然疫源地并未縮小,對于衛生條件較差的貧困地區,仍然存在暴發的可能性,所以仍需對其進行監測,不能掉以輕心。除此之外,在空氣、水源和食物等與人類息息相關的事物中同樣存在著一些其它致病細菌,細菌性疾病仍然對人體的健康造成很大的威脅。傳統的細菌培養是細菌檢測最常用的方法之一,然而細菌培養方法不僅繁瑣,而且耗時長,例如,嚴重危害人類健康的結核分枝桿菌,生長緩慢,一般2~4周才可見菌落生長,影響疾病的確診。LAMP技術不但操作方便,易于在自然疫源地開展檢測活動,而且反應速度快,在臨床診斷上有重要的意義,在30~35 min內即可完成對肺結核的檢測[10]。目前LAMP技術已經被用于多種致病菌的檢測當中,例如,霍亂弧菌[11]、沙門氏菌[12]和金黃色葡萄球菌[13]等,除此之外,結核桿菌、嗜肺軍團菌和艱難梭菌等已經有了商品化的LAMP恒溫快速檢測試劑盒。
2.2 病毒檢測 病毒的變異速度相對比較快,特別是RNA病毒,近些年來出現很多新發傳染病,基本上都是病毒性疾病。為了有效防止病毒性疾病的傳播感染,需要建立一種能夠對病毒進行快速檢測的方法。傳統的病毒分離培養方法和血清學鑒定耗時較長,所以一般先采用分子生物學核酸檢測的方法對其進行鑒定,而相比于普通PCR和實時熒光定量PCR,LAMP技術所需時間更短,能夠更加快速地檢測出病毒核酸。在LAMP技術出現的這十幾年來,很多研究者已經將其廣泛應用于各種病毒性疾病的檢測當中。
2007年,Kurosaki等[14]建立了快速檢測扎伊爾埃博拉病毒的RT-LAMP方法,該方法可以在26 min內檢測到20個拷貝的人工合成的扎伊爾埃博拉病毒RNA,或者10-3FFU的傳代細胞培養病毒。2013年,Yiyue Ge等[15]對HA基因和NA基因進行擴增,建立了檢測H7N9病毒的RT-LAMP-LFD方法,通過對80份H7N9疑似病例臨床樣本進行檢測,發現其敏感性和特異性與實時熒光定量PCR相比均達到了100%。2014年,Shirato等[16]建立了檢測MERS-CoV的RT-LAMP方法,能夠檢測出低至3~4個拷貝的RNA,具有高度的特異性,且不會與其它呼吸道病毒產生交叉反應。2012年,Kai Nie等[17]利用直接熱處理原始樣品進行RT-LAMP的方法檢測出咽拭子中的EV71病毒C4亞型,其敏感性和特異性與提取完RNA再進行RT-LAMP的方法相比分別為90.3%和100%,與qRT-PCR相比為86.83%和100%。除此之外,國內外許多研究者也成功地使用LAMP技術檢測出諾如病毒[18]、新布尼亞病毒[19]、登革熱病毒[20]和人乳頭瘤病毒[21]等,LAMP技術在病毒性疾病的檢測中有廣闊的前景。
2.3 寄生蟲檢測 在一些偏遠地區或者是野外,衛生環境比較差,容易引發寄生蟲病的感染。而LAMP技術操作方便,可省去DNA抽提環節,用肉眼觀察渾濁度可做出定性判斷,為寄生蟲病的現場流行病學調查提供了方便。目前,LAMP技術在寄生蟲包括原蟲、蠕蟲乃至其宿主的檢測中得到了應用。瘧疾是全球三大公共衛生問題之一,2014年,江再茂等[22]針對惡性瘧原蟲核糖體DNA的序列保守區設計LAMP引物,成功地檢測出了血液中的惡性瘧原蟲,克服了傳統血膜染色法費時、費力且容易漏診、誤診的缺點。2014年,陳璐等[23]針對棘球絳蟲ND2基因設計引物,建立LAMP檢測方法,鑒別出多房棘球絳蟲和細粒棘球絳蟲這兩個相近的種屬,且不與其它待檢寄生蟲發生交叉反應,最低檢測限度為40拷貝。此外,對剛地弓形蟲[24]、利什曼原蟲病[25]、布魯格絲蟲病[26]、泰國肝吸蟲[27]等進行LAMP檢測的方法也已經建立起來,并得到不斷深入的研究。
2.4 與其他技術聯合應用 由于LAMP技術反應條件溫和,敏感性強,特異性高,反應速度快等特點,人們將其與其他技術聯合應用,開發了一些很有意義的檢測病原生物的方法。Jung等[28]將多重RT-LAMP和免疫層析試紙條相結合(RT-LAMP-ICS),檢測出臨床樣品中僅10個拷貝的甲型流感病毒,并得出其分型(H1N1、H3N2、H5N1)。Aaruyama等[29]將LAMP和原位雜交相結合,建立了In-Situ-LAMP技術,用于檢測組織細胞中大腸桿菌O157∶H7。Seetang-Nun等[30]將納米金顆粒標記的DNA探針與LMAP技術相結合,建立了用肉眼觀察白斑綜合征病毒的方法。
3 展 望
LAMP技術靈敏度高,可以檢測到單個拷貝的核酸,對DNA要求不高,樣品甚至只需經過超聲裂解即可做為擴增模板,再加上其反應溫度恒定,在1h內即可擴增109個拷貝,所以在臨床檢測和現場檢測中具有重大的意義。LAMP擴增反應所需溫度恒定,不需要使用昂貴儀器,一旦建立了一種病原生物的LAMP檢測方法,就可以在基層單位和現場中推廣,具有廣闊的應用前景。
[1]Compton J. Nucleic acid sequence-based amplification[J]. Nature, 1991, 350(6313): 91-92.
[2]Lizardi PM, Huang XH, Zhu ZR, et al. Mutation detecton and single-molecule counting uding sothermal rolling-circle amplification[J]. Nat Genet, 1998, 19: 225-232.
[3]Walker GT, Fraiser MS, Schram JL, et al. Strand displacement amplification-an isothermal,invitroDNA amplification technique[J]. Nucleic Acids Res, 1992, 20(7): 1691-1696.
[4]Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): e63.
[5]Nagamine K, Hase T, Notomi T. Accelerated reaction by loop-mediated isothermal amplification using loop primers[J]. Mol Cell Probes, 2002, 16: 223-229.
[6]Chuang TL, Wei SC, Lee SY, et al. A polycarbonate based surface plasmon resonance sensing cartridge for high sensitivity HBV loop-mediated isothermal amplification[J]. Biosens Bioelectron, 2012, 32(1): 89-95.
[7]Fischbach J, Xander NC, Frohme M, et al. Shining a light on LAMP assays--a comparison of LAMP visualization methods including the novel use of berberine[J]. Biotechniques, 2015, 58(4): 189-194.
[8]Deng J, Pei J, Gou H, et al. Rapid and simple detection of Japanese encephalitis virus by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick[J]. J Virol Methods, 2015, 213: 98-105.
[9]Ravan H, Yazdanparast R. Development and evaluation of a loop-mediated isothermal amplification method in conjunction with an enzyme-linked immunosorbent assay for specific detection ofSalmonellaserogroup D[J]. Anal Chim Acta, 2012, 733: 64-70.
[10]Kumar P, Pandya D, Singh N, et al. Loop-mediated isothermal amplification assay for rapid and sensitive diagnosis of tuberculosis[J]. J Infect, 2014, 69(6): 607-615.
[11]Okada K, Chantaroj S, Taniguchi T, et al. A rapid, simple, and sensitive loop-mediated isothermal amplification method to detect toxigenicVibriocholeraein rectal swab samples[J]. Diagn Microbiol Infect Dis, 2010, 66(2): 135-139.
[12]Yang Q, Wang F, Jones KL, et al. Evaluation of loop-mediated isothermal amplification for the rapid, reliable, and robust detection ofSalmonellain produce[J]. Food Microbiol, 2015, 46: 485-493.
[13]Wang XR, Wu LF, Wang Y, et al. Rapid detection ofStaphylococcusAureusby loop-mediated isothermal amplification[J]. Appl Biochem Biotechnol, 2015, 175(2): 882-891.
[14]Kurosaki Y, Takada A, Ebihara H, et al. Rapid and simple detection of Ebola virus by reverse transcription-loop-mediated isothermal amplification[J]. J Virol Methods, 2007, 141(1): 78-83.
[15]Ge Y, Wu B, Qi X, et al. Rapid and sensitive detection of novel avian-origin influenza A (H7N9) virus by RT-lamp combined with a lateral-flow device[J]. PLoS ONE, 2013, 8(8): e69941.
[16]Shirato K, Yano T, Senba S, et al. Detection of Middle East Respiratory Syndrome coronavirus using reverse transcription loop-mediated isothermal amplification(RT-LAMP)[J]. Virol J, 2014, 11: 139.
[17]Nie K, Qi S, Zhang Y, et al. Human enterovirus 71 subgenotype C4 in nasopharyngeal swab specimens[J]. PLoS ONE, 2012, 7(12): e52486.
[18]Hanaki K, Ike F, Kajita A, et al. Detection of murine norovirus by reverse transcription loop-mediated isothermal amplification[J]. J Virol Methods, 2014, 204: 17-24.
[19]Huang XY, Hu XN, Ma H, et al. Detection of new bunyavirus RNA by reverse transcription-loop-mediated isothermal amplification[J]. J Clin Microbiol, 2014, 52(2): 531-535.
[20]Teoh BT, Sam SS, Tan KK, et al. Early detection of dengue virus by use of reverse transcription-recombinase polymerase amplification[J]. J Clin Microbiol, 2015, 53(3): 830-837.
[21]Luo L, Nie K, Yang MJ, et al. Visual detection of high-risk human papillomavirus genotypes 16, 18, 45, 52, and 58 by loop-mediated isothermal amplification with hydroxynaphthol blue dye[J]. J Clin Microbiol, 2011, 49(10): 3545-3550.
[22]Jiang ZM, Ma XP, Yin ZJ, et al. A closed-tube isothermal amplification method for highly sensitive and visualized detection ofPlasmodiumfalciparum[J]. Progr Mod Biomed, 2014, 14(26): 5014-5018. (in Chinese) 江再茂,馬雪萍,殷竹君,等. 單管可視化環介導等溫擴增技術快速檢測惡性瘧原蟲[J]. 現代生物醫學進展, 2014, 14(26): 5014-5018.
[23]Chen L, WLM Mamuti, Zhang DT, et al.Loop-mediated isothermal amplification for rapid detection of dogs infected withEchinococcusspecies based on copro-DNAⅡ[J]. Chin J Zoonoses, 2014, 30(7): 718-722. (in Chinese) 陳璐,吾拉木·馬木提,張德亭,等. 環介導等溫擴增技術(LAMP)檢測棘球絳蟲感染犬糞DNA的研究[J]. 中國人獸共患病學報, 2014, 30(7): 718-722.
[24]Zhuo X, Huang B, Luo J, et al. Development and application of loop-mediated isothermal amplification assays based on ITS-1 for rapid detection ofToxoplasmagondiiin pork[J]. Vet Parasitol, 2015, 208(3/4): 246-249.
[25]Mehrdad G, Mohammad JG, Lame A, et al. Development and assessment of loop-mediated isothermal amplification (LAMP) assay for the diagnosis of human visceral leishmaniasis in Iran[J]. Iranian J Parasitol, 2014, 9(1): 50-59.
[26]Poole CB, Tanner NA, Zhang Y, et al. Diagnosis of brugian filariasis by loop-mediated isothermal amplification[J]. PLoS Negl Trop Dis, 2012, 6(12): e1948.
[27]Arimatsu Y, Kaewkes S, Laha T, et al. Specific diagnosis ofOpisthorchisviverriniusing loop-mediated isothermal amplification (LAMP) targeting parasite microsatellites[J]. Acta Trop, 2015, 141(Pt B): 368-371.
[28]Jung JH, Oh SJ, Kim YT, et al. Combination of multiplex reverse-transcription loop-mediated isothermal amplification with an immunochromatographic strip for subtyping influenza A virus[J]. Anal Chim Acta, 2015, 853: 541-547.
[29]Maruyama F, Kenzaka T, Yamaguchi N, et al. Detection of bacteria carrying thestx2 gene by in situ loop-mediated isothermal amplification[J]. Appl Environ Microbiol, 2003, 69(8): 5023-5028.
[30]Seetang-Nun Y, Jaroenram W, Sriurairatana S, et al. Visual detection of white spot syndrome virus using DNA-functionalized gold nanoparticles as probes combined with loop-mediated isothermal amplification[J]. Mol Cell Probes, 2013, 27(2): 71-79.
Loop mediated isothermal amplification and its application in pathogenic organisms detection
HUANG Zhi-miao,WENG Yu-wei
(FujianCenterforDiseaseControlandPrevention,Fuzhou350001,China)
Loop mediated isothermal amplification (LAMP) technology is a novel nucleic acid amplification technology developed in recent years. Because of its simplicity, rapidity, high specificity and high sensitivity, it has been widely used in the detection of pathogenic organisms such as bacteria, viruses and parasites in the past dozen years since 2000, it has important significance of point-of-care test and local laboratory promotion.
Loop mediated isothermal amplification;pathogenic organisms;detection
福建省疾病預防控制中心,福州 350001
10.3969/j.issn.1002-2694.2015.11.019
R781
A
1002-2694(2015)11-1075-06
2015-05-23;
2015-07-21

