復發性膠質母細胞瘤再手術治療預后因素分析
苗發安 范月超
徐州醫學院附屬醫院神經外科,江蘇徐州221000
復發性膠質母細胞瘤再手術治療預后因素分析
苗發安 范月超▲
徐州醫學院附屬醫院神經外科,江蘇徐州221000
目的探討復發性膠質母細胞瘤手術指征及相關預后影響因素。方法回顧性分析我院2008年5月~2013年5月收治的36例復發性腦膠質瘤再手術病例的臨床資料特點。結果本組無死亡病例,生存時間12~59周,平均生存時間(32.3±4.5)周,再手術后有22例KPS評分較術前提高,6例同術前,下降8例,繼發顱內出血再手術1例,切口腦脊液漏1例。經Log-rank檢驗單因素分析和Cox模型多因素分析,均顯示術前KPS評分、腫瘤是否全切除和術后是否放化療為影響預后的獨立因素(P<0.05)。結論復發性膠質母細胞瘤再次手術治療具有較大意義,但需把握手術指證,術后結合放化療,以延長生存時間,提高生存質量。
膠質母細胞瘤;復發;再手術;預后因素
腦膠質母細胞瘤是最常見的顱內原發惡性腫瘤,約占所有顱內腫瘤的12%~15%,占星形細胞腫瘤的50%[1],其浸潤性生長的生物學特點決定了較高的術后復發率,有研究稱其術后復發率可達100%[2],而復發后膠質母細胞瘤的繼續治療是該類患者不可回避的問題,是否可以在最大限度地保留患者神經功能的前提下盡可能再次切除復發腫瘤組織,是值得探討的問題,本文現對我院在2008年5月~2013年5月期間進行的36例復發性膠質母細胞瘤手術治療病例進行回顧性分析,探討其預后與相關影響因素之間的關系。
1 資料與方法
1.1 一般資料
選擇我院2008年5月~2013年5月收治的復發性腦膠質瘤再手術病例共36例,其中男25例,女11例,年齡最大73歲,最小33歲,平均(55.0±3.5)歲。根據卡氏評分(KPS)分級,術前KPS評分≤70分14例,>70分22例。
1.2 腫瘤發生部位
根據“有利/不利手術區域”概念[3]分類:術前影像學檢查提示腫瘤位于有利手術部位(位置表淺、不在重要功能區和累及單一腦葉)22例,不利手術部位(位置較深或位于重要功能區或累及多個腦葉)14例,所有病例均為原位復發,未見遠處轉移。
1.3 術后放化療情況
本次手術后單純輔以放療14例、化療6例,放療+化療10例,單純進行手術未行放化療6例。其中化療均采取口服替莫唑胺方案,放療患者則轉入放療科根據其病理性質、切除程度采取適當劑量和療程進行放療。
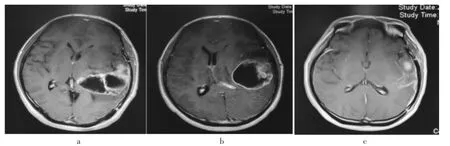
圖1 左側額顳葉基底節區膠質母細胞瘤術前術后影像對比
1.4 病理診斷
所有病例首次手術均經病理診斷為膠質母細胞瘤(WHOⅣ級)。分級免疫組化指標:GFAP(+),Vimentin(+),Ki67(>30),EGFR(+),P53(+)。
1.5 復發間隔時間
本組病例患者首次術后1個月復查MR,以后每3~6個月復查。本組病例復發間隔時間最短為2個月,最長約35個月,平均(11.0±1.8)個月。
1.6 影像學資料
所有病例均行MR增強檢查,結果提示病灶明顯強化,中線移位超5mm 8例,5mm以內28例。
1.7 手術治療方法
所有36例患者均采取顯微鏡下開顱病灶切除,術中均采取原手術切口開顱,仔細分辨腫瘤病灶與周邊水腫及壞死組織,分塊或整塊切除復發腫瘤病灶,其中2例因術后顱壓較高,去除或擴大骨瓣減壓,切口拆線時間根據患者體質及是否進行過放療而適當延長,仍有1例出現切口愈合不良,腦脊液切口漏。
1.8 統計學方法
應用SPSS statistics 16.0統計學軟件,計量資料采用均數±標準差(x±s)表示,采用Log-rank檢驗分析各因素的不同對患者預后的影響,采用Cox模型進行多因素分析,探討獨立影響再手術預后的各種因素,P<0.05為差異有統計學意義。
2 結果
2.1 治療效果
隨訪時間6個月~5年,生存時間12~59周,平均生存時間(32.3±4.5)周,所有患者行顯微鏡下復發腫瘤病灶切除,有26例增強病灶全切除,10例次全切除,術后病理檢查提示:有35例再次手術后病理檢查同首次病理診斷,仍為膠質瘤母細胞瘤,另有1例結果提示大片放射性壞死組織及膠質增生。術后多數患者KPS評分較術前提高,其中提高20分8例,提高10分14例,無變化6例,另有8例較術前下降,其中1例因術后繼發瘤腔出血,再次手術清除血腫。切口愈合不良繼發腦脊液漏1例。
2.2 預后影響因素分析
結果顯示術前KPS評分>70分的患者平均生存時間為(38.5±7.2)周,而≤70分生存時間僅為(21.8± 3.8)周,根據治療方法的不同分類,單純手術和術后接受放(化)療的患者其生存時間則分別為(19.5±3.2)周、(34.5±6.3)周,而切除程度的不同同樣顯示出生存時間的差異,經Log-rank檢驗單因素分析結果表明上述因素均顯示出統計學差異(P<0.05)。見表1。提示術前KPS評分、術后是否放化療和切除程度的不同為影響預后的獨立因素。對上述結果進一步進行Cox模型多因素分析,同樣顯示術前KPS評分、術后是否放化療及切除程度為影響預后的獨立因素(P<0.05)。見表2。而結果顯示年齡、性別、及腫瘤部位的不同則未對生存時間產生差異性影響。
2.3 典型影像學資料
見圖1。患者喬某,男性,56歲,初次診斷左側額顳葉基底節區膠質瘤(圖1a),行開顱腫瘤切除術,術后病理診斷:膠質母細胞瘤WHOⅣ級(封三圖2a),術后半年復發,MR顯示左側額顳基底節區病灶復發,明顯強化,中線結構移位(圖1b),再次行開顱腫瘤切除手術,術中切除腫瘤病灶,病理再次診斷為術后膠質母細胞瘤WHOⅣ級(封三圖2b),術后輔以放化療后復查MR見病灶明顯消失,中線結構居中(圖1c)。患者KPS評分較術前明顯改善。
3 討論
腦膠質瘤是中樞神經系統最常見的原發性惡性腫瘤[4],特別是膠質母細胞瘤,其浸潤性生長方式決定了雖然經過手術、放化療等綜合治療后仍有較高的復發率,原發性膠質母細胞瘤多數在2年內死亡,而5年生存率僅為5%[1]。手術及術后放、化療無法根本阻止腫瘤復發,復發性膠質母細胞瘤的治療目前仍是神經外科難點之一,關于其復發機制,有學者對膠質瘤臨床病理特點及復發的關系進行研究,并提出精子蛋白32前體(OY-TES-1)在膠質瘤的預后中發揮作用[5]。對于原發性膠質母細胞瘤,手術治療是獲得認可的首選治療方式[6],而由于其較高的惡性程度及不良預后,復發性膠質母細胞瘤如何選擇治療方案,再次手術療效如何,值得探討。

表1 預后影響因素單因素分析(x±s)

表2 預后影響因素Cox多因素分析
對于高級別復發性膠質瘤,特別是膠質母細胞瘤是否選擇再次手術治療,國外研究尚存在爭議,而國內鮮有報道,曾有國外學者對232例復發性膠質母細胞瘤患者進行研究,其中102例(44%)在接受再手術后繼續進行化療,而130例(56%)單純進行化療,結果并未顯示明顯差異,并由此得出結論,再次手術對于復發性膠質母細胞瘤患者病程的影響是有限的[7]。而Hervey-Jumper SL等對復發性膠質母細胞瘤再次手術治療的預后影響因素分析則表明:術前KPS評分、腫瘤復發間隔時間、是否輔以放化療等均是影響生存時間的重要因素[8]。Quick J等[9]通過多變量分析結果顯示:復發增強病灶的徹底切除程度和預后有明確相關性,KPS評分和預后則顯示出相關趨勢,因此認為對于復發性膠質母細胞瘤患者,選擇有條件的醫療機構進行再次手術徹底切除復發病灶是值得推薦的。而本組研究數據通過單因素分析結果顯示,術前評分>70分病例22例,多可以取得較好療效,隨訪平均生存時間(38.5±7.2)周,而≤70分病例14例,平均生存時間為(21.8±7.8)周,其差異有統計學意義(P<0.05),而通過Cox多因素分析,同樣顯示其為影響預后的獨立因素。
國內曾有專家學者認為,顱內復發性膠質母細胞瘤再次手術時腫瘤增強病灶全切除以及術后進行放化療均可以顯著延長生存時間[10,11],本組病例26全切除,其平均生存時間(36.4±6.6)周,而次全切除或活檢病例10例,平均生存僅為(20.6±3.4)周,差異有統計學意義(P<0.05)。腫瘤的部位單因素和多因素分析及其預后均未顯示出統計學差異,但淺部非功能區腫瘤的平均存活時間明顯長于深部功能區腫瘤,可能與腫瘤部位影響到切除程度有關。非功能區淺表部位的腫瘤再次手術,較易徹底切除,雖部分患者遺留相關神經功能障礙,但整體預后優于深部腫瘤病例。功能區及深部腫瘤由于其位置深,和重要神經血管關系密切,為保留神經功能,難以最大程度的徹底切除,術后可能出現較多的并發癥,且易反復發作,從而影響到整體預后,有報道利用術中喚醒麻醉、神經電生理檢測、術中超聲等手段,以盡可能精確定位腫瘤病灶,在保留神經功能的基礎上盡可能多的切除腫瘤組織[12],而復發病例的年齡、性別、腫瘤大小則與預后無明顯相關性。而再次手術后是否接受放化療,也對預后產生不同影響,國外曾進行的多中心隨機對照研究表明,替莫唑胺聯合放療可明顯延長膠質母細胞瘤患者的生存時間[13]。國內對于復發膠質瘤治療的專家共識也認為首次術后未進行聯合放化療的高級別膠質瘤患者如能接受再次手術,術后仍應積極放化療[6]。替莫唑胺作為一種有效的、相對安全的耐受性較好的新型藥物,在惡性腦腫瘤中的治療作用逐步得到接受[14,15],在本組30例術后接受放化療的患者,其病理結果均提示膠質母細胞瘤,經再次手術治療及放化療治療,MR復查提示腫瘤病灶較術前復發病灶明顯消失(圖1),且KPS評分明顯提高,平均生存時間[(34.5±6.3)周]明顯長于單純接受再手術病例[(19.5±3.2)周],經多因素及單因素分析,均提示其為影響預后的獨立因素。
由此可見,對于復發性膠質母細胞瘤,再次手術治療仍不失為重要的治療措施,手術的原則是在不加重腦功能損傷的前提下盡可能切除復發腫瘤病灶。術前綜合評估其KPS評分、腫瘤部位以及是否可盡可能全切除腫瘤病灶,對于決定是否采取再次手術治療,具有重要意義,對于KPS評分>70分,腫瘤位于非重要功能區腦葉的復發病例應積極采取再次手術治療,盡可能全切除復發病灶,術后輔以放化療,以盡可能提高生存質量,延長生存時間。
[1]趙繼宗.神經外科學[M].北京:人民衛生出版社,2007:381-385.
[2]徐志強,徐倫山,蔣曉江,等.膠質瘤的臨床治療進展[J].中國臨床神經科學,2010,18(4):431-435.
[3]Mineo JF,Bordron A,Baroncini M,et al.Prognosis factors of survival time in patients with glioblastoma multiforme:A multivariate analysis of 340 patients[J].Acta Neurochir(Wien),2007,149(3):245-253.
[4]陳忠平.腦膠質瘤的臨床治療方向[J].中華神經外科雜志,2007,23(2):81-82.
[5]嚴峻,盧桂花,阮玉山,等.腦膠質瘤臨床病理特征與復發的關系[J].中華實驗外科雜志,2014,31(3):636-638. [6]《中國中樞神經系統膠質瘤診斷和治療指南》編寫組.中國中樞神經系統膠質瘤診斷和治療指南(2012)[J].中華醫學雜志,2012,93(31):2424-2425.
[7]Franceschi E,Bartolotti M,Tosoni A,et al.The effect of re-operation on survival in patientswith recurrentglioblastoma[J].Anticancer Res,2015,35(3):1743-1748.
[8]Hervey-Jumper SL,Berger MS.Re-operation for recurrent high-grade glioma:A currentperspective of the literature[J]. Neurosurgery,2014,75(5):491-499.
[9]Quick J,Gessler F,Dützmann S,et al.Benefit of tumor resection for recurrent glioblastoma[J].JNeurooncol,2014,117(2):365-372.
[10]陳雄輝,周幽心,孫春明,等.復發膠質瘤的綜合治療[J].臨床神經外科雜志,2012,9(2):88-90.
[11]李鳴,詹懷義,葉建平.復發性腦膠質瘤的治療體會[J].醫學研究雜志,2012,41(8):124-126.
[12]郭效東,王本瀚,張長遠,等.功能區膠質瘤繼發癲癇的手術治療[J].中華神經外科雜志,2013,29(1):17-21.
[13]Stupp R,Mason WP,Van den BentMJ,etal.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].N Engl JMed,2005,352:987-996.
[14]甘燕玲,楊玉山,陳步東,等.替莫唑胺治療膠質母細胞瘤的近期不良反應觀察[J].中華神經外科雜志,2012,28(7):693-695.
[15]武新虎,朱錫旭,沈澤天,等.替莫唑胺治療復發性惡性腦膠質瘤療效[J].江蘇醫藥,2012,38(7):788-790.
Prognostic factors of patients with recurrent glioblastoma after reoperation
MIAO Fa'an FAN Yuechao
Department of Neurosurgery,the Affiliated Hospital of Xuzhou Medical College,Xuzhou 221000,China
ObjectiveTo explore the operation indication of recurrent glioblastoma and its prognostic factors.MethodsThe clinical characteristics of 36 reoperation cases with recurrent glioblastoma from May 2008 to May 2013 were analyzed retrospectively.ResultsAll patients survived,the overall survival time was from 12 to 59 weeks.The postopera tive survival time in whole caseswas(32.3±4.5)weeks,and the scores of Karnofsky in 22 caseswere improved after reoperation.The KPS in 6 cases were consistent with that of preoperative,and 8 cases were decreased.1 case received reoperation for secondary intracranial hemorrhage,and another one had cerebrospinal fluid leakage.The results showed that the scores of Karnofsky before reoperation,resection extentand whether they receive radiotherapy and chemotherapy after operation were independent prognostic factors according to univariate analysis and Cox regressionmodel(P<0.05).ConclusionThe reoperation has a significant effect in patientswith recurrent glioblastoma,but the operation indication should be evaluated strictly.Reoperation in combination with chemotherapy and radiation therapy could prolong survival time and improve the quality of life.
Glioblastoma;Recurrent;Reoperation;Prognostic factors
R739.4
B
1673-9701(2015)36-0037-04
2015-10-20)
▲通訊作者

