高溫脅迫對紅小豆(Vignaangularis)品系理化指標的影響
卞國棟,彭 海,張 靜,魏傳斌,陳禪友
(湖北省豆類(蔬菜)植物工程技術研究中心(江漢大學),湖北武漢 430056)
?
高溫脅迫對紅小豆(Vignaangularis)品系理化指標的影響
卞國棟,彭 海,張 靜,魏傳斌,陳禪友*
(湖北省豆類(蔬菜)植物工程技術研究中心(江漢大學),湖北武漢 430056)
[目的]為明確從野生紅小豆種群中篩選出來的紅小豆品系“JH01”的高溫脅迫響應。[方法] 以紅小豆品系“JH01”為試驗材料,利用40 ℃進行脅迫處理,檢測高溫下紅小豆品系可溶性蛋白含量、丙二醛(MDA)含量、質膜的相對透性、過氧化氫酶(CAT)活性、過氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性的變化。[結果] 經高溫處理,紅小豆品系葉片膜透性升高,SOD、CAT、MDA的活性增強,POD活性降低,而可溶性蛋白含量沒有顯著性變化。[結論]該研究為野生紅小豆逆境生理研究與耐高溫品系選育奠定基礎。
高溫脅迫;野生紅小豆;生理參數
紅小豆(Vignaangularis)具有降低膽固醇[1-3]、調節人體雌激素水平[4]、作為中草藥[5]等功能,用途十分廣泛。我國是紅小豆的生產與出口大國,栽培利用也有相當長的歷史[6]。
研究表明,鹽脅迫[7]、干旱[8]、水分脅迫[9]對紅小豆的理化指標如SOD、POD的活性、可溶性糖(WSG)含量、可溶性蛋白含量等造成影響。多項研究表明,不同的外源添加物可以通過改善理化指標降低脅迫對紅小豆的危害。尹相博等[10]指出,Ca 和葡萄糖能降低鹽脅迫對紅小豆種子發芽的負面影響。水楊酸 (SA)處理可顯著改變紅小豆POD酶活性[11]。La(NO3)3浸種可緩解鹽堿脅迫帶來的不良影響,使得受脅迫紅小豆的株高、葉面積、總根長、總根數、葉綠素、根活力、SOD活性、POD活性及CAT活性增加,并且顯著降低幼苗MDA含量水平,且表現出在鹽堿脅迫下變化幅度高于無脅迫處理的現象[12]。外源維生素可在不同程度提高鹽脅迫下紅小豆葉片葉綠素含量及幼苗體內游離脯氨酸、可溶性糖等滲透調節物質的含量,增強其滲透調節能力[13]。
在前期研究中,筆者發現一個野生紅小豆種群[14],從中篩選出一個適合林地栽培的紅小豆品系“JH01”。野生資源一般被認為對病蟲害和逆境具有較強的耐受性,但目前還沒有野生紅小豆對逆境響應的研究報道。筆者利用40 ℃的高溫處理了獲得的紅小豆品系“JH01”,從多個理化特性上對“JH01”高溫脅迫響應進行評估,為紅小豆品系逆境生理研究奠定基礎。
1 材料方法
1.1 試驗材料該紅小豆品系來源于前期于湖北武漢發現的一個野生紅小豆種群[12],從中篩選出一個種子為紅色、抗病蟲害、株形較高、適合栽培的紅小豆品系,命名為“JH01”。
1.2 試驗處理將紅小豆種子種植于含有MS固體培養基的玻璃瓶中,每瓶種2~3粒,在光照培養箱(上海新苗,GZX-250BS-III)中發芽生長,生長溫度為20 ℃,光照為其默認的光照條件(仿照自然光強呈24 h的周期性變化)。待長至4~5片葉,設置40 ℃進行脅迫處理,處理時間為3 d。處理后,取葉片進行各種理化指標的測定。試驗設20 ℃處理為對照,設3次生物重復。
1.3 質膜相對透性的測定采用電導儀法[15]測定,大致步驟如下:測定去離子水電導率(C);用去離子水浸泡取下的葉片1~2 h后,測定浸出液電導率(C1);在100 ℃沸水浴中10 min后,測定電導率(C2)。按如下公式,計算質膜相對透性。
1.4 可溶性蛋白含量的測定采用考馬斯亮藍G-250染色法,并且按如下公式計算。
式中,C為查標準曲線值(μg);Vt為提取液總體積(ml);Vs為測定時加樣量(ml);W為樣品鮮重(g)。
1.5 POD、CAT、MDA和SOD活性的測定POD、CAT、MDA和SOD活性分別用南京建成生物工程研究所開發的貨號為A084-3、A007-2、A003-3和A001-3的試劑盒測定,測定的步驟按照說明書進行。
1.6 數據統計平均數、方差和顯著性分析利用Excel2010的相關功能進行。
2 結果與分析
2.1 高溫脅迫對野生紅豆幼苗的細胞膜相對透性的影響高溫脅迫后,野生紅小豆的細胞膜相對透性從73.81%上升到76.19%,上升了2.38%,表明高溫處理增加了野生紅小豆的細胞膜透性。但是,顯著測驗的P值為0.13,沒有達到0.05的顯著性水平。
當植物受到逆境脅迫時,細胞膜易受到破壞,細胞內物質容易滲出,因此細胞膜的相對透性增大。該研究結果與這一預期相一致,也與已有的大部分研究結果相一致。例如,40 ℃高溫脅迫使得肇東苜蓿(MedicagosativaL.)葉片的細胞膜相對透性和MDA含量升高[16];高溫脅迫也使得歐亞旋覆花MDA積累,膜透性增大[17]。
2.2 高溫脅迫對野生紅豆幼苗可溶性蛋白質含量的影響高溫脅迫后,野生紅小豆的可溶性蛋白質含量從3.66 mg/g下降為3.53 mg/g,下降了0.13 mg/g,比例為3.55%。這表明高溫處理降低了野生紅小豆的可溶性蛋白質含量。顯著測驗的P值為0.01,達到0.01的極顯著性水平。
2.3 高溫脅迫對野生紅豆幼苗的MDA含量、CAT、SOD和POD活性的影響從表1可以看出,高溫脅迫后,野生紅小豆的CAT活性從7.90 μmol/g上升到13.95 μmol/g,上升了76.58%;CAT活性從51.73 U/g上升到71.18 U/g,上升了37.59%;SOD活性從9.69 U/g上升到12.05 U/g,上升了24.36%;POD活性從75.40 U/g下降到24.55 U/g,下降了67.44%。
表1 高溫脅迫對野生紅小豆幼苗MDA含量、CAT、SOD和POD活性的影響
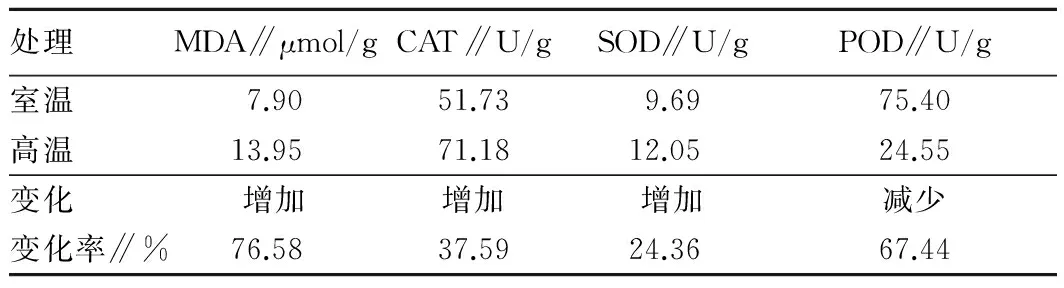
處理MDA∥μmol/gCAT∥U/gSOD∥U/gPOD∥U/g室溫7.9051.739.6975.40高溫13.9571.1812.0524.55變化增加增加增加減少變化率∥%76.5837.5924.3667.44
脅迫易產生自由基,CAT、SOD和POD可以清除植物體內的自由基因,使其不受自由基危害。因此,一般認為脅迫下這3種酶的活性將增加。研究中,CAT與SOD研究與這一預期相符,而POD不相符合。在前人脅迫研究中,大多發現這3種酶的活性均增加。例如,在40 ℃高溫脅迫下,菊花嫁接苗比扦插苗中葉片、根系和莖段SOD、POD和CAT活性平均提高90.5%~260.1%[18]。在12~24 h范圍內,高溫脅迫時間越久,脅迫溫度越高,連翹葉片的SOD活性上升得越顯著,高溫脅迫時間與連翹細胞SOD呈正相關[19]。然而,也有高溫使得水稻劍葉中POD、SOD活性降低[20]的報道。
3 結論
研究表明,在高溫脅迫后,野生紅小豆各種生理生化指標都發生變化。其中,細胞膜相對透性增加,可溶性蛋白質含量減少,MDA含量增加,CAT與SOD活性增加。這些指標的變化與大部分前人在其他物種的各種脅迫下的報道結果類似。研究還表明,POD在高溫脅迫下活性反而減少。這仍有待進一步討論。總體而言,各種理化指標反映野生紅小豆脅迫響應,為紅小豆品系逆境生理與抗逆品系篩選研究奠定基礎。
[1] NISHI S,SAITO Y,SOUMA C,et al.Suppression of serum cholesterol levels in mice by adzuki bean polyphenols[J].Food Science and Technology Research,2008,14(2):217-220.
[2] KOJIMA M,NISHI S,YAMASHITA S,et al.Smaller increase in serum cholesterol level in rats fed an ethanol extract of Adzuki bean seeds[J].Journal-Japanese Society of Food Science and Technology,2006,53(7):380.
[3] SOUMA C,OKUMURA O,KATO J.Effects of hot water extract of adzuki bean on physiological functions of human subjects[J].Bulletin of Hokkaido Prefectural Agricultural Experiment Stations (Japan),2007,91:23-29.
[4] BOUE S M,WIESE T E,NEHLS S,et al.Evaluation of the estrogenic effects of legume extracts containing phytoestrogens[J].J Agric Food Chem,2003,51(8):2193-2199.
[5] 張福生,王海英,桑英.有機紅小豆高產栽培[J].內蒙古農業科技,2009(1):106-106.
[6] 王麗俠,程須珍,王素華.小豆種質資源研究與利用概述[J].植物遺傳資源學報,2013,14(3):440-447.
[7] 于軍香.鹽脅迫對紅小豆種子萌發與生理生化特性的影響[J].作物雜志,2010(4):14.
[8] 尹寶重,王艷,張月辰.干旱脅迫對紅小豆苗期生理生化特性的影響[J].貴州農業科學,2011,39(7):65-67.
[9] 劉世鵬.水分脅迫對紅小豆抗氧化物質的影響[J].陜西農業科學,2011,57(5):17-20.
[10] 尹相博,于立芝,湯麗娟.Ca 和葡萄糖對鹽脅迫下紅小豆種子萌發的影響[J].廣東農業科學,2013(21):39-41.
[11] 楊劍平,金文林,徐紅梅,等.SA對水分脅迫下紅小豆葉片過氧化物酶活性的影響[J].北京農學院學報,2009(4):11-14.
[12] 張永清,劉鳳蘭,賈蕊.La(NO3)3浸種對鹽堿脅迫下紅小豆幼苗生長和抗氧化酶活性的影響[J].生態與農村環境學報,2009,25(4):12-18.
[13] 任秀艷,張一名,喬潔,等.外源維生素對鹽脅迫下紅小豆幼苗脂質過氧化的影響[J].西南農業學報,2012,25(5):1625-1628.
[14] 張靜,彭海,魏傳斌,等.野生紅小豆群落形態調查與利用研究[J].華中師范大學學報:自然科學版,2012(3):343-346.
[15] 西瓜,段會軍,李喜煥,等.低溫脅迫下西瓜幼苗生理特性與冷害的關系[J].中國農學通報,2007(1):84-87.
[16] 姜義寶,王成章,崔國文.肇東苜蓿對高溫的生理響應[J]..草地學報,2009,17(6):803-806.
[17] 周瑞蓮,王海鷗.在干旱、高溫脅迫中沙生植物抗脫水性與膜脂過氧化關系的研究[J].中國沙漠,1999,19(1):59-64.
[18] 龐勇,馬鋒旺,徐凌飛.抗壞血酸對蘋果組培苗耐熱性的生理效應[J].果樹學報,2005,22(2):160-162.
[19] 原海云,姚延梼.高溫脅迫對連翹葉片 SOD 活性的影響[J].天津農業科學,2012,17(6):102-104.
[20] 劉媛媛,滕中華,王三根,等.高溫脅迫對水稻可溶性糖及膜保護酶的影響研究[J].西南大學學報:自然科學版,2008,30(2):59-63.
Physiological and Biochemical Responses of Wild Adzuki Bean(Vignaangularis)Line “JH01” under High Temperature Stress
BIAN Guo-dong, PENG Hai, ZHANG Jing, CHEN Chan-you*et al
(Hubei Province Engineering Research Center for Legume Plants, Jianghan University, Wuhan, Hubei 430056)
[Objective]The research aimed to clarify the response of the wild adzuki bean line “JH01” under high temperature.[Method] A adzuki bean line “JH01” as experimental material was treated by high temperature (40 ℃). Its physiological and biochemical responses were measured, including leaf soluble protein content, malondialdehyde (MDA) content, plasma membrane relative permeability, catalase (CAT) activity, peroxidase (POD) activity and superoxide dismutase (SOD) activity.[Result] Under the high temperature, plasma membrane relative permeability, SOD activity, CAT activity and MDA activity increased, POD activity decreased, and soluble protein content didn’t significantly change. [Conclusion] This study set up a foundation for the understanding of the stress-resistance mechanism and breeding of the wild adzuki bean line.
High temperature stress;Wild adzuki bean;Physiological and biochemical parameters
武漢市科技攻關項目(2013021001010465);湖北省豆類中心項目(2012-02)。
卞國棟(1993-),男,安徽亳州人,本科生,專業:生物技術。*通訊作者,教授,博士,從事遺傳育種方面的研究。
2014-10-20
S 188+.1
A
0517-6611(2015)01-001-02

