2相早期后除極誘發時空湍流的抑制方法
張虹,趙丹,劉袁
(西安交通大學電氣工程學院, 710049, 西安)
?
2相早期后除極誘發時空湍流的抑制方法
張虹,趙丹,劉袁
(西安交通大學電氣工程學院, 710049, 西安)
針對心肌細胞膜電位振蕩的早期后除極(EAD)誘發的湍流,提出了恒定電場和周期電場兩種湍流消除方法并對其效果進行了比較。基于LR91單細胞模型構建了一塊包含400×400個細胞格點的二維組織,并通過將K+電流門控變量時常數和Ca2+電流最大電導分別增大4和2倍的方法在組織中心設置了一塊由20×20個格點構成的具有EAD特征的區域。利用垂直場法誘導螺旋波斑圖,并在EAD的作用下碎裂出現湍流即室顫。通過在反應擴散方程中引入電場項建立除顫模型,并引入膜電位的全局偏導數判別湍流的抑制效果。計算機仿真結果表明:恒定電場法抑制湍流的時間小于50 ms,周期場法需歷時200 ms,但兩種方法電場的實際作用時間無顯著差異;盡管周期場法產生的總熱能是恒定電場法的2.3倍,但周期場法一個周期產生的熱能僅為恒定電場法的一半。因此,恒定電場法具有消除湍流快、總熱能低的特點,但周期場法由于電場斷續式地施加,更有利于減小熱的持續積累對心肌的損傷。
早期后除極;湍流波;除顫;電場;計算機仿真
心肌細胞早期后除極(EAD)是在復極化階段細胞膜電位出現多次振蕩的現象[1]。根據電位振蕩的特點,EAD分為2相和3相。兩者相比,3相EAD膜電位振蕩開始時的電位低、振幅大,易誘發形成可傳導的電興奮,是引起觸發激動及心室纖維性顫動,即室顫的主要因素之一[2]。但是,實驗和理論研究說明[3-5],2相EAD不僅可發生于單細胞中,而且在組織中也可導致穩定螺旋波斑圖的碎裂形成湍流。研究證實,螺旋波斑圖與心律失常密切相關[6]。正常情況下,一次電興奮形成的波以平面的形式傳播,若發生室性心動過速即室速,膜電位的傳播表現為有序和規則的螺旋波斑圖的形態。當波的傳播不能正常進行時,伴隨破碎呈現形形色色的無序行為,出現時空混沌和湍流態時則為室顫。研究說明,2相EAD盡管不能由于觸發激動而誘發室顫,但由其引起的動作電位復極離散性可導致螺旋波破碎,演化為時空湍流態即室顫[7]。
室顫是心源性猝死的主要原因之一,電擊除顫是較為簡單直接有效的方法[8]。然而,強大的電擊不僅會對患者心理造成不可忽視的影響,而且可能引起心臟機械泵血功能受損,以及誘發新的電活動失穩等眾多問題,因此除顫方法的研究一直備受關注[9]。人們從除顫能量、波形以及除顫手段等諸多方面開展了廣泛的研究[10-11],但是目前尚未見到針對具有2相EAD特征的病理組織上的湍流抑制方法的相關報道。因此,本文采用計算機定量研究方法,以2相EAD誘發的湍流為研究對象,主要就恒定電場和周期電場兩種方法消除湍流的可行性進行了研究,并比較了它們的除顫效果。
1 方 法
1.1 局部EAD組織模型的構建及湍流的誘導
首先基于Luo和Rudy(LR91)單細胞模型[12]構建一塊6 cm×6 cm的二維組織并離散化為400×400個格點,每個格點代表一個細胞。電興奮的產生及擴布遵循如下反應擴散方程及無通量邊界條件

(1)
(2)
式中:V為跨膜電勢;Cm為跨膜電容;t是時間;D為擴散系數;Iion為總跨膜電流;Ist為外部刺激電流;xmin、xmax、ymin和ymax分別為二維組織沿x和y軸方向的最小和最大值。
由于本文主要研究的是EAD誘發的湍流的抑制方法,加之研究中發現中心處20×20的EAD區域所引起的湍流波碎裂程度最為明顯,因此在構建的正常組織中心位置處設置了一塊由20×20個具有EAD特征的細胞格點組成的區域。該區域內每個細胞的K+電流門控變量時常數以及Ca2+電流最大電導分別為正常細胞的4倍和2倍[7]。
然后,利用垂直場法[6]在組織模型中誘導出螺旋波。在EAD區域的作用下,螺旋波失穩斑圖出現碎裂,發生湍流即室顫。在湍流的誘導過程中,Ist為脈寬2 ms、幅值30 ×10-6A/cm2的電流。
1.2 湍流波的抑制及判別
文中采用恒定電場和周期性電場兩種方法消除湍流波。所用模型是將式(1)中的外部電流刺激項Ist代換為外電場項Edef,即
(3)
式中:ε為電場強度系數。研究中在整個組織平面沿y軸方向施加外電場,其中恒定電場法施加ε為0.1的恒定電場,周期電場法施加周期為T、電場脈寬為10 ms、ε為0.1的周期性電場。
利用Lax-Wandrof法[13]求解式(3),得
(4)
式中:(l,n)為細胞格點所在的坐標;Δx為沿x軸方向的空間步長。為判別湍流波的抑制效果,引入如下膜電位的全局偏導數,即平均膜電位偏差為[13]
(5)
式中:N、L分別為x和y軸方向的細胞總數,此處N=L=400。
σ越小,控制效果越理想。對于勻質組織,當σ接近或等于0時,系統恢復到靜息狀態,成功抑制時空混沌[13]。本文組織中部為EAD區域,所以動作電位時程遠大于周圍的正常組織細胞,當湍流波消失,正常細胞恢復到靜息電位時,EAD區域尚未完全復極化,具有較高的膜電位。因此,本文取σ=0.1作為湍流波是否得以抑制的判別標準,即σ<0.1時認為控制成功。
2 結果與討論
2.1 恒定電場法
圖1給出了恒定電場控制湍流波時不同時刻組織上的膜電位斑圖。由圖1a中可見,明顯地呈多處碎裂狀的湍流,此時開始施加恒定電場,經過7 ms后在圖1b的頂部區域處細胞膜電位取得一致,并形成近似平面波向下傳導,如圖1c、1d所示,導致碎裂處細胞膜電位由不均勻的分布狀態逐漸達到一致,從而消除了不同位置碎裂波不應期的差異性,抑制了由于碎裂波相互碰撞造成波的不斷湮滅和產生的現象,最終使湍流在49 ms時得以完全消除如圖1e所示,組織細胞開始恢復到靜息狀態,即-90 mV。

圖1 恒定電場控制湍流波時不同時刻的膜電位斑圖
圖2給出了恒定電場法控制湍流波時不同時刻平均膜電位偏差σ的變化情況。對應圖1a的斑圖,由于存在多處碎裂波,膜電位呈現明顯的無序狀態,σ值較大,為5.12。隨著電場的施加,對應圖1b~1d,σ從2.09減小到1.77,呈逐步減小的趨勢。49 ms時圖1e對應的σ小于0.1,時空混沌得到有效抑制。對比σ的變化情況,說明其較大變化率主要發生在兩個時段:一個是從開始施加電場到7 ms時,變化率為0.42;另一個是從全組織近乎2/3的湍流受到抑制到完全消除,即33 ms到49 ms時段,σ的變化率為0.11。
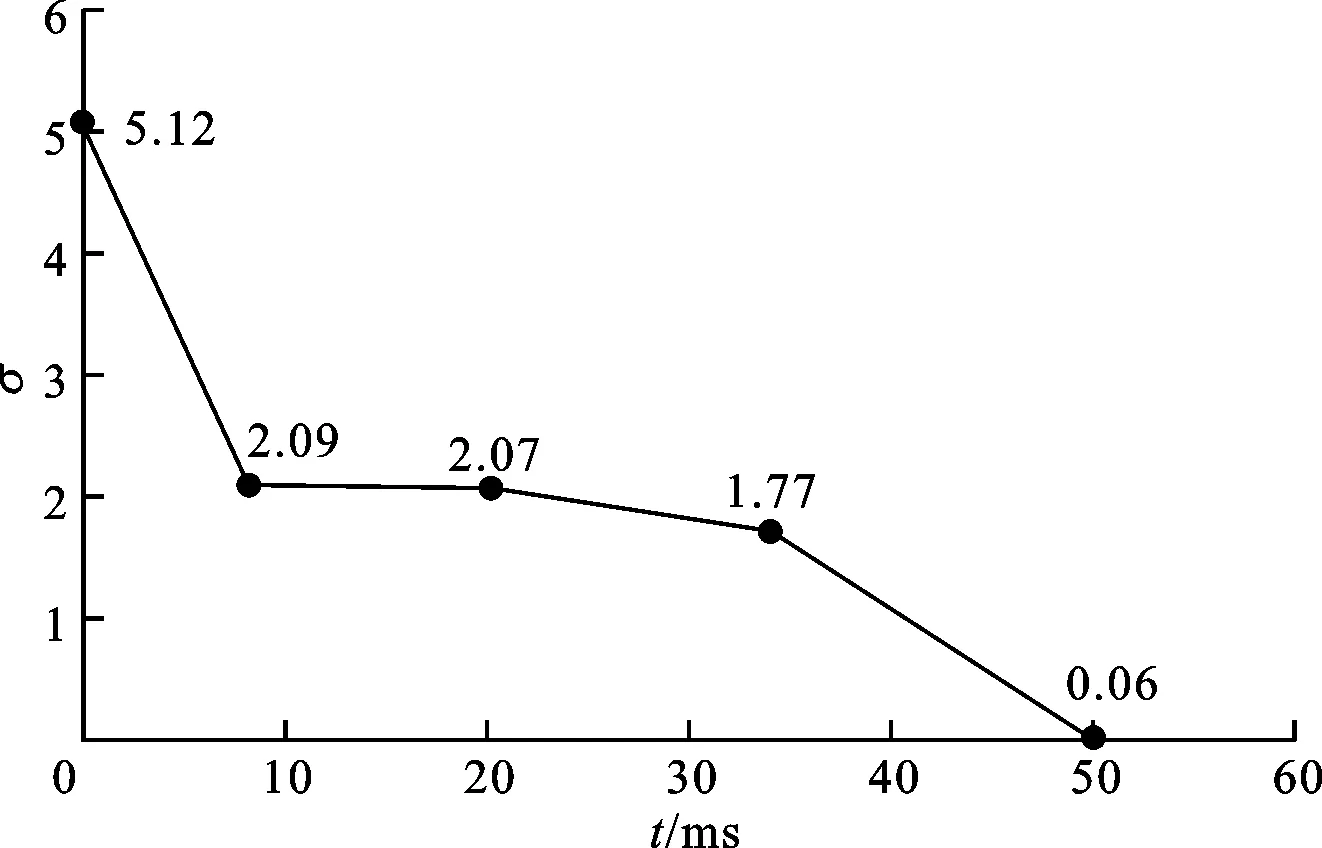
圖2 施加恒定電場時平均膜電位偏差隨時間的變化
2.2 周期電場法
為了探討周期電場法抑制湍流波時周期對控制效果的影響,研究了不同周期時消除湍流所需花費的時間,即從開始施加電場到σ<0.1時所歷經的時間。圖3給出了周期與湍流消除時間的關系,可見當周期從40 ms增加到50 ms時,消除時間從303 ms縮短到209 ms,之后隨著周期的增加,消除時間逐漸延長。當周期處于60 ms到90 ms之間時,消除時間從247 ms延長至573 ms,呈緩慢增長。當采用100 ms周期的電場時,消除時間驟然增大到1 450 ms。
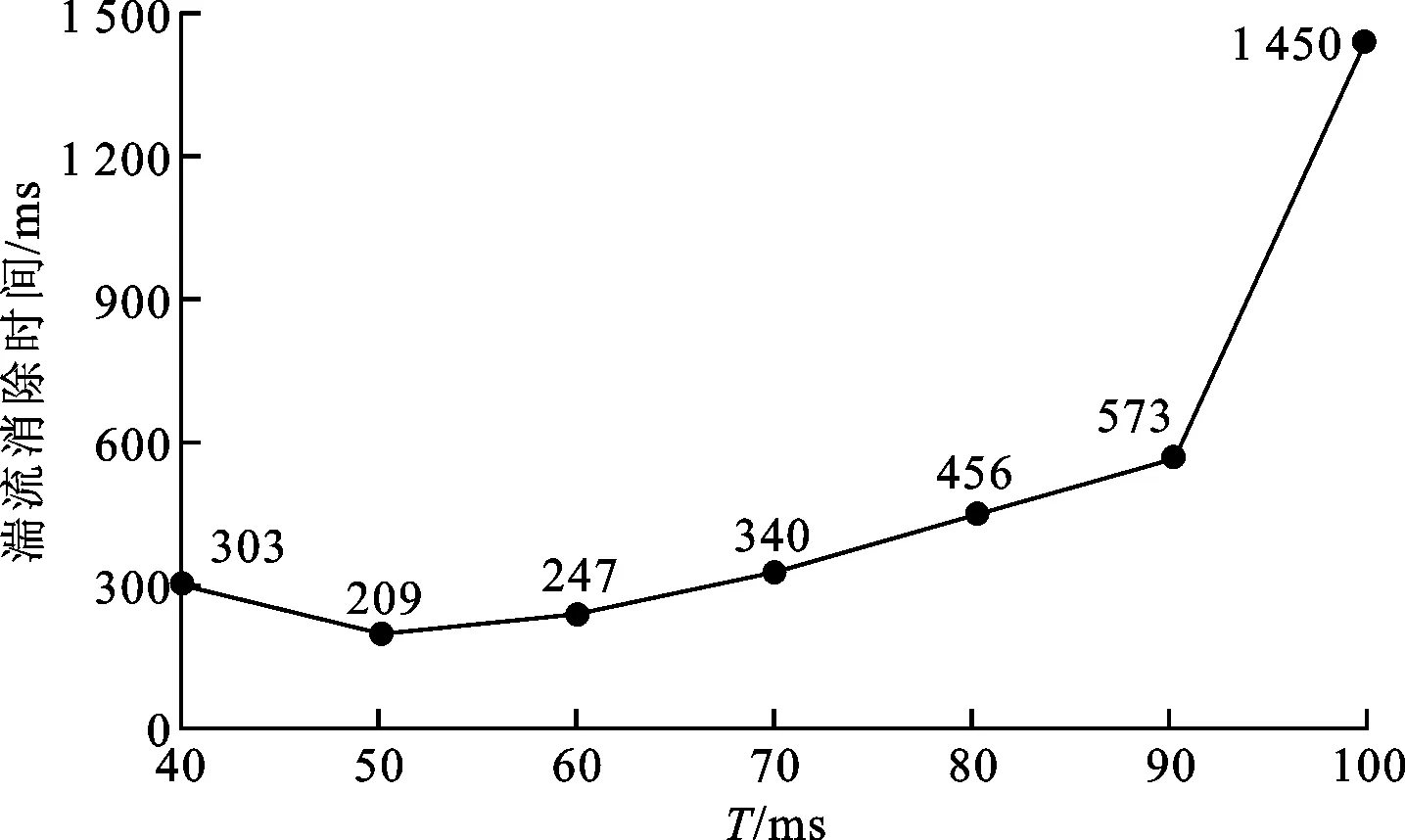
圖3 周期電場法的周期與湍流消除時間的關系
此外,實驗中發現采用周期小于40 ms或大于100 ms的電場均無法徹底抑制湍流,說明周期電場法對湍流的抑制效果與施加電場的周期有著密切的關系。周期過短時,由于組織細胞不應期的影響,使得一個周期的電場作用后下一個周期只能引起局部的電緊張,無法形成有效的可擴布的電場使得不同區域膜電位趨于一致,從而無法達到抑制湍流的目的。當周期過大時,兩次電場的作用間隔時間長,使得組織細胞有足夠的時間恢復到原有狀態,亦無法消除湍流。
圖4給出了周期為50 ms的電場抑制湍流的膜電位斑圖。圖4a~4e對應第1個周期,圖4f~4i對應第2個周期,圖4j為第4個周期209 ms時刻的斑圖。圖5為圖4中各時刻斑圖對應的平均膜電位偏差σ。由圖4a~4c可見,隨著電場的作用,組織上部波的碎裂得到抑制,使圖5中對應時刻的σ快速下降至1.89。之后由于電場的撤銷導致無法形成持續的可傳導的平面波,圖4d、4e的上部電場作用逐漸減弱,促使圖5中σ重新回升至3.63。但是,相對于開始施加電場時σ降低了1.48,這說明盡管第1個周期電場無法完全抑制湍流,但已使波碎裂的程度減弱。

圖4 周期電場控制湍流波時不同時刻的膜電位斑圖
隨著第2個周期電場的施加,由圖4f~4i可見,電場形成了有效的向下方可傳導的平面波,使碎裂逐步得到有效控制。圖5中的σ也相應地降低。圖4i說明在第2個周期結束前,雖然碎裂波仍存在,但已受到了明顯的抑制。之后隨著第3和第4個周期電場的施加,碎裂波越來越少,圖4j中已觀察不到明顯的湍流,平均膜電位偏差σ也降至0.1以下,說明湍流波已被完全抑制。
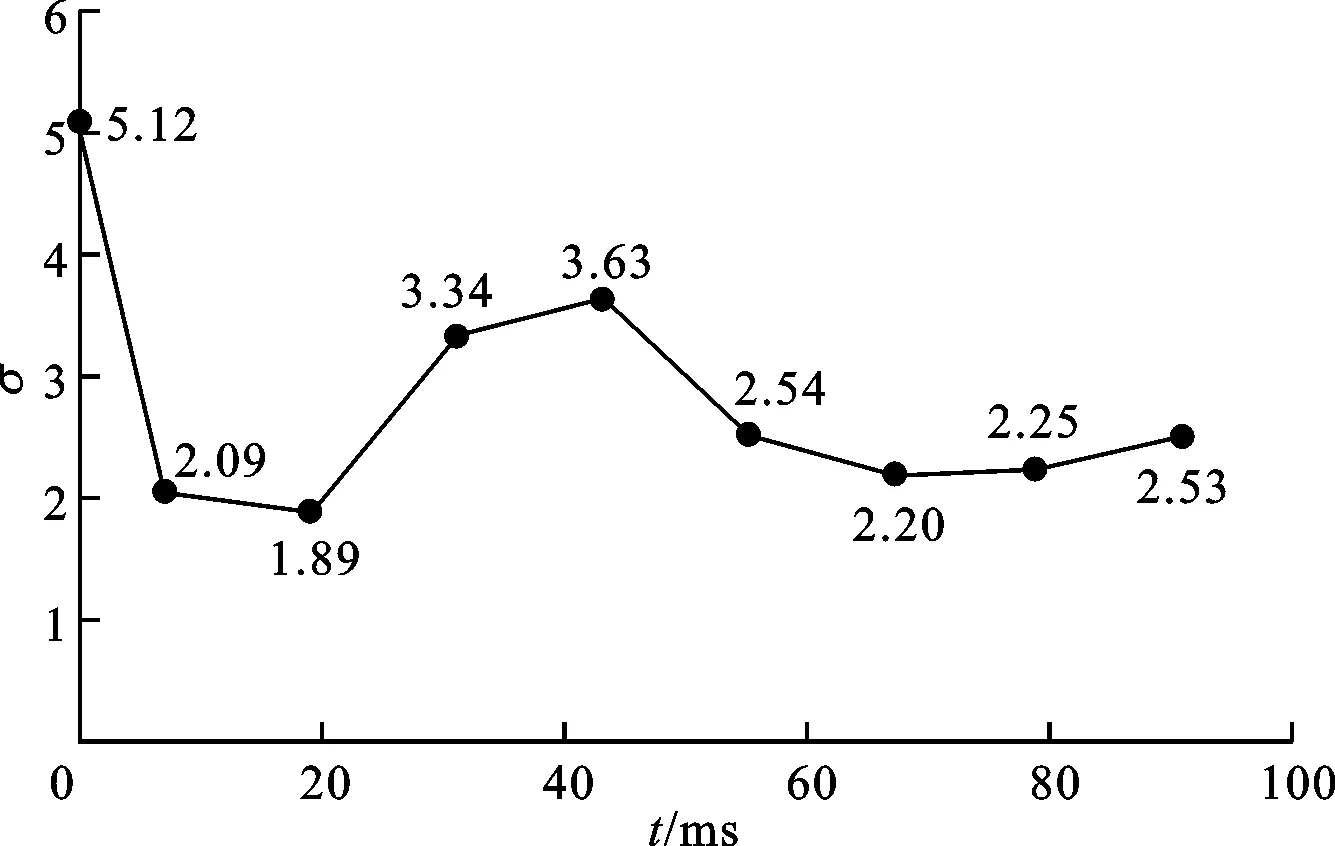
圖5 施加周期電場時平均膜電位偏差隨時間的變化
2.3 恒定與周期場法的比較
研究結果表明,恒定和周期場都可以抑制早后除極引起的湍流波。從抑制湍流的過程可見,周期場法由于一個周期中電場作用的時間較短,需要連續施加至少4個周期才能達到完全消除湍流的目的,歷經的湍流消除時間為209 ms,而采用同樣強度的恒定場,消除時間不到50 ms。但是,周期場每個周期施加電場10 ms,所以其電場的實際作用總時間與恒定電場法幾乎相同。因此,如果從實際作用時間來看,兩種方法無顯著性差異。
每個心肌細胞的電活動可等效為電阻和電容并聯的電導模型,細胞間通過縫隙電導緊密相連構成一個合胞體。因此,文中將心肌組織視為一個阻容并聯的等效電路,計算了兩種電場抑制湍流時在單位組織面積和單位電阻上產生的熱能,圖6給出了計算結果。由圖6a可見,隨著恒定電場的持續施加,能量不斷上升,而周期電場法在每個周期中電場作用階段的熱能呈上升趨勢,其余階段無熱能產生,因此呈階梯狀升高。當湍流完全得到抑制時,周期場法產生的總熱能是恒定電場法的2.3倍。但是,如果將周期場法一個周期產生的熱能與恒定電場法產生的熱能比較,前者只為后者的一半,且在一個周期中有4/5的時間無外加電場,從而減小了熱積累對心肌的損害。

(a)恒定電場

(b)周期電場圖6 兩種電場抑制湍流時在單位組織面積上產生的熱能
3 結 論
2相EAD誘發的湍流可采用恒定和周期場法加以控制。恒定電場法抑制湍流的時間小于50 ms,周期場法需歷時200 ms,但兩種方法電場的實際作用時間近乎相同;盡管周期場法產生的總熱能是恒定電場法的2.3倍,但周期場法一個周期產生的熱能僅為恒定電場法的一半。因此,恒定場法具有消除湍流快、總熱能低的特點。周期場法由于電場斷續式地施加,更有利于減小熱能的持續積累對心肌的損傷。
[1] ZHAO Zhenghang, WEN Hairuo, FEFELOVA N, et al. Revisiting the ionic mechanisms of early after-depolarizations in cardiomyocytes: predominant by Ca waves or Ca currents [J]. American Journal of Physiology: Heart and Circulatory Physiology, 2012, 302(8): H1636-H1644.
[2] QU Zhilin, XIE Laihua, OLCESE R, et al. Early afterdepolarizations in cardiac myocytes: beyond reduced repolarization reserve [J]. Cardiovascular Research, 2013, 99(1): 6-15.
[3] LANGE E D, XIE Yuanfang, QU Zhilin. Synchronization of early afterdepolarizations and arrhythmogenesis in heterogeneous cardiac tissue models [J]. Biophysical Journal, 2012, 103(2): 365-373.
[4] LIU Gongxin, CHOI B R, ZIV O, et al. Differential conditions for early afterdepolarizations and triggered activity in cardiomyocytes derived from transgenic LQT1 and LQT2 rabbits [J]. Journal of Physiology, 2012, 590(5): 1171-1180.
[5] 張虹, 趙丹, 李蕊娟. 心肌細胞鉀通道調控早期后除極的動力學機制 [J]. 西安交通大學學報, 2014, 48(11): 92-96. ZHANG Hong, ZHAO Dan, LI Ruijuan. Dynamic mechanisms of the early afterdepolarization regulated by cardiac potassium channel [J]. Journal of Xi’an Jiaotong University, 2014, 48(11): 92-96.
[6] MASATOSHI Y, HARUO H, HARUMICHI N, et al. Mechanisms of destabilization and early termination of spiral wave reentry in the ventricle by a class III antiarrhythmic agent, nifekalant [J]. American Journal of Physiology: Heart and Circulatory Physiology, 2007, 292(1): H539-H548.
[7] 張虹, 趙丹, 賀銳睿, 等. 2相早期后除極對心肌電折返穩定性的影響 [J]. 中國生物醫學工程學報, 2015, 34(1): 24-29. ZHANG Hong, ZHAO Dan, HE Ruirui, et al. Effects of phase-2 early afterdepolarization on the stabilities of electrical reentry [J]. Chinese Journal of Biomedical Engineering, 2015, 34(1): 24-29.
[8] 何慶, 萬智. 心臟電除顫發展史 [J]. 中華醫史雜志, 2007, 37(3): 161-164. HE Qing, WAN Zhi. Electric cardiac defibrillation history [J]. China Journal of Medical History, 2007, 37(3): 161-164.
[9] TRAYANOVA N. Defibrillation of the heart: insights into mechanisms from modelling studies [J]. Experimental Physiology, 2006, 91(2): 323-337.
[10]AMBROSI C M, RIPPLINGER C M, EFIMOV I R, et al. Termination of sustained atrial flutter and fibrillation using low-voltage multiple-shock therapy [J]. Heart Rhythm, 2011, 8(1): 101-108.
[11]CONSTANTINO Y, ASHIHARA T, TRAYANOVA N A, et al. Tunnel propagation following defibrillation with ICD shocks: hidden post-shock activations in the left ventricular wall underlie isoelectric window [J]. Heart Rhythm, 2010, 7(7): 953-961.
[12]LUO C H, RUDY Y. A model of the ventricular cardiac action potential, depolarization, repolarization, and their interaction [J]. Circulation Research, 1991, 68(6): 1501-1526.
[13]鄺玉蘭, 唐國寧. 心臟中螺旋波和時空混沌的抑制研究 [J]. 物理學報, 2012, 61(10): 100504. KUANG Yulan, TANG Guoning. Suppressions of spiral waves and spatiotemporal chaos in cardiac tissue [J]. Acta Physics Sinica, 2012, 61(10): 100504.
[本刊相關文獻鏈接]
楊振中,秦朝舉,宋立業,等.傳統缸內壁面傳熱模型在氫內燃機中的適用性.2015,49(9):36-40.[doi:10.7652/xjtuxb 201509007]
崔雨辰,段浩,李超,等.電場分布對球形傳播火焰變形率的影響.2015,49(5):49-55.[doi:10.7652/xjtuxb201505008]
張峰,王新軍,李軍.帶肋U型通道中的汽霧/空氣流動與換熱數值研究.2015,49(9):52-57.[doi:10.7652/xjtuxb2015 09010]
李森,李亮,杜長河.球窩/球凸結構下的U型通道蒸汽冷卻性能.2015,49(9):63-69.[doi:10.7652/xjtuxb201509012]
謝金偉,王新軍,周駿飛.空心靜葉汽膜孔排吹掃除濕的數值研究.2015,49(7):61-66.[doi:10.7652/xjtuxb201507011]
王世柱,李志剛,李軍,等.補汽對透平級氣動性能和靜葉汽封轉子動力特性影響的數值模擬.2015,49(5):56-61.[doi:10.7652/xjtuxb201505009]高慶,李軍.間隙結構對輪緣密封封嚴性能及透平級氣動性能影響的數值研究.2015,49(3):25-31.[doi:10.7652/xjtuxb 201503005]
張虹,鄭霄,趙丹.GPU加速竇房結計算機仿真的實現及優化.2014,48(7):60-64.[doi:10.7652/xjtuxb201407011]
張虹,趙丹,李蕊娟.心肌細胞鉀通道調控早期后除極的動力學機制.2014,48(11):92-96.[doi:10.7652/xjtuxb201411 016]
(編輯 趙煒)
Inhibition of the Turbulence Induced by Phase-2 Early Afterdepolarization
ZHANG Hong,ZHAO Dan,LIU Yuan
(School of Electrical Engineering, Xi’an Jiaotong University, Xi’an 710049, China)
Aiming at the myocardial cell membrane oscillation induced by phase-2 early afterdepolarization (EAD) due to voltage oscillation, two turbulence control methods based on constant and periodic electrical fields were presented and compared. A 2-dimensional tissue including 400×400 cells was developed based on the LR91 model. By increasing the time constant of K+current gating variable and the maximum conductance of Ca2+current by 4 and 2 times respectively, an EAD region with 20×20 cells was created in the center of the tissue model. The cross field method was used to induce spiral wave, which was degraded to turbulence due to EAD. The defibrillation model was created by introducing an electric field term in the reaction-diffusion equation. The inhibition efficiency was evaluated by using an introduced global partial derivative. Computer simulation results showed that the constant and periodic electric fields required 50 ms and 200 ms to eliminate the turbulence, respectively, but their actual delivery time has no significant difference. The total thermal energy produced by the periodic field was 2.3 times that by the constant field, while the heat produced within one period by the periodic field was half of that by constant field method. Therefore, the constant electric field method is characterized by faster turbulence elimination and less thermal energy consumption, while the periodic method can bring less damage to cardiac muscle because of its intermittent delivery nature.
early afterdepolarization; turbulence; defibrillation; electric field; computer simulation
2015-05-13。作者簡介:張虹(1969—),女,博士,副教授。基金項目:國家自然科學基金資助項目(81271661,30870659);教育部回國留學人員科研啟動基金資助項目(第40批)。
時間:2015-09-11
10.7652/xjtuxb201511013
TP391.9
A
0253-987X(2015)11-0077-05
網絡出版地址:http:∥www.cnki.net/kcms/detail/61.1069.T.20150911.1111.010.html

