新藥臨床研究中橋接試驗的統計方法*
南京醫科大學流行病與衛生統計學系(211166) 劉 晉 于 浩 柏建嶺 曾 平 劉麗亞 陳 峰
新藥臨床研究中橋接試驗的統計方法*
南京醫科大學流行病與衛生統計學系(211166) 劉 晉 于 浩 柏建嶺 曾 平 劉麗亞 陳 峰△
我國大部分新藥仿制或進口自西方國家,它們的安全性和有效性在西方國家已得到確認,而這些由歐美人群建立的臨床療效和安全性結果是否可以直接外推到中國人群,是我國藥物監管部門在審批此類藥物時重點考慮的問題。針對外國引進藥物,我國目前審批策略是:要求對引進的國外藥品在我國人群中進行I-III期的臨床試驗,驗證其對我國人群的安全性與有效性后方批準上市[1]。然而大量研究表明,大部分藥品的藥物特性在不同種族間類似。因此對所有申請上市藥品無區別地進行重復試驗常常造成時間延誤及資源浪費[2-3]。
為解決此類問題,1998年美國、歐盟和日本三國組成的國際協調會議(international harmonization conference,ICH)發布了名為“種族因素對外國臨床數據可接受性的影響”(ethnic factors in the acceptability of foreign clinical data)的指導文件(以下簡稱E5文件)[4]。該文件首次提出了橋接試驗(bridging study)概念并建立了評價種族因素對藥物療效、安全性等影響的基本規范。在E5文件指導下,橋接試驗策略在日本、臺灣等國家和地區得到了推廣、使用,許多新藥在經過橋接試驗后通過了藥物監管部門的審批[5]。
目前在國內已發表文獻中,除中國生物制品檢定所桑國衛院士和南京醫科大學辛衛權等對橋接試驗的概念和國外應用進行了介紹外,尚未見到對橋接試驗統計方法較為系統的介紹[1,6]。故本文將重點介紹橋接試驗設計與分析中的統計方法,以期為我國臨床試驗研究者提供了解和引進這一國外新技術和新策略的借鑒和參考。
橋接試驗的基本概念
ICH 1998年發布的E5文件指出,新藥在原地域已經通過審批以后,如果要推廣到新地域,可以利用原地域臨床試驗已有信息,按需在新地域進行小規模的附加試驗研究,通過這些試驗研究說明該藥品對新地域人群具有同樣的安全性、有效性,即可有效、快速地將原地域藥品外推到新地域。因此,橋接試驗只需證明藥物在新地域安全性和有效性特征與原地域具有“相似性”(similarity)。而傳統臨床試驗忽略原地域數據,僅依靠新地域數據證實藥物在該地域的安全性與有效性。由于“相似性”往往涉及到橋接試驗是否需要進行以及該試驗是否成功或被認可,因此是橋接試驗中一個極為重要的問題,但E5文件僅給出了“相似性”的概念,并沒有給出判定相似性的標準和方法[7-9]。鑒于此,國外研究者圍繞“相似性”問題進行了深入和廣泛的探討。現有研究從方法學上可分為經典統計方法(頻率方法)和貝葉斯統計方法。從研究重點上看,則主要集中在“相似性”的度量、原地域信息的利用、現地域試驗結果的模擬;在貝葉斯統計領域尚涉及結果的頻率解釋(I型誤差和II型誤差)以及與管理規范的銜接等。
橋接試驗中的經典統計學方法
根據經典統計學原理,一些研究者從不同角度出發提出了橋接試驗的頻率統計方法。其中代表性的方法有以下三類:重建概率和概括概率法、加權Z檢驗法、兩階段設計和成組序貫設計法。
1.重建概率和概括概率法
Shao和Chow于2002年提出重建概率(reproducibility probability)和概括概率(generality probability)的概念[8-9,11]。所謂重建概率是指在新地域重復原地域試驗結果的概率,當無明顯證據表明兩地域間的種族差異對藥物療效產生影響,通過計算重建概率判斷是否需要進行橋接試驗;而概括概率則為在已有信息表明新地域和原地域藥物療效可能存在差異的條件下,新地域得到療效存在的概率。計算這兩種概率的基本方法是利用原地域信息估計藥物療效的總體參數,進而計算在新地域I類錯誤控制在指定水準下的把握度。具體有三種計算方法:①估計把握度法(estimated power approach),②置信區間界值法(the confidence bound approach),③Bayes法(Bayesian approach)。隨后,Chow提出以敏感性指標(sensitivity index)[11]作為藥物療效在兩地域間變化的度量,并以該指標判斷藥物療效能否在兩地域間實現橋接。敏感性指標定義如下,令原地域療效總體均值和標準差為uorginal、σorginal,令新地域效應總體均值和標準差分別為unew=uorginal+ε、σnew=Cσorginal,其中ε和C分別為新地域療效總體均值和標準差相對于原地域的改變量。則新地域療效均值與標準差比值為:

Chow等將Δ稱為敏感性指標,Δ=(1+ε/uorginal)/C,該指標度量了兩地域間療效信噪比的改變量。在以下4種條件下:①ε和C都是固定常數;②ε為隨機變量,C為常數;③ε為常數,C為隨機變量;④兩者都是隨機變量;利用EM法可估計該敏感性指標。若該指標落于預定區域內,則判斷橋接成功。但是這個區域該如何選擇,作者并未給出明確建議。
2.加權Z檢驗法
2005年Lan首次提出加權Z檢驗(weighted z test)方法[12]。根據權重給定方式的不同,可以用于自適應設計的樣本量再估計或應用于橋接試驗的分析中。對于橋接試驗中的加權Z檢驗,其基本思想是將原地域和新地域的近似正態性Z檢驗統計量(ZForeign,ZBridging),按照預先指定的權重(w)相加,得到新的統計量對Zw進行假設檢驗,若小于預定檢驗水準a,則認為橋接成功。權重w通過預先獲得的關于原地域和新地域藥物療效的相似性在分析前確定。通過這種方式,新地域試驗的檢驗水準αbridging被調整為αbridging=1-φ((zα-顯而易見,αbridging受到權重w和原地域Z統計量兩個因素的共同影響,往往會造成Ⅰ類錯誤膨脹,因此在應用此法時應注意Ⅰ類錯誤的大小應滿足相關地域藥物審批的法規要求。對于新地域的試驗樣本量估計,Lan指出可以通過對橋接地域的樣本量相比較于原地域進行折扣的方式實現。令原地域試驗的Ⅱ類錯誤為β,Ⅰ類錯誤為αFull,試驗組與對照組療效總體差值為Δ,則原地域每組所需總樣本量為
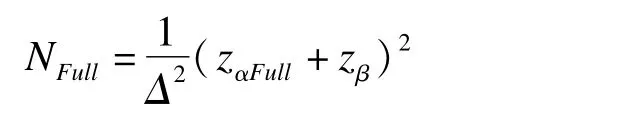
通過設定折扣因子D(discount factor),橋接地域的樣本量:
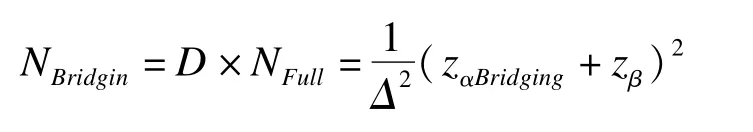
在保持橋接地域把握度不變的條件下,橋接地域所對應的Ⅰ類錯誤為
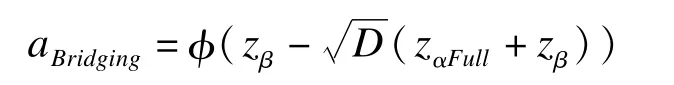
2012年Hsiao-Hui借鑒Lan加權Z檢驗思想,提出了另一種加權檢驗策略[13]。與Lan對Z統計量加權不同,他們通過對兩地域總體療效指標而非Z檢驗統計量進行加權,其定義的原假設為:
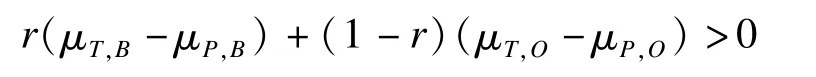
其中r為預先定義的權重,μT,B-μP,B,μT,O-μP,O分別為橋接地域和原地域試驗組與對照組療效差值。在此原假設下,對應的檢驗統計量服從t分布。在此基礎上,Hsiao使用迭代方法求解出新地域所需樣本量,并計算最大的權重取值。模擬試驗顯示,該迭代方法能夠計算出將Ⅰ類、Ⅱ類錯誤控制在指定水準下所需最小的橋接地域樣本量。
Xiaoyu Dong 2012年對Lan和Hsiao的方法進行了比較。考察在相同條件下,Ⅰ類、Ⅱ類錯誤以及樣本量需求情況[14]。他認為Lan的方法中權重w的取值和兩地域數據的變異度比值對Ⅰ類錯誤和把握度影響較大,而Hsiao的方法則相對穩定。
3.兩階段設計和成組序貫設計法
從另一角度出發,Hsiao xu和Liu將橋接試驗視為在統一框架下分兩階段(原地域階段和新地域階段)進行的臨床試驗。在此基礎上,將兩階段設計(two stage design)和成組序貫設計(group sequential design)引入橋接試驗的設計與分析中[15-16]。該法的主要步驟為:第一階段對原地域獲得的試驗結果進行t檢驗,若檢驗統計量T0大于預定界值C0則試驗進入第二階段(新地域試驗),否則試驗中止。當第二階段(橋接階段)完成后,對一、二階段的累計數據進行最終分析。若檢驗統計量TN大于預定界值CN,認為可以將第一階段原地域結果外推至第二階段的新地域。在總Ⅰ類錯誤和Ⅱ類錯誤固定的條件下,采用兩個參數r1和r2分配一階段和二階段的Ⅰ類和Ⅱ類錯誤。一階段和二階段Ⅰ類錯誤分別為
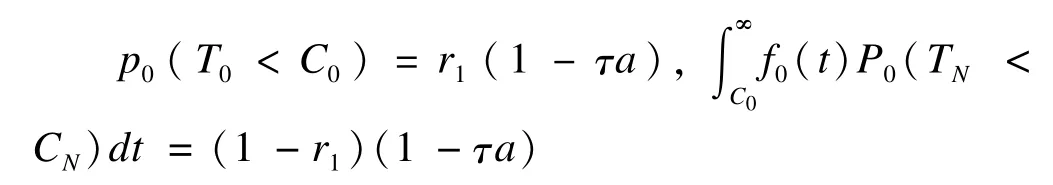
一階段和二階段Ⅱ類錯誤則分別為,

式中C0為一階段的檢驗界值,CN為二階段檢驗界值,τ為Ⅰ類錯誤調整參數。通過以上四個公式,即可得到原地域和新地域所需的樣本量。
橋接試驗中的貝葉斯統計方法
貝葉斯統計方法近年來日益受到重視,橋接試驗通過合理使用已掌握的藥物安全性、有效性信息(即原地域已上市藥物的相關信息),支持藥物在新地域的快速上市的思路和Bayes統計的理念十分契合。因此許多研究者對各種Bayes統計方法在橋接試驗設計與分析中的應用進行了大量研究[17]。其代表性的方法有Bayes預測概率法、經驗Bayes法、混合先驗法、冪次先驗法(power prior)和公度冪次先驗法(commensurate power prior)。
1.貝葉斯預測概率法
Shih 2001年將原地域進行的試驗(包括數個地區)視為多中心臨床試驗,將新地域視為一個新的中心,利用Bayes預測概率判斷各地域間療效的一致性(consistency)[7]。需要說明的是,Shih所說的一致性實際上是我們前面介紹頻率方法時提到的相似性的另一種表達方式。假定原地域S個中心試驗組和對照組比較t檢驗統計量為T=(T1,T2,……,TS),令TN為新地域的t統計量,分別計算在給定T統計量條件下的TN和Ti的Bayes預測概率p(TN|T)和p(Ti|T)(i=1,2,…,S)。若滿足以下公式:

即在原地域所有試驗中心數據基礎上得到新地域觀測數據的預測概率大于原地域任一中心的預測概率,則認為新地域與原地域間藥物療效具備一致性。此處預測概率是指在已有數據基礎上,利用Bayes原理推斷的未知數據各種取值的可能性。對于結果服從二項分布的數據,也可以按照上述方法的思路進行類似分析。該方法是E5文件發布后,首個被提出的橋接試驗的Bayes方法。雖然它為以后的研究奠定了一定基礎,但作為一種Bayes方法,Shih并沒有評價監管機構十分關心的Ⅰ類、Ⅱ類錯誤,因此,該方法的統計特性值得進一步研究。
2.經驗貝葉斯法
Liu等2002年將經驗Bayes方法引入橋接試驗的分析中,并利用總體參數后驗概率構建相應的相似性判斷標準[18]。具體方法為:將原地域試驗組和對照組療效差值作為新地域的先驗,以橋接地域試驗組和對照組療效差值作為現有數據,利用經驗Bayes方法計算新地域試驗組與對照組療效差值的后驗概率,若兩組療效差值大于0的概率大于預定界值(1-α),則認為兩地間療效具有相似性。令μNT為新地域治療組總體均值,μP為對照組總體均值,則新地域療效的后驗概率需滿足下式:
PSI=Pr{μNT-μP>0|bridging data and prior}>1-α
式中α取值為試驗前確定的,而新地域總體療效μNT-μP大于0的近似概率(similary probability)PSI即可視為相似性的判斷標準。
值得注意的是,該準則關注的是療效的定性描述,即僅關注新地域試驗組和對照組療效差值是否大于0,而并不涉及其具體療效大小。而在實際中即使新地域和原地域都有正向的療效存在,但它們的療效之間可能存在明顯差別,因此,采用該判斷方法可能并不能真正識別出兩地域間療效的相似性。為此Liu 2004年對其2002年的方法進行了改進,計算在整合新地域數據和原地域試驗數據(bridging data and prior)條件下,新地域和原地域試驗組療效差值大于非劣效界值(δ)的概率(PSI)。并和事先確定的概率水平(1-α)進行比較,若大于(1-α)則認為藥物在兩地域療效相似[19]。用公式表示為
PSI=Pr{μNT-μOT>-δ|bridging data and prior}>1-α
其中μNT為新地域治療組療效指標總體均值,μOT為原地域治療組療效指標總體均值。該方法原理與Liu(2002)方法類似。
Liu(2002)和Liu(2004)的相似性判斷策略均直接以原地域的樣本信息作為新地域的先驗信息估計后驗概率,而在實際工作中原地域數據樣本量往往遠大于新地域樣本量,故在后驗分布的計算中占據主導地位,常常使得新地域的結果無法“扭轉”原地域結果,這就導致使用上述兩種方法進行相似性判斷時,即使新地域的療效遠低于原地域,最終也總是判斷兩地結果相似,而這正是經驗Bayes方法的主要缺陷。
3.混合先驗
針對經驗Bayes法存在的缺陷,Liu 2007年在其2002年方法的基礎上對先驗信息的定義方式進行了改進,提出混合先驗Bayes法(m ixture prior approach)以代替經驗Bayes方法[20]。所謂混合先驗是指總體參數的先驗分布并非是單個分布函數,而是由兩個分布函數按照一定權重相加組成。對于橋接試驗而言,其中一個分布函數是由原地域已知的數據確定,而另一個分布函數則常常使用無信息先驗分布,再將兩者按照預定的權重相加,即得到混合先驗分布。令總體參數為新地域試驗組和對照組療效之差:
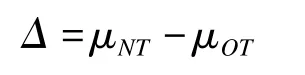
則混合先驗分布形式為:

其中π1(ΔN)常為無信息先驗,具體形式可以是均勻分布、方差較大的正態分布等;π2(ΔN)和前述經驗Bayes先驗相同,為根據原地域試驗確定的經驗先驗。為預先指定的先驗權重,取值范圍。當γ為1時,不借用原地域信息,為0時,則退化為Liu(2002)方法中的先驗。不難看出,混合先驗通過權重調整有信息的原地域數據在整個先驗信息中所占的比例,從而達到削弱原地域樣本量過大造成的影響。然而,由于γ取值需要人為指定,加之其實際意義并不明確,因此在實際應用中很難給出其合理取值。
4.冪次先驗法和公度冪次先驗法
對于經驗Bayes先驗存在的原地域信息“掩蓋”新地域信息問題,除了可以使用混合先驗法外,也可以使用冪次先驗(power prior)的方法加以解決。冪次先驗通過指定冪次參數a0和初始先驗(initial prior)將原地域信息以似然的形式納入模型中,冪次a0的大小作為尺度參數用于調整歷史信息被使用的程度,從而避免信息量較大的原地域數據掩蓋可能的“真實”結果[21]。利用冪次先驗法獲得總體參數后驗概率的一般過程如下:令現有試驗數據為D,歷史數據為D0,θ為感興趣的總體參數,L(θ|D)為似然函數;進一步,令π0(θ|c0)為在歷史數據D0被觀測前關于θ的先驗信息,稱之為初始先驗;則在給定冪次a0和歷史數據D0的條件下,θ的冪次先驗為:
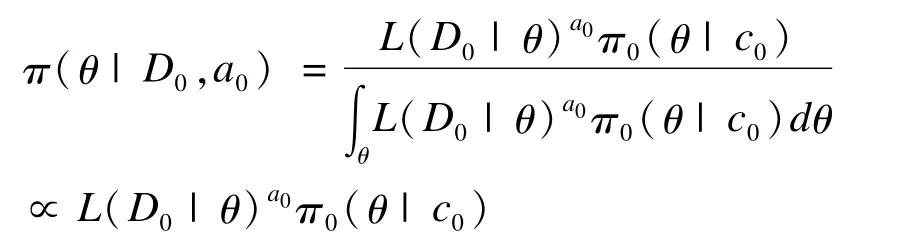
上式與一般Bayes公式的不同之處是其似然函數具有冪次a0,0<a0<1。當a0為1時,即利用全部原地域信息,退化為一般的層次Bayes先驗;而a0為0時,則僅使用初始先驗。在實際應用中,a0可以根據實際情況指定一個常數或為a0指定一個先驗分布以反映a0取值的不確定性。顯然,在橋接試驗中我們可以在使用冪次先驗得到新地域藥物療效指標后驗概率后,進一步利用Liu 2002或2004年提出的相似性判斷準則進行原地域和新地域的療效相似性判斷。Mihir Gandhi等于2012年采用這種方式對療效指標服從二項分布的橋接試驗數據進行了分析[22]。
在橋接試驗數據分析中,冪次先驗和混合先驗兩種Bayes先驗指定方法都可以實現對原地域信息在合理范圍內“有限度”的利用,然而冪次先驗在許多條件下可給出直觀解釋,故冪次先驗法更為實用。
雖然冪次先驗可以方便直觀地將原地域信息加以利用,然而,反映信息使用多少的冪次參數卻需要人為指定,因此可能存在利用外部信息過多,超出合理范圍的問題[23]。為解決此問題,Hobbs等在冪次先驗方法的基礎上提出了公度冪次先驗(commensurate power prior)法[24]。該方法利用了冪次先驗的基本原理,但通過增加一個度量兩地域間總體參數相似性的參數τ,并估計其分布,自適應地確定a0的分布,從而避免了主觀決定a0對結果產生的影響。具體過程為:
令θ0為原地域的療效參數,對于θ0我們賦予其模糊先驗或平坦先驗,對于新地域數據θ的先驗分布則由θ和度量θ和θ0相似性的參數τ決定。例如θ0的先驗可以是θ~N(θ0,τ),其中方差τ的大小,即度量了θ和θ0相似性。在對τ指定一個模糊先驗p(τ)后,即可得到關于(θ,θ0,a0,τ)的聯合先驗分布為

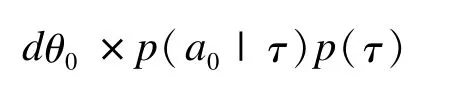
雖然該法需要估計更多的參數(比如τ),但是卻改進了對a0的估計[24]。
討 論
自1998年ICH E5指導文件發布以來,橋接試驗設計和統計分析方法一直是國外臨床試驗研究的熱點問題之一,現已初步形成了其特有的方法學體系(雖然遠非完善)。如頻率學派的成組序貫設計、加權Z檢驗、等效性檢驗、非劣效檢驗等。貝葉斯學派包括經驗貝葉斯方法、貝葉斯預測概率、貝葉斯后驗概率等。由于貝葉斯方法借助先驗信息進行統計推斷,因此和橋接試驗的基本思想,即借用藥物在原地域已獲得的有效性、安全性信息支持其在新地域上市相吻合。因此貝葉斯方法在橋接試驗上的應用較頻率方法更為自然。目前的貝葉斯方法在橋接試驗上應用的主要難點在于先驗信息的確定或原地域已有信息的利用程度,以及利用貝葉斯后驗概率進行決策時Ⅰ類錯誤的估計等。
目前針對橋接試驗的統計設計分析方法較多,然而這些方法的優劣與特性的比較則相對缺乏。由于橋接試驗本身特點,一些分析與設計方法并沒有考慮Ⅰ類錯誤。而實際上橋接試驗方法由于常常借助外來信息使得Ⅰ類錯誤膨脹,采用此種分析策略可能在一些國家或地區無法通過藥物監管部門的審批。橋接試驗的推廣與應用離不開科學完善的統計設計與分析方法支撐,只有科學合理的對橋接試驗結果進行分析與解釋,才能發揮出這種試驗策略的優勢,這正需要我們統計工作者進行深入的探索與研究。
1.辛衛權,荀鵬程,于浩,等.新藥臨床試驗中的橋接試驗.中國臨床藥理學與治療學,2008,13(3):309-314.
2.Kihito T,Mari I,Hiromu N.Multiregional Clinical Trials for Global Simultaneous Drug Development in Japan,2012:235-250.
3.Mey W,Yeong-Liang L,Herng-Der C.Feasibility and Implementation of Bridging Studies in Taiwan,2012:251-264.
4.ICH.Triparite Guidance E5,Ethnic Factors in the Acceptability of Foreign Data.Federal Register,1998,83:31790-31796.
5.Christy C,Yoichi I,Norisuke K,et al.Design and Sample Size Considerations for Global Trials//2012:121-150.
6.桑國衛.新藥臨床研究中的“橋接”試驗.中國處方藥,2003(2):50-53.
7.Shih WJ.Clinical trials for drug registrations in Asian-Pacific countries:proposal for a new paradigm from a statistical perspective.Control Clin Trials,2001,22(4):357-366.
8.Shao J,Chow S.Reproducibility probability in clinical trials.Statistics in Medicine,2002,21(12):1727-1742.
9.Liu J,Chow S.Bridging studies in clinical development.Journal of biopharma ceutical statistics,2002,12(3):359-367.
10.Khin N A,Yang P,Hung H,et al.Regulatory and Scientific Issues Regarding Use of Foreign Data in Support of New Drug Applications in the United States:An FDA Perspective.Clin.Pharmacol.Ther,2013,94(2):230-242.
11.Chow SC,Shao J,Hu OY.Assessing sensitivity and sim ilarity in bridging studies.J Biopharm Stat,2002,12(3):385-400.
12.Lan KK,Soo Y,Siu C,etal.The use of weighted Z-tests in medical research.J Biopharm Stat,2005,15(4):625-639.
13.Tsou HH,Tsong Y,Liu J T,et al.Weighted evidence approach of bridging study.J Biopharm Stat,2012,22(5):952-965.
14.Dong X,Guo Y,Tsong Y.A Note on Two Approaches of Testing Bridging Evidence to a New Region.Journal of Biopharmaceutical Statistics,2012,22(5):966-976.
15.Hsiao C,Xu J,Liu J.A group sequential approach to evaluation of bridging studies.Journal of biopharmaceutical statistics,2003,13(4):793-801.
16.Hsiao CF,Xu JZ,Liu JP.A two-stage design for bridging studies. JOURNAL OF BIOPHARMACEUTICAL STATISTICS,2005,15(1):75-83.
17.Chin-Fu H,Hsiao-Hui T,Jen-pei L,et al.A Bayesian Approach for E-valuation of Bridging Studies,2012:89-104.
18.Liu J,Hsiao C,Hsueh H.Bayesian approach to evaluation of bridging studies.Journal of biopharmaceutical statistics,2002,12(3):401-408.
19.Liu J,Hsueh H,Hsiao C.A Bayesian noninferiority approach to evaluation of bridging studies.Journal of biopharmaceutical statistics,2004,14(2):291-300.
20.Hsiao CF,Hsu YY,Tsou HH,et al.Use of prior information for Bayesian evaluation of bridging studies.Journal of Biopharmaceutical Statistics,2007,17(1):109-121.
21.Ibrahim JG,Chen M.Power prior distributions for regression models. Statistical Science,2000:46-60.
22.Gandhi M,Mukherjee B,Biswas D.A Bayesian apprroach for inference from a bridging study with binary outcomes.Journal of Biopharmaceutical Statistics,2012,22(5SI):935-951.
23.Duan Y,Ye K,Smith EP.Evaluating water quality using power priors to incorporate historical information.Environmetrics,2006,17(1):95-106.
24.Hobbs BP,Sargent DJ,Carlin BP.Commensurate priors for incorporating historical information in clinical trials using general and generalized linear models.Bayesian Analysis,2012,7(3):639-674.
(責任編輯:郭海強)
*國家自然科學基金資助項目(81273184);國家自然科學基金資助項目(81302512)
△通信作者:陳峰,E-mail:fengchen@njmu.edu.cn

