肝刺激因子對非酒精性脂肪性肝炎保護作用的初探
史一君,郭 慶,安 威
(首都醫科大學細胞生物學系,肝臟保護與再生調節北京市重點實驗室,北京100069)
肝臟是以代謝功能為主的人體最大臟器。在體內扮演著消化、吸收、代謝,去除毒素和轉運等多種重要角色。由于承擔著如此繁重的任務,肝臟很容易被各種致病因素攻擊。肝刺激因子(hepatic stimulator substance,HSS)是一種相對分子質量為15~23 000的多肽類物質,熱穩定性強,無種屬特異性,但有器官特異性[1]。HSS存在于哺乳動物的胚肝以及部分切除后的殘余肝臟中[2]。研究表明,HSS可以保護肝細胞免受如四氯化碳、氨基半乳糖和缺氧等毒性因素的損傷[3-4]。非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一種逐漸被人們認識的慢性肝臟疾病,它是無過量飲酒史,以肝細胞脂肪變性為特征的臨床綜合征。NAFLD可謂為一個由輕到重的肝臟疾病譜,其病理過程包含3個發病階段,即單純性脂肪肝、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、終末期的肝纖維化/肝硬化[5]。本實驗室前期研究發現,HSS在蛋氨酸膽堿缺乏飼料飲食喂養的小鼠NASH中起到保護作用,可以減輕肝臟的脂肪堆積[6]。本研究旨在觀察油酸(oleic acid,OA)誘導BEL-7402細胞NASH疾病的細胞模型中,HSS是否可以減輕細胞中脂質的堆積。而HSS對NASH疾病保護機制可能與內質網膜上的鈣通道相關,這一部分的研究我們仍在進一步探討中。
1 材料與方法
1.1 主要試劑 BEL-7402細胞,人原發性肝癌細胞系,本實驗室保存;DMEM培養基(美國Gibco/BRL公司);胎牛血清(美國Hyclone公司);OA(美國Sigma公司);噻唑藍[3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliu-mromide,MTT]粉末(北京天來生物科技有限公司);組織三酰甘油(triglyceride,TG)酶法測定試劑盒(北京普利來基因技術有限公司);油紅 O(美國Sigma公司);caspase-3/7活性檢測試劑盒(美國Promega公司)。
1.2 細胞培養 野生型BEL-7402細胞、穩定轉染空載體和穩定轉染HSS的BEL-7402細胞在含10%胎牛血清的DMEM培養基中置于37℃含5%CO2的培養箱中培養。每24~48h傳代1次,取處于對數生長期的細胞進行實驗。
1.3 MTT法測定細胞活力 BEL-7402細胞按2×104個細胞密度接種于96孔板中,在37℃含5%CO2的培養箱中培養,直至細胞匯合達80%時,更換含有1%胎牛血清的DMEM培養基繼續培養細胞5h,以排除血清對細胞的影響。分別向培養基中加入牛血清蛋白(bovine serum albumin,BSA)和濃度為25、50、100、200、400μmol/L的 OA培養24h。隨后,每孔加入50μL的2g/L的MTT溶液繼續培養3h。隨后,將培養基吸出,每孔加入150μL二甲基亞砜,避光條件下振蕩混勻10min。用酶標儀在490nm下測光密度(optical density,OD)值。
1.4 細胞內TG的測定 按照普利萊公司組織TG酶法測定試劑盒中說明書的步驟進行操作,用酶標儀在550nm工作波長下測定OD值。
1.5 油紅O染色 配置0.5%油紅O儲存液,之后以3∶2的比例混合稀釋油紅O儲存液和雙蒸水,現用現配。待野生型BEL-7402,轉染空載體或轉染HSS的BEL-7402細胞匯合率達80%時,用中性甲醛固定細胞10min。用過濾后的油紅O染液染色10~15min。用60%異丙醇脫色細胞5s,之后用PBS漂洗細胞3次,使用蘇木精對細胞核復染10~20s[7]。
1.6 丙氨酸轉氨酶(alanine aminotransferase,ALT)的測定 應用日立7180全自動生化分析儀檢測細胞培養基上清液中ALT的含量。
1.7 Caspase-3/7活性檢測 按照Promega公司caspase-3/7檢測試劑盒說明書的步驟操作,用熒光分光光度計檢測細胞凋亡情況。
1.8 統計學方法 應用SPSS11.5統計學軟件進行數據分析。計量資料以±s表示,分別采用成組設計的t檢驗、配對t檢驗、F檢驗和q檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 MTT法檢測不同濃度OA對BEL-7402細胞活性的影響 用25、50、100、200、400μmol/L OA處理BEL-7402細胞24h后,用MTT法檢測細胞活性。細胞活力隨OA濃度升高而下降。當OA濃度為200μmol/L時,與BSA對照組相比,細胞活力出現顯著下降;當OA濃度為400μmol/L時,細胞活力下降更為顯著(圖1)。
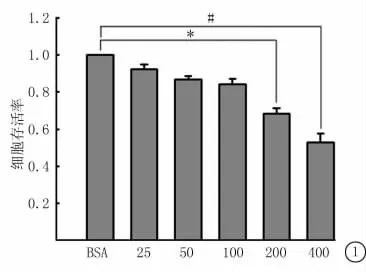
圖1 MTT法檢測不同濃度OA處理BEL-7402細胞活力*P<0.05 #P<0.01與BSA對照組比較(q檢驗)Figure 1 The cell activity was determined by MTT treated with different concentrations of OA to BEL-7402cells
2.2 不同濃度OA對BEL-7402細胞內TG含量的影響 用25、50、100、200、400μmol/L OA 分別處理BEL-7402細胞24h后,測定細胞內TG的含量。與BSA組相比,隨OA濃度增加,細胞內TG含量逐漸增加,直至OA濃度為100μmol/L時,細胞內TG含量達到頂峰。當OA濃度>200μmol/L時,TG含量逐漸減少(圖2)。這可能與OA濃度>200μmol/L時,細胞存活率顯著下降有關。

圖2 檢測不同濃度OA處理BEL-7402細胞內TG的含量*P<0.05與BSA對照組比較(q檢驗)Figure 2 The TG content in BEL-7402cells treated with different concentrations of OA
2.3 HSS對BEL-7402細胞內TG含量的影響
用100μmol/L濃度OA作用于轉染空載體與穩定轉染HSS的BEL-7402細胞24h,檢測細胞內TG的含量。與空載體組相比,轉染HSS組細胞內TG含量減少(圖3)。
2.4 HSS對BEL-7402細胞中脂滴堆積的影響
TG聚積在肝細胞內會形成脂質沉積。100μmol/L濃度的OA作用于轉染空載體與穩定轉染HSS的BEL-7402細胞24h,用油紅O染色可以觀察到肝細胞內的脂質堆積情況。轉染空載體細胞OA處理組,胞內可見大量紅色顆粒,脂質沉積明顯;穩定轉染HSS細胞與轉染空載體細胞相比,細胞內紅色顆粒明顯減少,脂質沉積減輕(圖4)。

圖3 穩定轉染HSS可以減少TG在細胞內的堆積*P<0.05與轉染空載體細胞的OA處理組比較(q檢驗)Figure 3 The triglyceride content was significantly decreased in HSS-overexpressing cells

圖4 脂質在BEL-7402細胞內的定位,標尺刻度均為50μm(油紅O染色 ×40)A.轉染空載體細胞BSA處理組油紅O染色;B.轉染空載體OA處理組油紅O染色;C.穩定轉染HSS細胞BSA處理組油紅O染色;D.穩定轉染HSS細胞OA處理組油紅O染色Figure 4 The lipid accumulation was determined in BEL-7402 cells.The scale bar indicates 50μm(oil red O staining×40)
2.5 HSS對BEL-7402細胞細胞膜通透性的影響轉染空載體OA處理組細胞,漏出胞外的ALT較BSA組明顯增多,而穩定轉染HSS可以顯著減少細胞ALT的漏出,見表1。
表1 2組細胞上清中ALT比較Table 1 The cellular supernatant levels of ALT in two groups(n=9,±s,U/L)
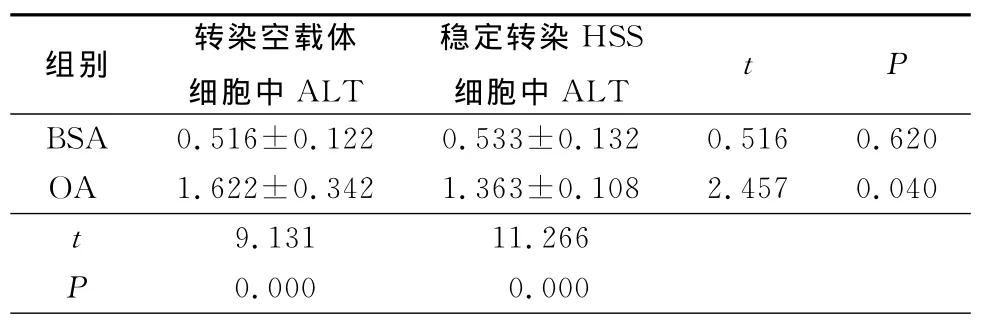
表1 2組細胞上清中ALT比較Table 1 The cellular supernatant levels of ALT in two groups(n=9,±s,U/L)
?
2.6 HSS對BEL-7402細胞凋亡的影響 用100 μmol/L濃度的OA作用于轉染空載體與穩定轉染HSS的BEL-7402細胞24h,檢測細胞內caspase-3/7的活性。空載體OA處理組與BSA對照組相比,caspase-3/7的活性顯著增強,而穩定轉染HSS細胞的caspase-3/7活性顯著減弱(圖5)。

圖5 穩定轉染HSS可以減輕細胞凋亡*P<0.05與轉染空載體的BSA處理組比較 #P<0.05與轉染空載體的OA處理組比較(q檢驗)Figure 5 The caspase-3/7activity was notably decreased in HSS-overexpressing cells
3 討 論
NAFLD是指除外酒精所致的一種慢性肝臟疾病,發病率日趨增長,引起了學者們的關注和重視。對于NAFLD的發病機制,目前尚未完全明確,廣為認可的是由英國學者Day提出的“二次打擊”學說。初次打擊是指胰島素抵抗和脂質代謝紊亂所導致的肝細胞內脂質沉積,形成了單純性脂肪肝;二次打擊是指在此基礎上其他各種原因所致的氧化應激與脂質過氧化損傷引起的肝細胞損傷乃至凋亡[8]。
對于NASH的發病,肝臟內TG代謝紊亂是主要的發病原因。游離脂肪酸運輸至肝臟過多,導致TG合成增多,肝臟脂肪蓄積。故本研究選用了OA不飽和脂肪酸誘導人肝癌細胞系BEL-7402建立體外NASH模型。使用不同濃度的OA處理BEL-7402細胞24h后,MTT法檢測細胞活力,采用試劑盒測定細胞內TG的含量。發現當OA濃度達到100μmol/L時,細胞內TG含量最多,細胞生存率高。據文獻報道,加入外源性HSS蛋白可以促進肝細胞增殖,甚至部分逆轉實驗性肝纖維化[9-10]。充分提示HSS是一個促進肝細胞生長的生長因子,同時還能保護肝臟。本研究結果顯示,轉染了HSS的細胞內TG含量明顯減少,用油紅O染色法觀察細胞內脂質堆積減輕。表明HSS對肝細胞脂質損傷起到了保護作用。ALT主要存在于肝細胞的胞質中,當肝細胞受到損傷時,細胞膜通透性增加,大量ALT釋放入細胞外[11]。ALT是臨床上檢驗肝功能是否受損的重要指標。本研究中,檢測細胞漏出的ALT含量發現,OA可以誘導細胞分泌ALT增多,而轉染了HSS細胞中ALT含量比空載體組明顯減少。提示HSS可以維持細胞膜的通透性,使細胞免受脂質損傷。OA誘導細胞發生了細胞凋亡,而轉染HSS后,細胞凋亡減輕。說明HSS可以緩解肝細胞凋亡情況。
綜上所述,在BEL-7402細胞中穩定轉染HSS可以減少肝細胞內脂質的蓄積,保護肝損傷,減輕肝細胞凋亡。而HSS對NASH的保護作用我們也在進一步探索中,其可能機制為HSS通過抑制內質網應激進而減輕肝損傷。這為今后NASH的研究和防治提供了新的思路和依據。
[1] LaBrecque DR, Pesch LA.Preparation and partial characterization of hepatic regenerative stimulator substance(SS)from rat liver[J].J Physiol,1975,248(2):273-284.
[2] Sun GY,Dong LY,An W.Involvement of hepatic stimulator substance in the regulation of hepatoblast maturation into hepatocytes in vitro[J].Stem Cells Dev,2014,23(14):1675-1687.
[3] Jiang SJ,Li W,An W.Adenoviral gene transfer of hepatic stimulator substance confers resistance against hepatic ischemia-reperfusion injury by improving mitochondrial function[J].Hum Gene Ther,2013,24(4):443-456.
[4] Wu Y,Zhang J,Dong L,et al.Hepatic stimulator substance mitigates hepatic cell injury through suppression of the mitochondrial permeability transition[J].FEBS J,2010,277(5):1297-1309.
[5] 馮如剪,馬蕊香,張曉博,等.飲食、運動及聯合早期干預對青年非酒精性脂肪肝的臨床療效觀察[J].河北醫科大學學報,2013,34(11):1432-1435.
[6] 任夢,肖衛純,安威.肝刺激因子在 MCD飲食喂養小鼠非酒精性脂肪性肝炎中的作用[J].中國組織化學與細胞化學雜志,2014,23(5):387-393.
[7] Mehlem A,Hagberg CE,Muhl L,et al.Imaging of neutral lipids by oil red O for analyzing the metabolic status in health and disease[J].Nat Protoc,2013,8(6):1149-1154.
[8] Day CP,James OF.Steatohepatitis:a tale of two"hits"?[J].Gastroenterology,1998,114(4):842-845.
[9] Zhang M,Song G,Minuk GY.Effects of hepatic stimulator substance,herbal medicine,selenium/vitamin E,and ciprofloxacin on cirrhosis in the rat[J].Gastroenterology,1996,110(4):1150-1155.
[10] Gribilas G,Zarros A,Zira A,et al.Involvement of hepatic stimulator substance in experimentally induced fibrosis and cirrhosis in the rat[J].Dig Dis Sci,2009,54(11):2367-2376.
[11] 張子玉,羅文明.超聲檢出脂肪肝與血脂水平及肝功能關系分析[J].臨床薈萃,2012,27(23):2050-2052.

