enJSRV囊膜蛋白及其受體的瞬時表達與綿羊絨毛膜滋養層細胞融合的誘導研究
張宇飛,石 晶,劉淑英,2*
(1.內蒙古農業大學獸醫學院,呼和浩特 010018;2.農業部動物臨床診療技術重點實驗室,呼和浩特 010018)
enJSRV囊膜蛋白及其受體的瞬時表達與綿羊絨毛膜滋養層細胞融合的誘導研究
張宇飛1,石 晶1,劉淑英1,2*
(1.內蒙古農業大學獸醫學院,呼和浩特 010018;2.農業部動物臨床診療技術重點實驗室,呼和浩特 010018)
旨在深入研究內源性綿羊肺腺瘤病毒(enJSRV)囊膜蛋白在綿羊胎盤形成過程中的作用,本研究體外培養了蒙古綿羊絨毛膜滋養層細胞,采用RT-PCR技術擴增出enJSRV-env基因及其受體Hyal2基因全長序列,定向克隆于真核表達載體pEGFP-C1上。優化絨毛膜滋養層細胞電轉染條件和測定電轉效率。將構建好的真核表達質粒分別電轉染到絨毛膜滋養層細胞中,在熒光顯微鏡下觀察enJSRV囊膜蛋白及其受體Hyal2的瞬時表達情況。并研究高表達enJSRV-env基因及通過RNA干擾沉默enJSRV-env基因對絨毛膜滋養層細胞的細胞融合活性的影響。結果顯示,真核表達質粒構建成功,分別命名為pEGFP-C1/enJSRV-env及pEGFP-C1/Hyal2。研究表明,綿羊絨毛膜滋養層細胞最佳電轉染條件為脈沖電壓150 V,脈沖時間5.0 ms,電擊2次,間隔50 ms。轉染pEGFP-C1/enJSRV-env質粒及pEGFP-C1/enJSRV-env與pEGFP-C1/Hyal2共轉染的綿羊絨毛膜滋養層細胞中多核細胞數目明顯增加,平均每個視野分別可以觀察到1.8和2.3個多核細胞。說明enJSRV-env對絨毛膜滋養層細胞的細胞融合有一定的促進作用。本研究為進一步探究enJSRV囊膜蛋白的結構和功能及絨毛膜滋養層細胞融合機理提供試驗基礎。
內源性綿羊肺腺瘤病毒;內源性逆轉錄病毒;囊膜蛋白;絨毛膜滋養層細胞;細胞融合
內源性逆轉錄病毒(Endogenous retrovirus,ERVs)在數百萬年前整合到哺乳動物基因組中[1-2],并遵照孟德爾法則遺傳給下一代[2]。ERVs被認為是古代的外源性逆轉錄病毒感染宿主進化后形成的[2-3]。ERVs已經大量地侵入到所有動物的基因組中。在人類基因組中約占8%[4],牛的基因組約占18%[5]。完整的ERV與外源性逆轉錄病毒共享基因組結構,包含4個基因,分別為gag、pro、pol和env,兩側是長末端重復序列(LTR)[2,6]。在綿羊的基因組中至少包含有27個拷貝的ERVs,且與外源性綿羊肺腺瘤病毒(Exogenous jaagsiekte sheep retrovirus,exJSRV)高度相似,將其命名為內源性綿羊肺腺瘤病毒(enJSRVs)[2,7]。exJSRV是綿羊傳染性肺腫瘤性疾病的病原[8],屬β-逆轉錄病毒。exJSRV與其它致癌逆轉錄病毒不同之處:它的囊膜糖蛋白(ENV)是體內和體外誘導細胞發生轉化的主要因素[9]。有研究發現,enJSRV在母羊生殖道上皮細胞內大量且特異性表達,對生殖發育及抵御外源性逆轉錄病毒的侵入可能發揮重要作用[10-11]。目前眾多學者認為,綿羊單核滋養外胚層細胞(Mononuclear trophoblastic cell,MTC)在enJSRV囊膜蛋白及其受體透明質酸酶2(Hyaluronidases 2,Hyal2)的相互作用下分化、移行,之后通過核內復制或融合作用形成滋養外胚層巨型雙核細胞,繼續融合形成多核合胞體,最終形成胎盤的子葉[2,11-14]。這也說明綿羊內源性反轉錄病毒enJSRV囊膜蛋白在妊娠過程中可能發揮了重要作用。
本研究采用RT-PCR技術從蒙古綿羊絨毛膜滋養層細胞中擴增出enJSRV-env及Hyal2基因全長,同時定向克隆于真核表達載體pEGFP-C1上。由于前期研究發現原代培養的絨毛膜滋養層細胞利用脂質體進行轉染的轉染效率較低[11],所以筆者優化了絨毛膜滋養層細胞電轉染條件,并測定了電轉效率。將構建好的融合蛋白真核表達質粒分別電轉染到絨毛膜滋養層細胞中瞬時表達。同時在熒光顯微鏡下觀察高表達enJSRV-env基因及通過RNA干擾沉默enJSRV-env基因的絨毛膜滋養層細胞的細胞融合情況,通過統計學方法分析細胞核數量變化情況。為進一步探討enJSRV囊膜蛋白的結構和功能及其細胞融合機理提供研究基礎。
1 材料與方法
1.1 試驗動物與樣品的采集
妊娠中期蒙古羊的胎盤絨毛膜組織由內蒙古呼和浩特市屠宰場提供。
1.2 主要試劑
DMEM高糖培養基、胰蛋白酶從HyClone公司購買;胎牛血清(Gibco公司);PrimeScript One Script RT-PCR Kit Ver.2試劑盒(大連寶生物工程有限公司);Phusion高保真DNA聚合酶(Thermo公司);質粒小提、凝膠回收及RNA提取試劑盒(天根生化科技(北京)有限責任公司);pEGFP-C1真核表達載體(Invitrogen公司);E.coliDH5α感受態細胞(天根生化科技(北京)有限責任公司)[11,15]。
1.3 綿羊絨毛膜滋養層細胞培養
取妊娠44~50 d、正常的新鮮子宮體,快速送到實驗室。用70%酒精清洗整個子宮,用鑷子將6~7個與母體肉阜相連的胚胎子葉分開并剪下,用含雙抗的D-PBS清洗6~8遍。用眼科剪充分剪碎絨毛組織成糊狀。以0.25%胰蛋白酶液與0.1%膠原酶Ⅰ液(含0.1 g膠原酶Ⅰ的100 mL PBS用0.22 μm的過濾器除菌),于37 ℃恒溫水浴鍋內消化30 min,200目篩網過濾后,將濾液800 r·min-1離心10 min,用完全培養基(80 mL高糖DMEM培養基中加入20 mL FBS和1 mL雙抗)重懸,將終濃度為1×105mL-1細胞接種于培養瓶內[2,16-17]。
1.4 引物設計
根據enJSRV的全基因組序列(No.:AF153615),利用Primer Primer 5.0軟件,在囊膜基因區域設計1對enJSRV-env的引物(預期擴增產物大小1 836 bp)。上下游引物分別加入酶切位點KpnⅠ和BamH Ⅰ。引物:上游引物(env-GFPU):5′-AAGGTACCATGCCGAAGCGCCG-3′,下游引物(env-GFPL):5′-AAGGATCCTCACGGGTCG-TCCC-3′。根據Hyal2的mRNA序列(No.:NM_001009754.1),利用Primer Primer 5.0軟件,在Hyal2基因區域設計1對引物(預期擴增產物大小1 443 bp)。上下游引物分別加入酶切位點HindⅢ和BamHI。引物:上游引物(Hyal2-GFPU):5′-TTAAGCTTCGATGTGGACAGG-3′,下游引物(Hyal2-GFPL):5′-AAGGATCCTTACGAAGTCCAGGTG-3′。引物在Invitrogen公司合成。
1.5 總RNA的提取與處理
當綿羊絨毛膜滋養層細胞匯合度為70%~80%時,按照微量RNA提取試劑盒說明書,提取細胞總RNA,利用分光光度計和1.0%變性瓊脂糖凝膠電泳檢測RNA的純度及完整性。利用TaKaRa公司的PrimeScript One Script RT-PCR Kit Ver.2試劑盒將總RNA反轉錄為cDNA,-20 ℃保存備用[2,11]。
1.6 enJSRV-env及Hyal2基因的擴增
以cDNA為模板,使用引物env-GFPU、env-GFPL、Hyal2-GFPU、Hyal2-GFPL和Phusion高保真DNA聚合酶,按常規方法進行PCR擴增。反應條件:98 ℃ 5 min;98 ℃ 30 s,63 ℃ 30 s,72 ℃ 2 min,35個循環;72 ℃ 10 min。PCR擴增產物經瓊脂糖凝膠電泳鑒定[15]。
1.7 pEGFP-C1/enJSRV-env及pEGFP-C1/Hyal2真核表達質粒的構建
上述PCR產物分別經1.0%的瓊脂糖凝膠電泳鑒定并回收。利用限制性內切酶KpnⅠ和BamH Ⅰ對純化后的enJSRV-env基因與真核表達載體pEGFP-C1同時進行雙酶切,瓊脂糖凝膠電泳鑒定并回收。同時利用限制性內切酶HindⅢ和BamH Ⅰ對純化后的Hyal2基因與真核表達載體pEGFP-C1同時進行雙酶切并回收。回收后的目的基因片段和經同樣雙酶切的真核表達載體pEGFP-C1進行連接并轉化。提取重組質粒后,用PCR、單雙酶切鑒定,連接成功后將陽性菌液送到Invitrogen公司測序。測序鑒定正確后用去內毒素質粒中提試劑盒提取質粒[15]。所得到的重組真核表達質粒分別命名為pEGFP-C1/enJSRV-env和pEGFP-C1/Hyal2。
1.8 綿羊絨毛膜滋養層細胞電轉染效率的測定
將培養第7天的原代綿羊絨毛膜滋養層細胞,采用0.25%的胰酶消化得到單個細胞。用預熱的Opti-MEM培養液清洗細胞兩次,將密度調整為1×107mL-1。取100 μL細胞懸液(約1×106個細胞)并加入10 μg pEGFP-C1質粒DNA輕輕混勻,轉移到0.1 cm的電擊杯中。按照NEPA21高效基因轉染系統說明書設置電轉參數,電轉完成后將細胞懸液接種到含有預熱的完全培養基的6孔板內,48 h后觀察綠色熒光蛋白表達情況。為篩選原代綿羊絨毛膜滋養層細胞的最優電轉染條件,先按照NEPA21高效基因轉染系統說明書內12套電轉參數(表1),進行電轉染,通過熒光顯微鏡下計數法來確定不同電轉條件下細胞轉染率。細胞轉染率=(發綠色熒光的細胞數/存活細胞數)×100%。篩選出最優條件后,用于后續試驗。
1.9 pEGFP-C1/enJSRV-env及pEGFP-C1/Hyal2在綿羊絨毛膜滋養層細胞中的瞬時表達
待原代綿羊絨毛膜滋養層細胞生長至70%~80%時,按照最優電轉染條件分別轉染真核表達質粒pEGFP-C1/enJSRV-env及pEGFP-C1/Hyal2。同時設立空質粒pEGFP-C1轉染的細胞作為陰性對照。轉染48 h后,4%的多聚甲醛固定,DAPI染細胞核,在熒光顯微鏡下觀察enJSRV 囊膜蛋白及受體透明質酸酶2(Hyal2)在原代綿羊絨毛膜滋養層細胞的表達情況[15]。
1.10 enJSRV-env基因在綿羊絨毛膜滋養層細胞中表達上調及下調后細胞融合情況
按照最優電轉染條件,將真核表達質粒pEGFP-C1/enJSRV-env、pEGFP-C1/Hyal2、pcDNA6.2-GW/EmGFP-miR/enJRSV-env-shRNA分別轉入對數生長期的原代綿羊絨毛膜滋養層細胞中[11]。同時將pEGFP-C1/enJSRV-env與pEGFP-C1/Hyal2共轉染到對數生長期的原代綿羊絨毛膜滋養層細胞中。將空質粒pEGFP-C1轉染的原代綿羊絨毛膜滋養層細胞作為陰性對照。電轉染后將細胞接種到含有蓋玻片的6孔板內。48 h后,利用4%的多聚甲醛固定細胞,DAPI染細胞核,在熒光顯微鏡下觀察并記錄綿羊絨毛膜滋養層雙核及多核細胞的數目[15]。隨機取5個視野進行計數,采用算術均值進行統計。
表1 12套電轉參數
Table 1 Twelve sets of electroporation parameters used in the experiment
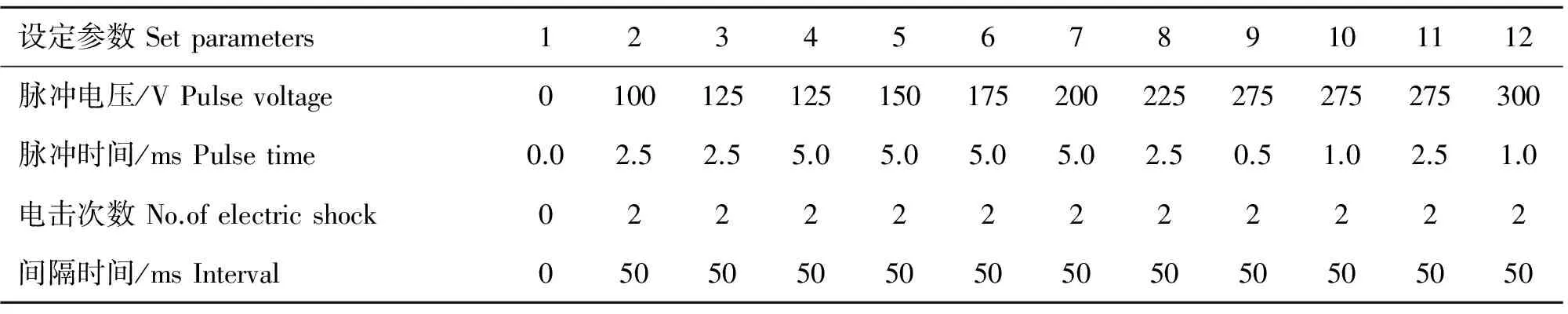
設定參數Setparameters123456789101112脈沖電壓/VPulsevoltage0100125125150175200225275275275300脈沖時間/msPulsetime0.02.52.55.05.05.05.02.50.51.02.51.0電擊次數No.ofelectricshock022222222222間隔時間/msInterval05050505050505050505050
2 結 果
2.1 enJSRV-env及Hyal2基因的擴增
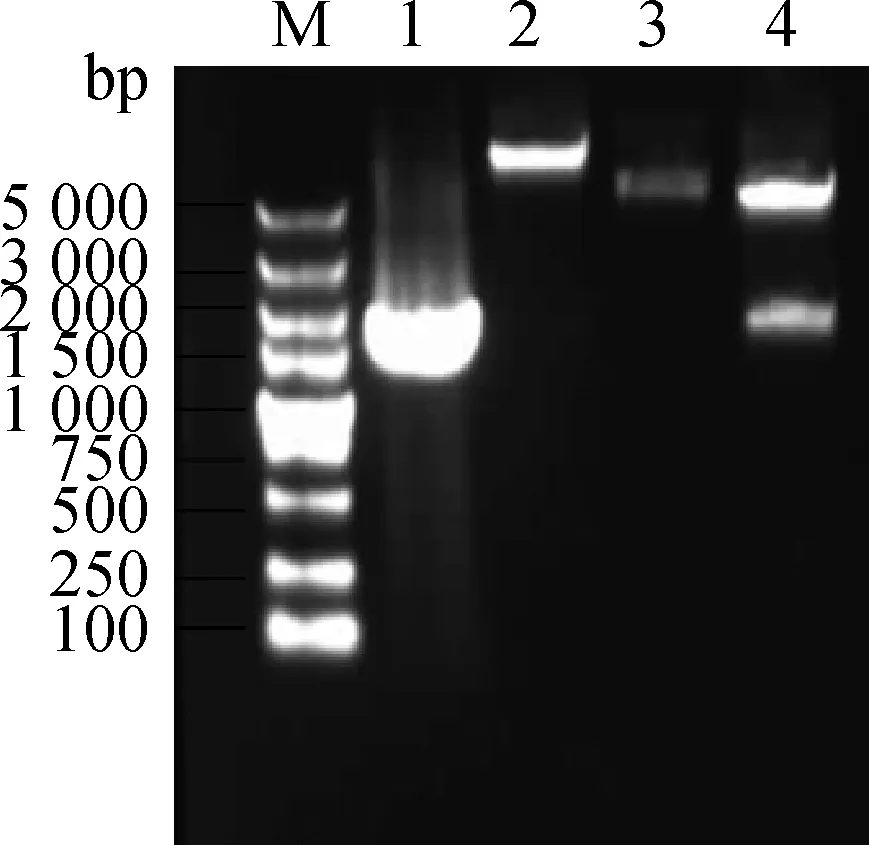
RT-PCR擴增的產物分別經1%瓊脂糖凝膠電泳顯示,在約1 836與1 443 bp處分別有一明顯擴增條帶,與預期的目的基因enJSRV-env及Hyal2大小一致(圖1)。

M.DNA相對分子質量標準;1.enJSRV-env基因擴增產物;2.Hyal2基因擴增產物M.DNA marker;1.PCR product of enJSRV-env;2.PCR product of Hyal2圖1 enJSRV-env和Hyal2基因的擴增Fig.1 Amplification of enJSRV-env and Hyal2 genes
2.2 真核表達質粒pEGFP-C1/enJSRV-env及pEGFP-C1/Hyal2的構建與鑒定
將經PCR擴增的目的基因enJSRV-env與真核細胞表達載體pEGFP-C1分別利用限制性內切酶KpnⅠ和BamH Ⅰ進行雙酶切。利用T4 DNA連接酶過夜連接,構建重組質粒pEGFP-C1/enJSRV-env。經PCR、BamH Ⅰ單酶切、KpnⅠ和BamH Ⅰ雙酶切鑒定結果(圖2)顯示pEGFP-C1/enJSRV-env質粒構建初步成功,然后進一步進行核苷酸序列測定,結果顯示插入pEGFP-C1的enJSRV-env基因的讀碼框架和插入方向均正確。
將PCR擴增的目的基因Hyal2與真核細胞表達載體pEGFP-C1分別用限制性內切酶HindⅢ和BamH Ⅰ進行雙酶切。利用T4 DNA連接酶過夜連接,構建重組質粒pEGFP-C1/Hyal2。經PCR、BamH Ⅰ單酶切、Hind Ⅲ和BamH Ⅰ雙酶切鑒定結果(圖3),表明pEGFP-C1/Hyal2質粒構建初步成功,然后進一步進行核苷酸序列測定,結果顯示插入pEGFP-C1的Hyal2基因的讀碼框架和插入方向均正確。
M.DNA相對分子質量標準(DL5000);1.enJSRV-env基因擴增產物;2.BamH Ⅰ單酶切pEGFP-C1/enJSRV-env重組質粒;3.BamH Ⅰ單酶切pEGFP-C1空質粒;4.BamH Ⅰ和Kpn Ⅰ雙酶切pEGFP-C1/enJSRV-env重組質粒M.DNA marker(DL5000);1.PCR product of enJSRV-env;2.Digested product of pEGFP-C1/enJSRV-env with BamH Ⅰ;3.Digested product of pEGFP-C1 with BamH Ⅰ;4.Digested product of pEGFP-C1/enJSRV-env with BamH Ⅰ and Kpn Ⅰ圖2 重組質粒pEGFP-C1/enJSRV-env單雙酶切鑒定Fig.2 Identification of recombinant plasmid pEGFP-C1/enJSRV-env by single and double restriction endonuclease digestion

M.DNA相對分子質量標準(DL7000);1.BamHⅠ單酶切pEGFP-C1空質粒; 2.BamHⅠ單酶切pEGFP-C1/Hyal2重組質粒;3.BamH Ⅰ和Hind Ⅲ雙酶切pEGFP-C1/Hyal2重組質粒;4.Hyal2基因擴增產物M.DNA marker(DL7000);1.Digested product of pEGFP-C1 with BamH Ⅰ;2.Digested product of pEGFP-C1/Hyal2 with BamH Ⅰ;3.Digested product of pEGFP-C1/Hyal2 with BamH Ⅰ and Hind Ⅲ;4.PCR product of Hyal2圖3 重組質粒pEGFP-C1/Hyal2單雙酶切鑒定Fig.3 Identification of recombinant plasmid pEGFP-C1/Hyal2 by single and double restriction endonuclease digestion
2.3 綿羊絨毛膜滋養層細胞電轉染條件的確立
按照NEPA21高效基因轉染系統說明書內12套電轉染參數進行電轉染,電轉染完成后將細胞懸液接種到含有預熱的完全培養基的6孔板內,48 h后觀察綠色熒光蛋白表達情況,通過熒光顯微鏡下計數,確定不同電轉條件下的細胞轉染率。程序1為對照組,加入10 μg pEGFP-C1質粒DNA,但不進行電轉染(圖4A和4B)。隨著脈沖電壓的增大,細胞轉染效率不斷升高,同時細胞死亡率也在增高。在程序5(脈沖電壓150 V,脈沖時間5.0 ms,電擊次數2次,間隔時間50 ms)時綿羊絨毛膜滋養層細胞的電轉染效率最高,約87.53%(圖4C和4D)。再增加脈沖電壓后細胞的死亡率達到60%以上(圖4E和4F),故將程序5定為綿羊絨毛膜滋養層細胞的最佳電轉染條件,用于后續試驗。
2.4 enJSRV-env及Hyal2在綿羊絨毛膜滋養層細胞中瞬時表達
將轉染重組質粒pEGFP-C1/enJSRV-env、pEGFP-C1/Hyal2和對照空載體pEGFP-C1 48 h后的綿羊絨毛膜滋養層細胞用4%的多聚甲醛固定及DAPI染細胞核。熒光顯微鏡下發現轉染pEGFP-C1空質粒的細胞在細胞質和細胞核內都有大片的綠色熒光(圖5A3);轉染pEGFP-C1/enJSRV-env質粒的細胞質內有彌散的綠色熒光,在細胞膜上圍繞一圈淺綠色熒光,細胞核中有少量的綠色熒光顯現(圖5B3);轉染pEGFP-C1/Hyal2質粒的細胞質內有彌散的點狀綠色熒光(圖5C3)。表明enJSRV-env在綿羊絨毛膜滋養層細胞表達后,囊膜蛋白主要分布于細胞膜和細胞質內,而受體透明質酸酶2主要分布于細胞質內的細胞器上。
2.5 enJSRV-env及Hyal2在綿羊絨毛膜滋養層細胞融合過程中的作用
將真核表達質粒pEGFP-C1/enJSRV-env、pEGFP-C1/Hyal2、pcDNA6.2-GW/EmGFP-miR /enJRSV-env-shRNA按照最佳電轉染條件分別轉入對數生長期的原代綿羊絨毛膜滋養層細胞中。轉染48 h后,用4%的多聚甲醛固定后再用DAPI進行細胞核染色。結果在熒光顯微鏡下可以觀察到雙核滋養層細胞(圖6A3)、三核滋養層細胞(圖6B3)、多核滋養層細胞(圖6C3)。在熒光顯微鏡下分別取10個視野觀察綿羊三核和多核絨毛膜滋養層細胞的個數,發現轉染pEGFP-C1/enJSRV-env及pEGFP-C1/enJSRV-env與pEGFP-C1/Hyal2共轉染的綿羊絨毛膜滋養層細胞中多核細胞數目明顯增加,平均每個視野分別可以觀察到1.8和2.3個多核細胞。然而轉染pEGFP-C1、pEGFP-C1/Hyal2及pcDNA6.2-GW/EmGFP-miR/enJRSV-env-shRNA干擾質粒的綿羊絨毛膜滋養層細胞中多核細胞數變化不明顯,平均每個視野分別可以觀察到0.5、0.5和0.4個多核細胞(圖7)。
3 討 論
由于內源性逆轉錄病毒顆粒常常在生殖道和胎盤中觀察到,S.S.Kalter等[18]推測ERVs在合體滋養層細胞形成上發揮重要的生理作用。ERVs已確定在靈長類動物[19](合胞體蛋白-1和-2)、鼠科[20](合胞體蛋白-A,-B)、兔[21](合胞體蛋白-Ory1)胎盤中存在。在人類和小鼠的合胞體蛋白(人類合胞體蛋白-1和小鼠合胞體蛋白-A)都能夠誘導細胞發生融合[2,22-23]。同樣在母羊的生殖道不同組織上皮中大量表達enJSRV,如在子宮內膜腔上皮和腺上皮中可檢測到enJSRV mRNA[24]和蛋白[25]。在母羊整個妊娠期內,胎盤的滋養外胚層巨型雙核細胞、滋養層多核合胞體與滋養層小半鞘翅也大量表達enJSRV[2,26]。enJSRV完整的囊膜基因在胎盤多核合體滋養層細胞中表達,已有幾千年的歷史了[2,11,27]。根據合胞體蛋白在體外誘導的細胞融合的特性,有學者提出enJSRV囊膜蛋白及其受體透明質酸酶2共同誘導綿羊胎盤多核合體滋養細胞形成假說。為了驗證這一假說的真實性,筆者通過體外培養綿羊絨毛膜滋養層細胞,并從中克隆內源性綿羊肺腺瘤病毒囊膜基因及其受體透明質酸酶2基因進行功能研究。本研究發現轉染pEGFP-C1/enJSRV-env質粒及pEGFP-C1/enJSRV-env與pEGFP-C1/Hyal2共轉染的綿羊絨毛膜滋養層細胞中多核細胞數目明顯增加,而且pEGFP-C1/enJSRV-env與pEGFP-C1/Hyal2共轉染的綿羊絨毛膜滋養層細胞中多核細胞數目要比單獨轉染pEGFP-C1/enJSRV-env質粒的綿羊絨毛膜滋養層細胞中多核細胞數目多,這說明enJSRV囊膜蛋白與其受體透明質酸酶2共同作用促進多核絨毛膜滋養層細胞的形成。同時筆者也發現多核絨毛膜滋養層細胞要比單核及雙核的絨毛膜滋養層細胞體積大而且呈圓形。然而轉染pEGFP-C1/Hyal2質粒的綿羊絨毛膜滋養層細胞中多核細胞數目沒有變化,這也說明受體透明質酸酶2本身并不促進綿羊絨毛膜滋養層細胞融合。轉染pcDNA6.2-GW/EmGFP-miR/enJRSV-env-shRNA干擾質粒的綿羊絨毛膜滋養層細胞中多核細胞數變化不明顯與轉染空質粒的綿羊絨毛膜滋養層細胞基本相似。這一結果說明RNA干擾試驗不在細胞核計數方法的靈敏度范圍內,故不能夠很好的檢測到細胞融合活性的降低。本研究的結論為K.A.Dunlap等[12]提出的enJSRV囊膜蛋白及其受體透明質酸酶2共同誘導綿羊胎盤多核合體滋養細胞形成的假說提供有力的理論依據,但enJSRV囊膜蛋白及其受體透明質酸酶2共同誘導綿羊胎盤多核合體滋養細胞形成的機理還需要后續深入的研究。由于胎盤的形成與腫瘤的發生和轉移的特點類似,而且enJSRV囊膜蛋白與致癌的外源性JSRV 囊膜蛋白具有高度相似性,同時JSRV與enJSRVs使用相同的受體透明質酸酶2進入細胞[11,15]。故C.Ferretti等[28]推測,內源性JSRV 囊膜蛋白利用同外源性JSRV 囊膜蛋白相似的機制,促使滋養層細胞增殖和分化。滋養層細胞比一般細胞具有較高的增殖、轉移和侵入的能力,同時也可以躲避機體的免疫系統,這也是腫瘤細胞的特性。JSRV囊膜蛋白主要通過Ras-MEK-MAPK、Rac1和PI3K-AKT-mTOR 3條信號通路,使綿羊肺泡Ⅱ型上皮細胞和細支氣管Clara細胞發生癌變[28-29]。Ras-MEK-MAPK、Rac1和PI3K-AKT-mTOR信號通路是在人類和嚙齒類動物胎盤滋養層細胞生長和分化的重要調節通路[2,28,30]。但迄今仍沒有充分的證據證明enJSRV囊膜蛋白通過Ras-MEK-MAPK、Rac1和PI3K-AKT-mTOR 3條信號通路來促使滋養層細胞的生長和分化[2]。

A、C、E為電轉染48 h后綿羊絨毛膜滋養層細胞的相差顯微鏡照片;B、D、F為轉染后表達綠色熒光蛋白的細胞A,C and E are transfected sheep trophoblast cells by electroporation after 48 h observed under phase contrast;B,D,F are transfected cells which expressing green fluorescent protein圖4 電轉染pEGFP-C1后的綿羊絨毛膜滋養層細胞100×Fig.4 The ovine trophoblast cells after electric transfected with pEGFP-C1 100×

A1~A3.綿羊絨毛膜滋養層細胞轉染pEGFP-C1后熒光顯微鏡照片(A1.DAPI染核,A2.GFP綠色熒光,A3.重疊后照片);B1~B3.綿羊絨毛膜滋養層細胞轉染pEGFP-C1/enJSRV-env后熒光顯微鏡照片(B1.DAPI染核,B2.GFP/enJSRV-env融合蛋白綠色熒光,B3.重疊后照片);C1~C3.綿羊絨毛膜滋養層細胞轉染pEGFP-C1/ Hyal2后熒光顯微照片(C1.DAPI染核,C2.GFP/Hyal2融合蛋白綠色熒光,C3.重疊后照片)A1-A3.The sheep trophoblast cells transfected with pEGFP-C1(A1.Cell stained with DAPI,A2.Expression of EGFP,A3.Merge);B1-B3.The sheep trophoblast cells transfected with pEGFP-C1/enJSRV-env(B1.Cell stained with DAPI,B2.Expression of GFP/enJSRV-env,B3.Merge);C1-C3.The sheep trophoblast cells transfected with pEGFP-C1/Hyal2(C1.Cell stained with DAPI,C2.Expression of GFP/Hyal2,C3.Merge)圖5 enJSRV-env及Hyal2在綿羊絨毛膜滋養層細胞中瞬時表達 200×Fig.5 Transient expressions of enJSRV-env and Hyal2 gene in ovine trophoblast cells 200×

A1、B1、C1.DAPI染核;A2、B2、C2.GFP綠色熒光;A3、B3、C3.重疊后照片A1,B1,C1.Cell stained with DAPI;A2,B2,C2.Expression of GFP;A3,B3,C3.Merge圖6 熒光顯微鏡下觀察綿羊雙核及多核絨毛膜滋養層細胞 200×Fig.6 Bi-and multi-nucleated trophectoderm cells in sheep observed under fluorescence microscope 200×
本研究結果表明,轉染pEGFP-C1/Hyal2的絨毛膜滋養層細胞的細胞質內有彌散的點狀的綠色熒光,且主要集中在細胞核周邊。瞬時表達EGFP-enJSRV-env融合蛋白的絨毛膜滋養層細胞的細胞質內有彌散的綠色熒光,在細胞膜上圍繞一圈淺綠色熒光,細胞核中有少量的綠色熒光顯現,說明JSRV囊膜蛋白定位于細胞膜與細胞核上,這與筆者之前研究的exJSRV囊膜蛋白亞細胞定位結果相同[15]。因為enJSRV囊膜蛋白與致癌的外源性JSRV 囊膜蛋白具有高度相似性[11,15]。ERVs的生物學意義進行了幾十年的辯論,通常被認為是“垃圾DNA”,因為ERVs由于突變、缺失、重排、甲基化的積累導致他們不健全的復制機制[2,31]。然而,最近的研究表明,ERVs部分基因對他們的宿主有多種有益的作用[32]。此外,ERVs部分基因保持了完整的開放閱讀框(ORF),且具有轉錄活性,這支持了宿主通過特定的生物學功能征用了一些ERVs的想法[33]。由于在綿羊的基因組中至少包含有27個拷貝的enJSRV[7,34],故綿羊成為理想的動物模型來研究ERVs的生物學作用。本研究以綿羊絨毛膜滋養層細胞為基礎克隆且表達了enJSRV-env及其受體Hyal2,同時證實了內源性綿羊肺腺瘤病毒囊膜蛋白在綿羊絨毛膜滋養層細胞融合過程可以起到一定的促進作用。

**.P<0.01。1.pEGFP-C1;2.pEGFP-C1/enJSRV-env;3.pEGFP-C1/Hyal2;4.pEGFP-C1/enJSRV-env與pEGFP-C1/Hyal2共轉染;5.pcDNA6.2-GW/EmGFP-miR/enJRSV-env-shRNA**.P<0.01.1.Trophoblast cells transfected with pEGFP-C1 plasmids;2.Trophoblast cells transfected with pEGFP-C1/enJSRV-env plasmids;3.Trophoblast cells transfected with pEGFP-C1/Hyal2 plasmids;4.Trophoblast cells co-transfected with pEGFP-C1/enJSRV-env and pEGFP-C1/Hyal2 plasmids;5.Trophoblast cells transfected with pcDNA6.2-GW/EmGFP-miR/enJRSV-env-shRNA plasmids圖7 綿羊絨毛膜滋養層細胞轉染不同質粒后多核絨毛膜滋養層細胞的數目Fig.7 The number of multinucleated trophectoderm cells which ovine trophoblast cells transfected with different plasmids
[1] SHARP J M,DE MARTINI J C.Natural history of JSRV in sheep[J].CurrTopMicrobiolImmunol,2003,275:55-79.
[2] 張宇飛,王專家,劉淑英,等.綿羊多核絨毛膜滋養層細胞中enJSRV-env克隆與生物信息學分析[J].科技論文在線,2014:201309-245. ZHANG Y F,WANG Z J,LIU S Y,et al.Cloning and bioinformatics analysis of enJSRV-env gene of sheep multinucleated syncytiotrophoblast cells[J].SciencepaperOnline,2014:201309-245.(in Chinese)
[3] GIFFORD R,TRISTEM M.The evolution,distribution and diversity of endogenous retroviruses[J].VirusGenes,2003,26(3):291-315.
[4] LANDER E S,LINTON L M,BIRREN B,et al.Initial sequencing and analysis of the human genome[J].Nature,2001,409(6822):860-921.
[5] ADELSON D L,RAISON J M,EDGAR R C.Characterization and distribution of retrotransposons and simple sequence repeats in the bovine genome[J].ProcNatlAcadSciUSA,2009,106(31):12855-12860.
[6] SPENCER T E,PALMARINI M.Application of next generation sequencing in mammalian embryo genomics:lessons learned from endogenous betaretroviruses of sheep[J].AnimReprodSci,2012,134(1-2):95-103.[7] QI J W,XU M J,LIU S Y,et al.Identification of sheep endogenous beta-retroviruses with uterus-specific expression in the pregnant Mongolian ewe[J].JIntegrAgr,2013,12(5):884-891.
[8] PALMARINI M,SHARP J M,FAN H,et al.Jaagsiekte sheep retrovirus is necessary and sufficient to induce a contagious lung cancer in sheep[J].JVirol,1999,73(8):6964-6972.
[9] ALLEN T E,SHERRILL K J,CRISPELL S M,et al.The jaagsiekte sheep retrovirus envelope gene induces transformation of the avian fibroblast cell line DF-1 but does not require a conserved SH2 binding domain[J].JGenVirol,2002,83(11):2733-2742.
[10] 劉麗珍,劉淑英.妊娠早期蒙古綿羊子宮內膜enJSRV及IFN-τ基因表達水平的分析[J].畜牧獸醫學報,2012,43(6):979-984. LIU L Z,LIU S Y.Analysis of the expression of enJSRV and IFN-τin endometrium of mongolian sheep in early pregnancy[J].ActaVeterinariaetZootechnicaSinica,2012,43(6):979-984.(in Chinese)
[11] 張宇飛,劉 月,劉淑英,等.靶向enJSRV-env基因shRNA真核表達質粒的構建及其干擾效率的測定[J].中國獸醫科學,2013,43(1):53-59. ZHANG Y F,LIU Y,LIU S Y,et al.Construction of short hairpin RNA eukaryotic expression plasmids targeting enJSRV-envgene and interference efficiency detection[J].ChineseVeterinaryScience,2013,43(1):53-59.(in Chinese)
[12] DUNLAP K A,PALMARINI M,SPENCER T E.Ovine endogenous betaretroviruses(enJSRVs) and placental morphogenesis[J].Placenta,2006,27(20):135-140.
[13] 徐萌杰,陳大勇,劉淑英.妊娠綿羊子宮內膜組織內源性反轉錄病毒及其受體HYAL2基因表達水平的檢測[J].中國獸醫科學,2011,41(3):256-261. XU M J,CHEN D Y,LIU S Y.Detection of expression level of endogenous jaagsiekte sheep retrovirus and its receptor HYAL2 in endometrium of pregnant Mongolian sheep by TaqMan real-time PCR andinsituhybridization[J].ChineseVeterinaryScience,2011,41(3):256-261.(in Chinese)
[14] SPENCER T E,JOHNSON G A,BAZER F W,et al.Pregnancy recognition and conceptus implantation in domestic ruminants:roles of progesterone,interferons and endogenous retroviruses[J].ReprodFertilDev,2007,19(1):65-78.
[15] 張宇飛,劉 月,劉淑英,等.綿羊肺腺瘤病毒pEGFP-C1/exJSRV-env構建及引起NIH3T3細胞惡性轉化的研究[J].病毒學報,2014,30(3):268-276. ZHANG Y F,LIU Y,LIU S Y,et al.Construction and transfection of pEGFP-C1/exJSRV-env into NIH3T3 and research on its cellular localization[J].ChineseJournalofVirology,2014,30(3):268-276.(in Chinese)
[16] 劉 慧,劉淑英,劉麗珍,等.綿羊胎盤滋養層細胞的體外培養與鑒定[J].中國獸醫科學,2012,42(3):309-313. LIU H,LIU S Y,LIU L Z,et al.Culture and identification of sheep trophoblast cellsinvitro[J].ChineseVeterinaryScience,2012,42(3):309-313.(in Chinese)
[17] 王專家,張宇飛,劉淑英.綿羊多核絨毛膜滋養層細胞的分離培養與鑒定[J].細胞與分子免疫學雜志,2014,30(1):82-86. WANG Z J,ZHANG Y F,LIU S Y.Isolation,culture and identification of sheep multinucleated chorionic trophoblast cells[J].ChineseJournalofCellularandMolecularImmunology,2014,30(1):82-86.(in Chinese)
[18] KALTER S S,HEBERLING R L,HELMKE R J,et al.A comparative study on the presence of C-type viral particles in placentas from primates and other animals[J].BiolHaematol,1975(40):391-401.
[19] BLOND J L,LAVILLETTE D,CHEYNET V,et al.An envelope glycoprotein of the human endogenous retrovirus HERV-W is expressed in the human placenta and fuses cells expressing the type D mammalian retrovirus receptor[J].JVirol,2000,74(7):3321-3329.
[20] DUPRESSOIR A,MARCEAU G,VERNOCTHET C,et al.Syncytin-A and syncytin-B,two fusogenic placenta-specific murine envelope genes of retroviral origin conserved in Muridae[J].ProcNatlAcadSciUSA,2005,102(3):725-730.
[21] HEIDMANN O,VERNOCHET C,DUPRESSOIR A,et al.Identification of an endogenous retroviral envelope gene with fusogenic activity and placenta-specific expression in the rabbit:a new “syncytin” in a third order of mammals[J].Retrovirology,2009,6(1):107-118.
[22] WATSON E D,CROSS J C.Development of structures and transport functions in the mouse placenta[J].Physiology,2005,20(3):180-193.
[23] MANGENEY M,RENARD M,BOUALLAGA I,et al.Placental syncytins:genetic disjunction between the fusogenic and immunosuppressive activity of retroviral envelope proteins[J].ProcNatlAcadSciUSA,2007,104(51):20534-20539.
[24] 吳曉莉,齊景偉,劉淑英,等.Real-time PCR和組織原位雜交法檢測enJSRV在綿羊胎兒免疫器官及肺臟中的表達[J].畜牧獸醫學報,2010,41(8):1018-1023. WU X L,QI J W,LIU S Y,et al.Expression of enJSRV in immune organs and lung of the fetus by in situ hybridization and real-time PCR[J].ActaVeterinariaetZootechnicaSinica,2010,41(8):1018-1023.(in Chinese)
[25] PALMARINI M,GRAY C A,FAN H,et al.Expression of endogenous betaretroviruses in the ovine uterus:effects of neonatal age,estrous cycle,pregnancy and progesterone[J].JVirol,2001,75(23):11319-11327.
[26] DUNLAP K A,PALMARINI M,SPENCER T E,et al.Sheep endogenous betaretroviruses(enJSRVs) and the hyaluronidase 2(HYAL2) receptor in the ovine uterus and conceptus[J].BiolReprod,2005,73(2):271-279.
[27] SPENCER T E,MURA M,GRAY C A,et al.Receptor usage and fetal expression of ovine endogenous betaretroviruses:implications for coevolution of endogenous and exogenous retroviruses[J].JVirol,2003,77(1):749-753.
[28] FERRETTI C,BRUNI L,BELLET D,et al.Molecular circuits shared by placental and cancer cells,and their implications in the proliferative,invasive and migratory capacities of trophoblasts[J].HumReprodUpdate,2007,13(2):121-141.
[29] 張亞坤,劉淑英.綿羊肺腺瘤病毒囊膜蛋白的致癌作用研究進展[J].中國獸醫科學,2012,42(12):1315-1320. ZHANG Y K,LIU S Y.Research progress in tumorigenesis of Jaagsiekte sheep retrovirus’ envelope protein[J].ChineseVeterinaryScience,2012,42(12):1315-1320.(in Chinese)
[30] POLLHEIMER J,KNOFLER M.Signalling pathways regulating the invasive differentiation of human trophoblasts:a review[J].Placenta,2005,26:S21-S30.
[31] BOCK M,STOYE J P.Endogenous retroviruses and the human germline[J].CurrOpinGenetDev,2000,10(6):651-655.
[32] JERN P,COFFIN J M.Effects of retroviruses on host genome function[J].AnnuRevGenet,2008,42:709-732.[33] KURTH R,BANNERT N.Beneficial and detrimental effects of human endogenous retroviruses[J].IntJCancer,2010,126(2):306-314.
[34] ARNAUD F,CAPORALE M,VARELA M,et al.A paradigm for virus-host coevolution:sequential counter-adaptations between endogenous and exogenous retroviruses[J].PLoSPathog,2007,3(11):1716-1729.
(編輯 程金華)
Study on the Transient Expression of enJSRV Envelope Protein and Its Receptor and the Induction of Trophoblast Cell Fusion in Sheep
ZHANG Yu-fei1,SHI Jing1,LIU Shu-ying1,2*
(1.CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Huhhot010018,China;2.KeyLaboratoryofClinicalDiagnosisandTreatmentTechnologyinAnimalDisease,MinistryofAgriculture,Huhhot010018,China)
This paper aimed to study the possible role of endogenous jaagsiekte sheep retrovirus(enJSRV) envelope protein in sheep placenta formation process.Chorionic trophoblast cells from Mongolian sheep were culturedinvitro.RT-PCR technique was used to amplify enJSRV-envgene as well as the full-length gene of its receptorHyal2.The genes were then directionally cloned into the eukaryotic expression vector pEGFP-C1.The electric transfection conditions of the chorionic trophoblast cells were optimized and the electrical transfer efficiency was measured.The constructed eukaryotic expression plasmids were transfected into chorionic trophoblast cells by electroporation,and transient expressions of enJSRV envelope protein and its receptorHyal2 were observed under a fluorescence microscope.The activity of cell fusion in chorionic trophoblast cells under high expression and RNA interference silencing of enJSRV-envgene was also observed.The results showed that eukaryotic expression plasmids were successfully constructed and named as pEGFP-C1/enJSRV-envand pEGFP-C1/Hyal2,respectively.The best transfection conditions were pulse voltage 150 V,pulse time 5.0 ms,electric shock number for 2 times with 50 ms interval.The number of multinucleated cells were significantly increased in the trophoblast cells which co-transfected pEGFP-C1/Hyal2 with the transfection of pEGFP-C1/enJSRV-envplasmid and pEGFP-C1/enJSRV-env.We observed 2.3 and 1.8 multinucleated cells in average per field.The enJSRV-envhad a certain role in promoting the cell fusion of chorionic trophoblast cells.This study provides an experimental basis for further exploring the structure and function of enJSRV envelope protein and the fusion mechanism of chorionic trophoblast cells.
enJSRV;endogenous retroviruses;envelope protein;trophoblast cells;cell fusion
10.11843/j.issn.0366-6964.2015.11.003
2015-02-05
國家自然科學基金(31160493;31360597);內蒙古科技創新引導基金項目(20130224);教育部博士點基金博導類項目(20111515110008)
張宇飛(1988-),男,呼和浩特人,博士生,主要從事生殖內分泌及病毒病理學研究,E-mail:enjoy_zyf@163.com
*通信作者:劉淑英,教授,博士生導師,Tel:0471-4309175,E-mail:liushuying_imau@126.com
S826.2
A
0366-6964(2015)11-1924-10

