圍產期小鼠子宮頸中糖皮質激素受體、11β羥基類固醇脫氫酶的表達
李亭亭,田高強,羅明久,黃麗波,葛利江
(山東農業大學動物科技學院,泰安 271018)
圍產期小鼠子宮頸中糖皮質激素受體、11β羥基類固醇脫氫酶的表達
李亭亭#,田高強#,羅明久,黃麗波,葛利江*
(山東農業大學動物科技學院,泰安 271018)
旨在揭示糖皮質激素(GC)及糖皮質激素受體(GR)、11β羥基類固醇脫氫酶1和2(11βHSD-1和2)對圍產期小鼠子宮頸成熟的影響和機制。選取圍產期5個時間點,分別為產前48 h(-48 h)、產前24 h(-24 h)、分娩時(0 h)、產后12 h(+12 h) 和產后48 h(+48 h)。首先通過ELISA檢測血清皮質酮濃度變化,再通過免疫組化對GR和影響GC活性的兩個酶,11βHSD-1和11βHSD-2,進行免疫定位和半定量檢測。ELISA結果顯示圍產期GC濃度呈先升高后下降趨勢,分娩時達到峰值(P<0.01)。免疫組化結果顯示,11βHSD-1、11βHSD-2和GR在子宮頸腔上皮、基質、血管和平滑肌細胞上均有分布,11βHSD-1/11βHSD-2平均光密度的比值呈現先升高再下降趨勢,分娩時比值最高;GR的表達量也是分娩時最高,分娩前后較低的趨勢(P<0.01)。以上結果提示11βHSD-1合成的糖皮質激素通過其受體在子宮頸的成熟過程中起著關鍵性作用。
糖皮質激素;11βHSD-1;11βHSD-2;糖皮質激素受體;小鼠;免疫定位
糖皮質激素(Glucocorticoid,GC)是腎上腺皮質層束狀帶合成和分泌的一類甾體激素,在機體的代謝和應激等過程中起著重要的作用。11βHSD-1和 11βHSD-2 是調節糖皮質激素活性的轉化酶,二者作用相反,分別可以活化/失活GC,共同調節局部組織細胞內糖皮質激素的活性。
糖皮質激素受體(GR)是由核受體亞家族3C組成員1(NR3C1)編碼的一條多肽鏈組成的磷酸化蛋白質,與GC結合形成GC-GR復合物,通過和靶基因中的GC反應元件相互作用,最終引起各種生物學效應[1]。研究表明,糖皮質激素是參與分娩的重要激素[2],綿羊、牛、小鼠等在妊娠晚期及分娩后胎盤、子宮、胎兒或母體血管中均有GR表達,GC與GR 結合可引起前列腺素分泌增加,促使宮縮加強[3-4]。
宮頸成熟(cervical ripening)是正常分娩的必要條件。目前研究表明,子宮頸成熟不是繼發于子宮收縮的被動過程,而是一個多種內分泌因素參與的主動耗能[5]、炎性細胞浸潤的過程[6-7]。各種激素介質通過直接或間接對宮頸內免疫細胞的位置分布和相對數量的調控來發揮它們特有的生理功能使宮頸成熟軟化。其中糖皮質激素及其受體和轉換它的兩個關鍵酶的作用一直備受關注,但其調控機制尚不清楚。本研究旨在對這一機制進行初步闡釋。
1 材料與方法
1.1 實驗動物及分組
健康雌雄昆明小鼠,購自山東大學實驗動物中心,(80±5)日齡,體重40 g左右,其中雌鼠25只,雄鼠5只,給予充足的飲水和飼料,自然光照。將小鼠按雌雄3∶1的比例合籠。次日早晨發現陰道栓時記為妊娠第1天(D 1),按采樣時期不同分為5組,分別為產前48 h(D17)和24 h(D18)、0 h (D19)、產后12 h和48 h。
1.2 試劑和儀器
小鼠皮質酮ELISA試劑盒(DZE 20546,上海基爾頓生物科技);兔抗人糖皮質激素受體多克隆抗體(ab 52190)、兔抗人11βHSD-1多克隆抗體(ab 39364)、兔抗人11βHSD-2多克隆抗體(ab 115696)(均購自英國Abcam公司);超敏二步法免疫組化試劑盒(PV-9001,中山金橋);DAB顯色試劑盒(PA 110,北京天根)。
LEICA石蠟切片機;Labsystems Multiskan MS公司的酶標儀;Olympus顯微照相系統。
1.3 樣本采集和處理
所有小鼠摘除眼球采血,收集于干燥離心管中,室溫靜置30 min,1 000 r ·min-1離心10 min,取血清儲存于-20 ℃冰箱,用于檢測血清皮質酮濃度。采血后取小鼠新鮮子宮頸組織,生理鹽水沖洗,放于4%多聚甲醛,4 ℃固定48~72 h;固定后組織再經水流沖洗1 d,酒精逐級脫水,二甲苯透明,石蠟包埋;連續切片,切片厚約4 μm,每隔5張取3張連續切片,用于免疫組化染色。
1.4 小鼠血清皮質酮的檢測
應用ELISA法分別檢測5組小鼠血清皮質酮的含量,小鼠皮質酮ELISA試劑盒檢測濃度范圍為8~150 μg·L-1;在酶標包被板上待測樣品孔中先加樣品稀釋液40 μL,然后再加待測樣品10 μL,具體操作方法按照試劑盒說明書進行。
1.5 免疫組化(間接法)檢測GR、11βHSD-1和11βHSD-2
1.5.1 主要染色步驟 切片常規脫蠟至水;0.8%胰蛋白酶消化修復抗原;含3% H2O2的甲醇溶液37 ℃濕盒內避光孵育30 min;兔抗人糖皮質激素受體多克隆抗體一抗工作液(1∶100稀釋),4 ℃冰箱濕盒內過夜孵育;相繼滴加超敏二步法免疫組化試劑盒試劑1和試劑2,于37 ℃溫箱中各孵育1 h。以上各步驟之間均以0.01 mol·L-1PBS 液充分洗滌3次,每次5 min。最后DAB顯色以及蘇木素復染,脫水,封片。
1.5.2 視野觀察與統計 使用顯微照相系統對子宮頸切片進行圖像采集,每只小鼠取3張切片,每張切片隨機選取5個視野,并在相同條件下拍照保存。用Image-pro plus 6.0軟件進行圖像分析,測定單位視野中GR陽性顆粒的光密度值,取5個視野的平均值定為該樣本的GR陽性顆粒的平均光密度值,平均光密度值越大表示蛋白含量越高。
11βHSD-1和2的免疫組化檢測步驟同上。
1.6 統計分析
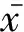
2 結 果
2.1 小鼠血清皮質酮濃度
產前48h、產前24h、分娩時、產后12h和產后48h血清皮質酮分別為(124.22±2.82)、(123.87±3.31)、(136.15±3.79)、(135.74±2.72)和(131.30±2.10)μg·L-1。血清皮質酮從產前48h至產前24h略有下降,二者差異不顯著(P>0.05);產前24h到分娩時GC濃度迅速上升,達到峰值,二者差異極顯著(P<0.01);產后12h時GC濃度略有降低,但與分娩時差異不顯著(P>0.05);產后48h時GC濃度顯著下降,與其他四個時間點差異極顯著(P<0.01)。
2.2 子宮頸中11βHSD-1和2的定位和半定量
免疫組化結果表明,11βHSD-1和11βHSD-2在細胞核和細胞質中均有表達,且主要為細胞核著色,陰性對照不著色(圖1F、f)。產前48h時11βHSD-1和2在子宮頸腔上皮細胞和基質細胞中有少量表達(圖1A、a),從產前24h至產后48h在子宮頸中分布廣泛,子宮頸腔上皮和基質細胞(圖1B、D、b、d、e),血管內皮(圖1D、E、d、e)以及子宮頸平滑肌細胞(圖1C、c、e)上均有分布,且主要分布在腔上皮和平滑肌細胞上。
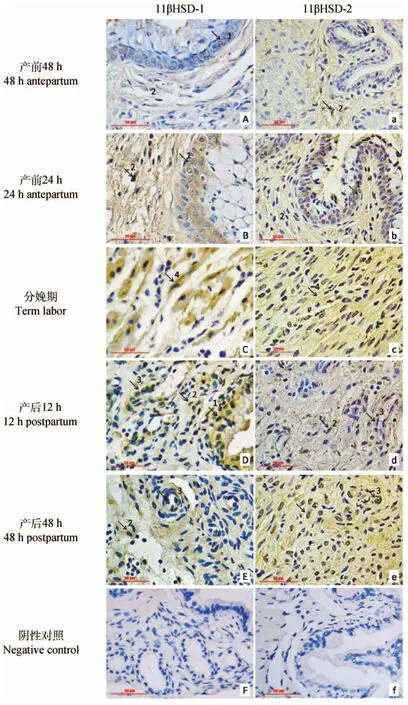
平均光密度分析得出,產前48h至分娩期,11βHSD-1和11βHSD-2表達量逐漸升高,分娩時達到最大值(P<0.05),產后12h表達水平顯著下降(P<0.05),其中11βHSD-1表達量在產后48h降低到產前48h水平,兩者差異不顯著(P>0.05),11βHSD-2表達量在產后12h與產后48h差異不顯著(P>0.05),且維持在較高水平,但與產前48h相比差異極顯著(P<0.01) (圖2)。
2.3 子宮頸中GR的定位和半定量
GR蛋白定位在子宮頸細胞的細胞核中,細胞質中也檢測到少量表達。經免疫組化DAB染色的切片,GR免疫反應陽性細胞呈深淺不等的棕黃色(圖3),陰性對照不著色(圖3F)。結果顯示,在產前48h時GR僅在子宮頸腔上皮細胞和基質中少量表達(圖3A);產前24h至產后48h,GR在子宮頸腔上皮和基質細胞(圖3B,D),腺管(圖3D),血管內皮(圖3D,E)以及子宮頸平滑肌細胞(圖3C,E)上均有分布,其中分娩時GR表達量最高。
Image-proplus6.0的分析顯示,產前48h、產前24h、分娩時、產后12h和產后48hGR陽性細胞在小鼠子宮頸組織中的平均光密度分別為(0.008±0.004) 、(0.034±0.017)、(0.062±0.015)、(0.039±0.016)和(0.016±0.007)IOD·Area-1。GR陽性細胞在產前48h表達水平較低,平均光密度值最小,產前24hGR表達量迅速上升(P<0.01),分娩時上升到最高水平(P<0.01)。產后GR表達量迅速下降,其中分娩時與產后12h差異極顯著(P<0.01),產后12h與產后48h差異極顯著(P<0.01),且產后48hGR表達量接近產前48h(P>0.05) 。
上述結果表明小鼠圍產期5個時間點GR的平均光密度值呈現出先升高再降低。在分娩時GR的平均光密度值最高,與11βHSD-1/11βHSD-2的比值有著相似的變化趨勢。
3 討 論
糖皮質激素(GC)分為皮質醇和皮質酮,在不同種屬動物體內分泌的種類和比例有所不同,牛、羊和人等體內以皮質醇為主,而鳥類、大鼠和小鼠、兔則以皮質酮為主。GC的生物學效應不僅取決于目標組織中GR受體的表達量還取決于糖皮質激素的代謝酶 (11βHSD-1和2)的表達含量與反應方向。11βHSD-1和2可催化糖皮質激素C11位的酮基與羥基之間的氧化還原反應,其中11βHSD-1能使無活性的可的松(脫氫皮質酮)還原為有活性的皮質醇(皮質酮),而11βHSD-2的催化反應方向相反,使有活性的糖皮質激素失活。
本試驗結果表明,GR蛋白與11βHSD-1和2表達部位一致,在小鼠子宮頸內膜基底層、間質、腺管、血管以及子宮頸平滑肌都有分布,說明糖皮質激素可通過自分泌或旁分泌的方式在子宮頸局部細胞內起作用。小鼠圍產期5個時間點11βHSD-1和2的平均光密度曲線相似,說明11βHSD-1和2的表達量有著相似的變化趨勢,都是在分娩時表達量最高。同時11βHSD-1/11βHSD-2的比值也呈現出“先升高再降低”的趨勢。這與作者檢測的小鼠圍產期血清皮質酮濃度的變化規律相符,說明在分娩時11βHSD-1/11βHSD-2比值達到最大值,皮質酮活化反應更占優勢,子宮頸局部組織細胞中GC濃度上升,參與宮頸成熟擴張。而在分娩前后皮質酮失活反應更占優勢,子宮頸局部組織細胞中GC濃度下降,以減少糖皮質激素對宮頸的擴張作用,利于宮頸的產后修復。此外GR蛋白在分娩時表達水平的顯著升高,增加了子宮頸對GC的敏感性,進一步加強GC對子宮頸成熟擴張的作用。
1.腔上皮;2.基質細胞;3.血管;4.平滑肌細胞;箭頭表示11βHSD-1和11βHSD-2陽性細胞1.Luminal epithelium;2.Stromal cells;3.Blood vessels;4.Smooth muscle cells;Arrows represent immune positive cells of 11βHSD-1 and 11βHSD-2圖1 圍產期小鼠子宮頸中11βHSD-1和11βHSD-2免疫反應陽性細胞Fig.1 Immune positive cells of 11βHSD-1 and 11βHSD-2 in murine uterine cervix during the peripartal period
雖然糖皮質激素通過干擾NF-κB信號系統可抑制羊膜成纖維細胞以及大多數其他類型細胞內前列腺素合成酶(PTGS 2)的表達[8],降低前列腺素濃度,但是在滋養層中包括羊膜和絨毛膜,糖皮質激素卻可刺激PTGS 2表達和活性[9-12]。皮質醇可刺激羊膜PTGS 2轉錄以增強前列腺素的合成,并抑制絨毛膜前列腺素脫氫酶的活性從而抑制前列腺素代謝[13,15]。此外,糖皮質激素在分娩期可直接上調胎膜中前列腺素的合成[13-14]。
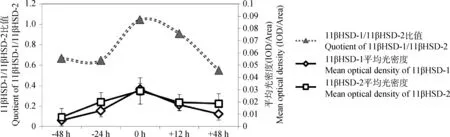
圖2 子宮頸中11βHSD-1 和2免疫陽性細胞的平均光密度及11βHSD-1/11βHSD-2比值Fig.2 The mean optical density of 11βHSD-1 and 2 immunopositive cells in the uterine cervix and the quotient between mean optical density of 11βHSD-1 and 2
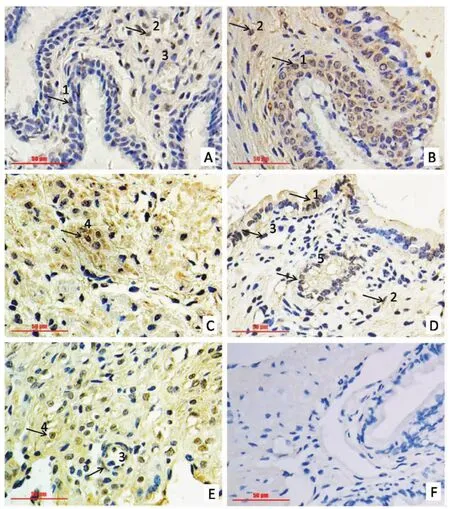
A.產前48 h;B.產前24 h;C.分娩期;D.產后12 h;E.產后48 h;F.陰性對照;1.腔上皮;2.基質細胞;3.血管;4.平滑肌細胞;5.腺管;箭頭表示GR陽性細胞A.48 h antepartum;B.24 h antepartum;C.Term labor;D.12 h postpartum;E.48 h postpartum;F.Negative control;1.Luminal epithelium;2.Stromal cells;3.Blood vessels;4.Smooth muscle cells;5.Glandular epithelium;Arrows represent immune positive cells of GR圖3 圍產期小鼠子宮頸組織中GR免疫反應陽性細胞Fig.3 Immune positive cells of GR in murine uterine cervix during the peripartal period
而前列腺素在分娩啟動和延續中起著關鍵作用,已有研究證明,內源性前列腺素PGE 2參與宮頸成熟[16]。PGE 2可破壞子宮頸上皮細胞間的結構和結締組織中的膠原纖維和彈性蛋白[17],使結締組織和上皮變得松散軟化。分娩時PGE 2主要產生于羊膜,絨毛膜,蛻膜組織還有母體胎盤[ 18-20 ]。我們另一項研究發現在分娩時PGE 2在宮頸組織中分布廣泛,除了存在于脂肪細胞外,還存在于腔上皮、血管,腺管,平滑肌和漿膜[5],說明子宮頸也是PGE 2旁分泌或自分泌的部位。因此,推斷子宮頸局部組織中由11βHSD-1和2共同調節的糖皮質激素及其受體與宮頸內PGE 2有密切聯系,糖皮質激素在分娩期可能是通過增加子宮頸局部組織PGE 2的濃度使子宮頸成熟擴張。
顧國生等已證明[5],山羊子宮頸平滑肌中前列腺素松弛型受體EP 2和EP 4蛋白在分娩期的表達量顯著升高,這與小鼠子宮頸中的糖皮質激素受體的表達規律也相符。PGE 2通過與其受體EP 1、EP 2、EP 3和EP 4結合使分娩正常啟動。PGE 2與EP 2、EP 4結合后刺激腺苷酸環化酶的分泌,通過提高cAMP的分泌來誘導子宮頸平滑肌松弛[21]。此外,有研究表明糖皮質激素可通過增加離體培養的子宮平滑肌組織中的前列腺素水平而增加子宮的收縮力[22]。糖皮質激素在子宮組織中產生的不同生物學效應可能與前列腺素受體在不同組織中的特異性表達相關。不同組織細胞分泌的PGE 2可以通過跨膜G蛋白偶聯EP超家族來激活不同細胞內通路以引起子宮和宮頸的收縮或松弛[23-25]。分娩期子宮組織中前列腺素受體EP 1和EP 3大量表達分布,其中EP 1是收縮性受體,前列腺素通過與其結合直接使子宮收縮,而EP 3是通過降低cAMP的表達來抑制子宮平滑肌的舒張來間接使子宮處于收縮狀態。
4 結 論
分娩時子宮頸局部組織中由11βHSD-1合成糖皮質激素及其受體大量增加使子宮頸成熟軟化,分娩后子宮頸局部組織糖皮質激素水平的降低使子宮頸恢復到分娩前的狀態,因此糖皮質激素及其受體與小鼠子宮頸成熟有密切關系。
[1] McCULLERS D L,HERMAN J P.Adrenocorticosteroid receptor blockade and excitotoxic challenge regulate adrenocorticosteroid receptor mRNA levels in hippocampus[J].JNeurosciRes,2001,64(3):277-283.
[2] CHALLIS J R G.Mechanism of parturition and preterm labor[J].ObstetGynecolSurv,2000,55(10):650-660.
[4] BOOS A,KOHTES J,JANSSEN V,et al.Pregnancy effects on distribution of progesterone receptors,oestrogen receptor alpha,glucocorticoid receptors ki-67 antigen and apoptosis in the bovine interplacentomal uterine wall and foetal membranes[J].AnimReprodSci,2006,91(1-2):55-76.
[5] GU G,GAO Q,YUAN X J,et al.Immunolocalization of adipocytes and prostaglandin E2 and its four receptor proteins EP1,EP2,EP3,and EP4 in the caprine cervix during spontaneous term labor[J].BiolReprod,2012,86(5):1-10.
[6] OSMAN I,YOUNG A,LEDINGHAM M A,et al.Leukocyte density and pro-inflammatory cytokine expression in human fetal membranes,decidua,cervix and myometrium before and during labour at term[J].MolHumReprod, 2003,9(1):41-45.
[7] SENNSTR?M M B,EKMAN G,WESTERGREN-THORSSON G,et al.Human cervical ripening,an inflammatory process mediated by cytokines[J].MolHumReprod,2000,6(4):375-381.
[8] MCKAY L I,CIDLOWSKI J A.Molecular control of immune/inflammatory responses:interactions between nuclear factor-κB and steroid receptor-signaling pathways[J].EndocrRev,1999,20(4):435-459.
[9] ECONOMOPOULOS P,SUN M,PURGINA B,et al.Glucocorticoids stimulate prostaglandin H synthase type-2(PGHS-2) in the fibroblast cells in human amnion cultures[J].MolCellEndocrinol,1996,117(2):141-147.
[10] ZAKAR T,OLSON D M.Dexamethasone stimulates arachidonic acid conversion to prostaglandin E2 in human amnion cells[J].JDevPhysiol,1989,12(5):269-272.
[11] ZAKAR T,OLSON D M.Studies on glucocorticoid hormone actions in the regulation of human amnion PGHS[J].ReprodFertilDev,1995,7(3):517-520.
[12] ZAKAR T,HIRST J J,MIJOVIC J E,et al.Glucocorticoids stimulate the expression of prostaglandin endoperoxide H synthase-2 in amnion cells[J].Endocrinology, 1995,136(4):1610-1619.
[13] CHALLIS J R G,GIBB W.Control of parturition[J].PrenatNeonatMed,1996,1:283.
[14] POTESTIO F A,ZAKAR T,OLSON D M.Glucocorticoids stimulate prostaglandin synthesis in human amnion cells by a receptor-mediated mechanism[J].JClinEndocrinolMetab,1988,67(6):1205-1210.
[15] CHALLIS J R,MATTHEWS S G,VANMIER C,et al.Current topic:the placental corticotrophin-releasing hormone-adrenocorticotrophin axis[J].Placenta,1995,16(6):481-502.
[16] KEELAN J A,COLEMAN M,MITCHELL M D.The molecular mechanisms of term and preterm labor:recent progress and clinical implications[J].ClinObstetGynecol,1997,40(3):460-478.
[17] 董彥亮.妊娠期子宮頸成熟和催熟的研究[J].徐州醫學院學報,1985,5(4):64-69. DONG Y L.Study on cervical ripening and mature during pregnancy[J].ActaAcademiaeMedicinaeXuzhou,1985,5(4):64-69.(in Chinese)
[18] OLSON D M,SKINNER K,CHALLIS J R.Prostaglandin output in relation to parturition by cells dispersed from human intrauterine tissues[J].JClinEndocrinolMetab,1983,57(4):694-699.
[19] SKINNER K A,CHALLIS J R.Changes in the synthesis and metabolism of prostaglandins by human fetal membranes and decidua at labor[J].AmJObstetGynecol,1985,151(4):519-523.
[20] MITCHELL M D,ROMERO R J,EDWIN S S,et al.Prostaglandins and parturition[J].ReprodFertDev,1995,7(3):623-632.
[21] NARUMIYA S,SUGIMOTO Y,USHIKUBI F.Prostanoid receptors:structures,properties,and functions[J].PhysiolRev,1999,79(4):1193-1226.
[22] MORIMOTO K,OKU M.Effect of progesterone,cortisol and dehydroepiandrosterone-sulfate on prostaglandin production by cultured human myometrial cells[J].NihonSankaFujinkaGakkaiZasshi,1995,47(4):391-397.
[23] MILLER-GRAZIANO C L,FINK M,WU J Y,et al.Mechanisms of altered monocyted prostaglandin E2 production in severely injured patients[J].ArchSurg,1998,123(3):293-299.
[24] LONG J A,FOGEL-PETROVIC M,KNIGHT D A,et al.Higher prostaglandin E2 production by dendritic cells from subjects with asthma compared with normal subjects[J].AmJRespirCritCareMed,2004,170(5):485-491.
[25] JOURDAN K B,EVANS T W,GOLDSTRAW P,et al.Isoprostanes and PGE2 production in human isolated pulmonary artery smooth muscle cells:concomitant and differential release[J].FASEBJ,1999,13(9):1025-1030.
(編輯 白永平)
Expression of Glucocorticoids Receptor,11β-Hydroxysteroid Dehydrogenase in the Cervices of Peripartal Mice
LI Ting-ting#,TIAN Gao-qiang#,LUO Ming-jiu,HUANG Li-bo,GE Li-jiang*
(CollegeofVeterinaryMedicine,ShandongAgriculturalUniversity,Tai’an271018,China)
The present study was designed to examine the pattern and cellular localization of 11β-hydroxysteroid dehydrogenase(11β-HSD) enzymes and glucocorticoids receptor(GR) gene expression in the murine cervix during peripartal period,and to gain insight into the role of glucocorticoid(GC) and GR,11β-HSD-1 and 2 in the cervical ripening of peripartal mice.Mice in five groups were from 48 h before birth(-48 h) and-24 h,at term labor(0 h),12 h after birth(+12 h) and +48 h.The dynamic change of the serum corticosterone level was determined by ELISA and immunolocalization of GR,11βHSD-1 and 2 which influence glucocorticoid’s activity in cervix was assayed by immunohistochemistry.The results suggested that the levels of serum corticosterone were significantly increased before the onset of labor,reached the maximum during delivery(P<0.01).In addition,the 11βHSD-1,11βHSD-2 and GR protein were localized to the nuclei of cervical luminal epithelia,stromal cells,vascular and cervical smooth muscles.The quotient between mean optical density of 11βHSD-1 and 2 is highest at parturition.Furthermore,the immunoreactivity of GR also reached the peak at parturition(P<0.01).These results revealed that 11βHSD-1-regenerated glucocorticoids may act via its receptor to play an important role in the final cervical ripening.
glucocorticoids;11βHSD-1;11βHSD-2;glucocorticoid receptor;mice;immunolocalization
10.11843/j.issn.0366-6964.2015.11.024
2015-03-04
山東省自然科學基金(ZR2010CM052)
李亭亭(1989-),女,山東嘉祥人,碩士,主要從事動物生殖疾病與生殖內分泌的研究,E-mail:litingting0516@126.com。田高強為共同第一作者
*通信作者:葛利江,E-mail:glj@sdau.edu.cn
S857.2
A
0366-6964(2015)11-2097-07

