“問題式”教學模式的理論構建和實踐探索
馮妙玲
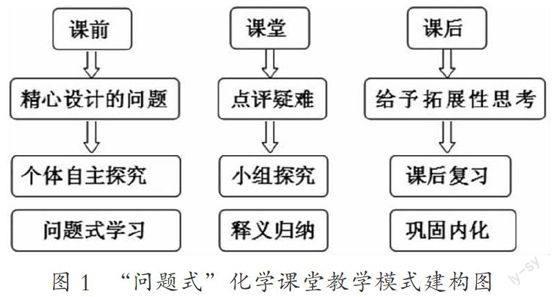
1. “問題式”化學課堂教學模式建構圖
2. 人教版選修4《鹽類的水解》“問題式”化學課堂教學模式
《鹽類的水解》是《化學反應原理》模塊的重點知識,也是難點知識,具有較高思維要求。
①課前向學生呈現一些精心設計的問題,學生完成預習作業。
教師課前為學生提供新知識的背景信息,通常包括閱讀教科書或補充材料,或為新知識學習所需要的舊知識的回顧,或要求學生以小組為單位收集資料等。
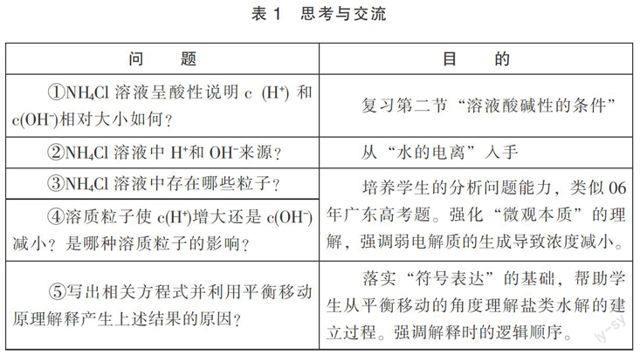
《鹽類的水解》預習學案設計問題如下:
問題1:你知道醋酸溶液為什么呈酸性嗎?氨水為什么又呈堿性呢?
【設計意圖】喚起學生對酸溶液呈酸性、堿溶液呈堿性原因的回憶;同時以醋酸和氨水為例,使學生進一步加深認識弱酸、弱堿在溶液中的電離是一個可逆過程,即弱酸溶液中弱酸分子、弱酸根離子和H+必定是同時存在,同樣弱堿溶液中弱堿分子、弱堿陽離子和OH-也必定是同時存在,為后面的猜想做好鋪墊。
問題2:那么純水為什么呈中性?溶液酸堿性的本質又是什么呢?
【設計意圖】進一步喚起學生對溶液酸堿性本質的回憶,為下面讓學生尋找Na2CO3溶液顯堿性的理論解釋埋下伏筆。
問題3:那么鹽溶液的酸堿性情況怎么樣呢?是不是鹽溶液一定呈中性?如果不是,請舉例說明。
【設計意圖】用一個學生非常熟悉的例子進行自然過渡,使學生在不知不覺中進入了《鹽類的水解》一節內容的學習。
②小組探究,教師對學生存在的疑難進行釋義歸納。師生共同解題,進一步加深學生對知識的理解。
《鹽類的水解》課堂教學中,學生在老師引導下完成科學探究:測定NaCl、Na2CO3、NaHCO3、NH4Cl、Na2SO4、CH3COONa、(NH4)2SO4溶液的酸堿性。這時教師提出:“什么鹽溶液并不顯中性?有某類鹽溶液顯酸性,有某類鹽溶液顯堿性?”引導學生結合“思考與交流”,先填寫 “NH4Cl溶液”一列。由于我校學生基礎較差,筆者準備以下相關問題,引導學生回答,層層推進,促進學生對鹽類水解本質的理解(見表1)。
學生接受問題后進行小組討論,教師巡回指導,及時提出啟迪性問題。教師選擇不同層次的學生回答、黑板演示,提問時可以故意選擇思維可能進入誤區的同學表述,師生共同討論,同時給予鼓勵,并進一步完善,將問題的討論推向高潮。通過這樣的學習,學生不僅學到了知識,還學會了探究問題的方法,提高了問題探究的能力。
③課后給予拓展性思考題,鞏固內化學生知識。
在講完鹽類水解核心問題后,教師留下以下幾個問題:為什么用純堿水溶液洗滌油污物品時,熱堿液的去污效果比冷的好?為什么在實驗室配制氯化鐵溶液時,要向溶液加入一定量的鹽酸?為什么長時期施用銨態氮肥(硫胺)的土壤,它的酸性會增強?這些問題為鹽類水解的應用一課做好準備。
這幾個問題既有基礎知識的鞏固,也有知識拓展和能力的訓練,同時與實踐活動緊密聯系,是一道綜合性、實踐性很強的題目。學生在解決本題所提出的問題時,必須綜合運用已學的知識,從不同層次進行思考。因此,問題解決過程即是知識鞏固提高的過程,也是學習新知識的過程。

