血漿Mir-21與卵巢功能減退相關(guān)性研究
藺會蘭 孫曉慧 金立娟 劉俊霞 田碩 張藝瑋 鐔麗霞
卵巢功能是指卵巢皮質(zhì)區(qū)卵泡生長、發(fā)育、形成可受精卵母細胞的能力。其反映了生育潛能,直接影響輔助生殖技術(shù)的結(jié)局。卵巢功能減退為婦科內(nèi)分泌疾病的常見多發(fā)病之一。大多數(shù)卵巢功能減退患者年齡小于40歲,并出現(xiàn)月經(jīng)不調(diào),閉經(jīng),不孕等癥狀,給她們的生活、工作帶來種種不便。因此尋找卵巢功能減退的發(fā)病機制,有助于早期診斷、早期治療。MicroRNA(miRNAs)是一類長約20個nt的內(nèi)源性非編碼RNA,主要通過抑制翻譯或促進mRNA的降解對轉(zhuǎn)錄后基因表達進行調(diào)控,并參與細胞增殖、分化、凋亡及腫瘤發(fā)生等多個生物過程[1]。研究表明,miRNAs與小鼠卵母細胞的成熟與卵泡發(fā)育有關(guān)[1]。目前關(guān)于miRNA對卵巢功能減退的作用機制尚不十分清楚,有大量研究證實Mir-21與細胞的凋亡密切相關(guān)。本文通過檢測卵巢功能減退患者與正常人外周血的Mir-21表達差異及顆粒細胞凋亡情況,探討Mir-21與卵巢功能的相關(guān)性,為研究卵巢功能減退的發(fā)病機制提供理論依據(jù)。
1 資料與方法
1.1 一般資料 選擇2012年11月至2013年12月因不孕接受IVF-ET/ICSI治療的患者43例,納入標準:年齡25~40歲,月經(jīng)周期25~35 d,B超檢查除外多囊卵巢綜合征、子宮內(nèi)膜異位癥、子宮腺肌病、子宮肌瘤、高泌乳素血癥、甲狀腺功能異常等疾病,無發(fā)熱及炎癥疾病,除外甲狀腺疾病、腎上腺疾病及其他系統(tǒng)腫瘤等。患者知情同意。
1.2 研究方法及分組 所有研究對象于月經(jīng)第2~4天8∶00 ~10∶00,空腹收集外周血 5 ml于 EDTA 抗凝管,1 h之內(nèi)離心,2 500 r/min,10 min收集上清,置-20℃保存待測性激素。采用微粒子化學(xué)發(fā)光法測定,批內(nèi)變異系數(shù)<5.4%,批間變異系數(shù)<10%。根據(jù)性激素結(jié)果分為:卵巢功能減退組(FSH>10 U/L)20例和卵巢功能正常組(FSH<8 U/L)23例。卵巢功能減退組血 FSH(12.1±0.9)U/L,卵巢功能正常組FSH 為(7.0±1.4)U/L,卵巢功能減退組 FSH 高于正常組(P<0.05);卵巢功能減退組血 LH(5.2±2.0)U/L、卵巢功能正常組血 LH(4.4 ±2.4)U/L,2 組差異無統(tǒng)計學(xué)意義(P>0.05)。卵巢功能減退組E2(155±50)pmol/ml、卵巢功能正常組 E2(192±43)pmol/ml,2組差異無統(tǒng)計學(xué)意義(P>0.05);卵巢功能減退組 T(3.0±1.3)nmol/L、卵巢功能正常組T(2.8 ±1.2)nmol/L,2 組間差異無統(tǒng)計學(xué)意義(P>0.05),卵巢功能減退組年齡(31±4)歲、卵巢功能正常組年齡(29±5)歲,2組間差異無統(tǒng)計學(xué)意義(P>0.05)。見表2。
表2 2組間基本情況比較±s

表2 2組間基本情況比較±s
注:與卵巢功能減退組比較,*P<0.05
組別 卵巢功能減退組(n=20) 卵巢功能正常組(n=23)年齡(歲)31±4 29±5體重指數(shù)(kg/m2) 21±10 21±9不孕年限(年) 4.0 ±2.1 3.7 ±1.7 FSH(U/L) 12.1 ±0.9 7.0 ±1.4*LH(U/L) 5.2 ±2.0 4.4 ±2.4 E2(pmol/ml) 155±50 192±43 T(pmol/ml)3.0 ±1.3 2.8 ±1.2
1.3 總 RNA提取 于室溫下,取血漿500 μl,采用Virina RNA試劑盒(美國Invitrogen公司)嚴格按照試劑盒說明操作,利用異丙醇沉淀 RNA,以70%冷乙醇清洗沉淀。在空氣條件下等待沉淀干燥后,加入二乙基焦磷酸酰胺(DEPC)處理的三蒸水溶解 RNA。利用紫外分光光度計和甲醛瓊脂糖變性電泳對提取的總RNA進行純度和含量鑒定。
1.4 miRNA 檢測 (1)逆轉(zhuǎn)錄:反應(yīng)總體系 25 μl,包括:提取總 RNA 按 1∶1稀釋后 1 μl,逆轉(zhuǎn)錄引物 3 μl(引物序列見表1),dNTP終濃度為0.5 mmol/L,DTT終濃 度 為 10 mmol/L,5 × 逆 轉(zhuǎn) 錄 Buffers 5 μl,M-MLV 200 U,加無菌 ddH2O 補足到25 μl,反應(yīng)條件為:16℃ 30 min,42℃ 30 min,85℃ 5 min。逆轉(zhuǎn)錄產(chǎn)物10倍稀釋后-20℃保存?zhèn)溆谩?2)實時熒光定量PCR 檢測:反應(yīng)體系 20 μl,包括:cDNA 按 1∶1稀釋后取2 μl,2 × 定量 PCR 反應(yīng)預(yù)混液 10 μl,引物及探針1 μl,加水補足到 20 μl。循環(huán)條件為:95℃ 10 min;95℃ 15 s,60℃1 min,40個循環(huán)。逆轉(zhuǎn)錄和熒光實時定量PCR檢測所用引物和探針由上海Sangon公司提供。(3)實時熒光定量PCR結(jié)果分析:本研究采用相對定量的方法(2-△△CT)對實時定量PCR的結(jié)果進行分析、比較。見表1。

表1 引物序列
1.5 顆粒細胞凋亡檢測 采用促性腺激素釋放激素激動劑(GnRH-a)/基因重組人卵泡刺激素(rFSH)/人絕經(jīng)期促性腺激素(HMG)/人絨毛膜促性腺激素(HCG)超促排卵方案,根據(jù)患者的年齡、AFC及基礎(chǔ)血清FSH/LH/E2水平確定促性腺激素(Gn)起始劑量,同時超聲監(jiān)測卵泡發(fā)育情況,根據(jù)卵泡發(fā)育情況調(diào)整Gn用量。當1個主導(dǎo)卵泡平均直徑超過18 mm、2個主導(dǎo)卵泡平均直徑超過17 mm、3個主導(dǎo)卵泡平均直徑超過16 mm時給予人絨毛膜促性腺激素(HCG)5 000或10 000 U肌內(nèi)注射,36 h后經(jīng)陰道超聲取卵,收集卵泡液,于室溫下置于無菌試管中,在1 500 r/min條件下離心20 min,取沉淀置50%Percoll液上,再在1 000 r/min條件下離心10 min,回收位于兩液體中間的顆粒細胞層。應(yīng)用熒光染料溶液hoechst 33258染色,熒光顯微鏡下觀察1 000個顆粒細胞,計算凋亡細胞數(shù)。凋亡細胞為核破碎或破碎細胞液中包含破碎核。
1.6 統(tǒng)計學(xué)分析 應(yīng)用SPSS 17.0統(tǒng)計軟件,計量資料以±s表示,組間比較采用獨立樣本t檢驗,P<0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 外周血中Mir-21表達 Mir-21在卵巢功能減退組和正常組血漿中 2-ΔΔCt值分別是(0.7818 ± 0.0633)和(1.0000±0.0000),2 組間比較差異有統(tǒng)計學(xué)意義(P<0.05),卵巢功能減退組外周血中Mir-21表達低于對照組。見圖1。

圖1 2組real-time PCR檢測卵巢早衰患者和正常人外周血中Mir-2的表達
2.2 顆粒細胞凋亡率比較 顆粒細胞凋亡率卵巢功能減退組為(24±10)%,正常組為(17±8)%,差異有統(tǒng)計學(xué)意義(P<0.05),卵巢功能減退組顆粒細胞凋亡率高于卵巢功能正常組。hoechst 33258染色發(fā)現(xiàn)卵巢功能減退組顆粒細胞亮染,細胞核固縮,核內(nèi)出現(xiàn)細小不規(guī)則顆粒狀凋亡小體。見圖2、3。

圖2 2組顆粒細胞凋亡率統(tǒng)計結(jié)果
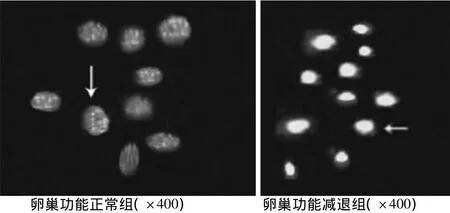
圖3 Hochest33342細胞染色檢測顆粒細胞凋亡,短尾箭頭所示為凋亡細胞,長尾箭頭所示為正常細胞
3 討論
卵巢功能減退為婦科內(nèi)分泌領(lǐng)域常見病,以繼發(fā)性閉經(jīng)、低雌激素等為其特點,其嚴重影響著患者的生活質(zhì)量。卵巢功能減退的具體發(fā)病機制目前還不十分清楚,尋找卵巢功能減退的發(fā)病機制對改善卵巢功能至關(guān)重要。卵泡的發(fā)育經(jīng)歷了始基卵泡、初級卵泡、次級卵泡、竇卵泡、排卵前卵泡。竇前卵泡的后期,顆粒細胞出現(xiàn)了FSH的受體,F(xiàn)SH誘導(dǎo)顆粒細胞芳香化酶的合成,芳香化酶使顆粒細胞將雄激素轉(zhuǎn)變?yōu)榇萍に兀]卵泡期FSH受體大量合成,產(chǎn)生更多的雌激素,促使卵泡發(fā)育,優(yōu)勢卵泡形成。因此,顆粒細胞在卵泡的發(fā)育過程中起決定性的作用[2,3]。大量研究發(fā)現(xiàn)顆粒細胞凋亡與卵子閉鎖及卵巢功能減退關(guān)系密切,當顆粒細胞凋亡達10%以上時該卵泡發(fā)生閉鎖,從而影響卵母細胞的發(fā)育,影響卵巢功能[4]。誘導(dǎo)顆粒細胞凋亡的確切分子機制仍然不清,可能是促卵泡生長因子:FSH、胰島素樣生長因子Ⅰ(IGF-Ⅰ)、白細胞介素 1β(IL-1β)、表皮生長因子(EGF)、Bcl-2等和誘導(dǎo)閉鎖因子:抑制素(Inhibin),Bax,F(xiàn)as,腫瘤壞死因子 α(TNF-α)和caspase等相互作用的結(jié)果[5]。體外培養(yǎng)卵丘復(fù)合物發(fā)現(xiàn)移除卵母細胞后,卵丘細胞的凋亡率增加,加入各種生長因子后卵丘細胞凋亡率顯著降低,表明這些介質(zhì)促使卵母細胞生長,影響卵巢卵泡膜細胞及顆粒細胞的活性,對卵泡發(fā)育至關(guān)重要,同時這些介質(zhì)的表達受 miRNAs轉(zhuǎn)錄后調(diào)控[6]。
MiRNAs是一類長約20 nt的內(nèi)源性非編碼RNA,自1993年第一個階段性調(diào)控胚胎后期發(fā)育的miRNAs(lin-4)被發(fā)現(xiàn),由于其在細胞生長、分化、凋亡等起重要作用而備受關(guān)注。研究表明在細胞核中,聚合酶RNAⅡ識別并啟動宿主基因組間隔區(qū)或內(nèi)含子區(qū),轉(zhuǎn)錄形成一個較長的初級 miRNA(pri-miRNA),其與RNA結(jié)合蛋白相結(jié)合,被聚合酶RNAⅢ-Drosha酶裂解成一個長約70個核苷酸有莖環(huán)結(jié)構(gòu)的pre-miRNA,然后再經(jīng)過Exportin 5運輸?shù)桨|(zhì)中,被另一RNAⅢ核酸內(nèi)切酶-Dicer加工成長約21-nt雙鏈miRNA,即成熟的miRNAs,此雙鏈miRNAs隨后分離成兩條單鏈,其中一條退化,另一條鏈與蛋白形成一個大的蛋白復(fù)合物—沉默復(fù)合體(RISC),整合到靶基因mRNA中發(fā)揮作用。miRNAs通過抑制翻譯或促進mRNA的降解對轉(zhuǎn)錄后基因表達進行調(diào)控,調(diào)節(jié)細胞的增殖、分化及凋亡等[7]。
細胞凋亡是保持細胞增殖和死亡相平衡的一種機制。細胞凋亡途徑分為外源性誘導(dǎo)凋亡途徑和內(nèi)源性誘導(dǎo)凋亡途徑。卵巢顆粒細胞凋亡的細胞內(nèi)機制可能與 caspases凋亡途徑有關(guān)[8]。Vital-Reyes等[9]首次報道人卵巢顆粒細胞表達caspase-8,說明caspase-8參與顆粒細胞凋亡過程。免疫組化法證明,正常小鼠卵巢顆粒細胞中不表達caspases-3,但在缺乏促性腺激素環(huán)境而誘導(dǎo)凋亡的小鼠卵巢顆粒細胞中caspases-3卻有表達。說明caspases-3參與卵巢顆粒細胞的凋亡。有學(xué)者認為miRNAs可能通過調(diào)節(jié)線粒體途徑介導(dǎo)bax表達,誘導(dǎo)細胞色素C從線粒體釋放出來,繼而激活Caspase-3、Caspase-9,引發(fā) Caspases級聯(lián)反應(yīng),導(dǎo)致顆粒細胞凋亡影響卵母細胞的生長[10,11]。與凋亡相關(guān)的基因分為促凋亡基因和抗凋亡基因,而這些基因多數(shù)受miRNAs的調(diào)控。有研究發(fā)現(xiàn)MIR-29B和miR-15-16、let-7/miR-98 和 miR-17-92 均參與細胞凋亡[12]。MiR-144過表達可導(dǎo)致肌細胞凋亡。miR-378高表達抑制細胞凋亡和壞死。miR-378抑制劑引起常氧條件下培養(yǎng)的心肌細胞出現(xiàn)顯著的損傷和凋亡。當miR-34a表達發(fā)生異位時會導(dǎo)致細胞凋亡、衰老或細胞周期靜止。由此推斷miRNAs在細胞凋亡中起重要的作用。
MiRNAs介導(dǎo)的基因轉(zhuǎn)錄調(diào)控機制是控制生殖器官發(fā)育和功能正常的重要機制。有證據(jù)表明在女性各個生殖器官內(nèi)均有miRNAs表達,其主要是對器官發(fā)育過程中的信號通路起調(diào)節(jié)作用。尤其對卵巢發(fā)育,卵泡生長,女性孕育能力等起著重要的作用。女性生殖器官正常發(fā)育和功能的維持受多種因素的調(diào)節(jié),由于miRNAs在轉(zhuǎn)錄、翻譯和翻譯后修改等水平的調(diào)節(jié)起非常重要的作用,miRNAs可能是控制生殖器官發(fā)育和功能正常的重要機制之一。利用不同技術(shù)對miRNAs研究發(fā)現(xiàn),老鼠卵巢中在卵泡周圍的顆粒細胞中發(fā)現(xiàn)了212種成熟的miRNAs,其中Let-7家族表達最多。在卵子生長過程中可檢測到多種miRNAs的表達。有研究發(fā)現(xiàn)miRNAs可能通過調(diào)控卵泡發(fā)育過程的信號通路來調(diào)節(jié)卵泡生長、分化及凋亡[13,14]。當miRNAs合成異常時,則表現(xiàn)為排卵功能異常,卵母細胞和胚胎的完整性受損、雙側(cè)輸卵管囊腫等[15]。Dicer1是miRNAs成熟過程中的重要內(nèi)切酶之一,Otsuka等[16]發(fā)現(xiàn)Dicer1缺乏的小鼠出現(xiàn)卵子成熟障礙,從而導(dǎo)致不孕。也有研究發(fā)現(xiàn)POF患者與正常對照組比較,10種miRNA表達上調(diào),2種miRNA表達下調(diào)。總之通過研究miRNA在轉(zhuǎn)錄后基因調(diào)控中的作用,可為如何提高生殖能力提供依據(jù)[17]。
Mir-21含有22個核苷酸,位于17p23.2染色體區(qū)域的脆性位點FRA17B上[18]。通過對靶基因的調(diào)控調(diào)節(jié)細胞的分化、增殖和凋亡[19]。大量研究發(fā)現(xiàn)Mir-21與腫瘤細胞的凋亡有關(guān)。Carletti等[20]研究發(fā)現(xiàn)Mir-21是促黃體生成素誘導(dǎo)在顆粒細胞中高表達的miRNAs的一種,當體內(nèi)和體外培養(yǎng)的顆粒細胞Mir-21表達下調(diào)時,細胞凋亡增加,排卵率降低。目前已在消化系統(tǒng)、血液系統(tǒng)、神經(jīng)系統(tǒng)等中進行了一系列關(guān)于Mir-21調(diào)節(jié)的凋亡靶基因的研究,但Mir-21誘導(dǎo)卵巢顆粒細胞凋亡的具體作用機制尚不十分清楚。本研究發(fā)現(xiàn)卵巢功能減退患者較正常患者Mir-21表達下調(diào)。同時通過熒光染色技術(shù)發(fā)現(xiàn),前者顆粒細胞的凋亡情況較正常組高,進一步證實了Mir-21可能參與顆粒細胞的凋亡。由于Mir-21作用的靶基因較復(fù)雜,我們將在今后的研究中進一步探討Mir-21導(dǎo)致顆粒細胞凋亡的具體機制,為如何保護卵巢功能提供理論依據(jù)。
隨著對miRNAs作用機制的進一步的深入研究,并不斷利用最新的芯片技術(shù)手段對miRNsA和疾病之間的關(guān)系進行研究,對基因表達調(diào)控的網(wǎng)絡(luò)理解更加深入透徹。不久的將來miRNAs可能會成為疾病診斷的新的生物學(xué)標記或臨床指標,把這一分子作成藥靶,或是模擬這一分子進行新藥研發(fā),將可能會給人類疾病的早期預(yù)防、診斷及治療提供新的手段和思路。
1 Subramanian S,Steer CJ.MicroRNAs as gatekeepers of apoptosis.J Cell Physiol,2010,223:289-298.
2 Perez GI,Trbovich AM,Gosden RG,et al.Mitochondria and the death of oocytes.Nature,2000,403:500-501.
3 Das M,Djahanbakhch O,Hacihanefioglu B,et al.Granulosa cell survival and proliferation are altered in polycystic ovary syndrome.J Clin Endocrinol Metab,2008,93:881-887.
4 Chauhan P,Sodhi A,Tarang S.Cisplatin-treated murine peritoneal macrophages induce apoptosis in L929 cells:role of Fas-Fas ligand and tumor necrosis factor-tumor necrosis factor receptor 1.Anticancer Drugs,2007,18:187-196.
5 Inoue N,Maeda A,Matsuda-Minehata F,et al.Expression and localization of Fas ligand and Fas during atresia in porcine ovarian follicles.J Reprod Dev,2006,52:723-730.
6 Makarevich AV,Markkula M.Apoptosis and cell proliferation potential of bovine embryos timulated with insulinlike growth factor I during in vitromaturation and culture.Biol Reprod,2002,66:386-392.
7 Yao N,Yang BQ,Liu Y,et al.Follicle-stimulating hormone regulation of microRNA expression on progesterone production in cultured rat granulosa cells.Endocrine,2010,38:158-166.
8 Jaskelainen M,Kyranlahti A,Anttonen M,et al.TRAIL pathway components and their putative role in granulosa cell apoptosis in the human ovary.Differentiation,2009,77:369-376.
9 Vital-Reyes V,Rodríguez-Burford C,Chhieng DC,et al.Ovarianexpression of markers associated with proliferation or apoptosis in women with diminished ovarian reserve.Fertil Steril,2006,86:176-185.
10 Sirotkin AV,Laukova M,Ovcharenko D,et al.Identification of microRNAs controlling human ovarian cell proliferation and apoptosis.J Cell Physiol,2010,223:49-56.
11 Hennebold JD.Preventing granulosa cell apoptosis through the action of a single microRNA.Biol Reprod,2010,83:165-167.
12 Sirotkin AV,Laukova M,Ovcharenko D.Identification of microRNAs controlling human ovarian cell proliferation and apoptosis.J Cell Physiol,2010,223:49-56.
13 Carletti MZ,F(xiàn)iedler SD,Christenson LK.MicroRNA 21 blocks apoptosis in mouse periovulatory granulosa cells.Biol Reprod,2010,83:286-295.
14 Toloubeydokhti T,Bukulmez O,Chegini N.Potential regulatory functions of microRNAs in the ovary.Semin Reprod Med,2008,26:469-478.
15 Nagaraja AK,Andreu-Vieyra C,F(xiàn)ranco HL,et al.Deletion of Dicer in somatic cells of the female reproductive tract causes sterility.Mol Endocrinol,2008,22:2336-2352.
16 Otsuka MQ,Jing P,Georgel L,et al.Hypersusceptibility to vesicular stomatitis virus infection in Dicer1-deficient mice is due to impaired miR24 and miR93 expression.Immunity,2007,27:123-134.
17 Carletti MZ,Christenson LK.MicroRNA in the ovary and female reproductive tract.J Anim Sci,2009,87:E29-E38.
18 Raponi M,Dosssey L,Jatkoe T,et al.MicroRNA classifiers for predicting prognosis of squamous cell lung cancer.Cancer Res,2009,69:5776-5783.
19 Rabinowits G,Gercel-Taylor C,Day JM,et al.Exosomal microRNA:a diagnostic marker for lung cancer.Clin Lung Cancer,2009,10:42-46.
20 Carletti MZ,F(xiàn)iedler SD,Christenson LK.MicroRNA 21 blocks apoptosis in mouse periovulatory granulosa cells.Biol Reprod,2010,83:286-295.

