膝關節骨性關節炎氧化應激指標的臨床分期檢測及分析
楊聲波 王聰 黃紹南 毛瑜坤 許子星 李貴雙 陳鵬
作者單位: 362261福建省晉江市安海醫院骨科(楊聲波、王聰、黃紹南、毛瑜坤);福建醫科大學附屬第一醫院骨科(許子星、李貴雙、陳鵬)
膝關節骨性關節炎氧化應激指標的臨床分期檢測及分析
楊聲波王聰黃紹南毛瑜坤許子星李貴雙陳鵬
作者單位: 362261福建省晉江市安海醫院骨科(楊聲波、王聰、黃紹南、毛瑜坤);福建醫科大學附屬第一醫院骨科(許子星、李貴雙、陳鵬)
【摘要】目的檢測不同臨床分期膝關節骨性關節炎(OA)患者血清及關節液氧化應激指標水平,分析其臨床應用價值。方法2011年7月至2013年6月,收集符合美國風濕病學會OA診斷標準(ACR2007)的患者49例(觀察組),臨床分期為Ⅰ期者10例,Ⅱ期15例,Ⅲ期13例,Ⅳ期11例。以同時期健康體檢志愿者16例(無OA病史、X線檢查排除OA診斷)作為對照(對照組),2組均抽取空腹靜脈血和膝關節液。WST-1法測定過氧化物歧化酶(SOD)活性,化學法測總抗氧化能力(T-AOC)、丙二醛(MDA)和谷胱甘肽(GSH)水平,統計并分析各指標的波動。結果與對照組相比,觀察組血清與關節液T-AOC,MDA均顯著增高(P<0.01),SOD,GSH顯著降低(P<0.01)。與對照組相比,觀察組Ⅰ期OA患者血清及關節液T-AOC水平即顯著升高,Ⅱ期兩者均進一步升高,Ⅲ期與Ⅳ期之間差異無統計學意義(P>0.05),但均較Ⅱ期高。觀察組血清MDA水平顯著升高(P<0.01),各分期之間MDA差異無統計學意義(P>0.05);而關節液中,Ⅱ期OA患者較I期MDA水平顯著升高,Ⅲ、Ⅳ期MDA水平進一步升高,而2期之間差異無統計學意義(P>0.05)。觀察組OA患者血清SOD活力均明顯降低(P<0.01),4期間SOD活力水平差異無統計學意義(P>0.05);而關節液中,Ⅰ~Ⅳ期SOD水平逐漸下降,Ⅰ期患者SOD水平較對照組即明顯下降(P<0.01),Ⅱ期較Ⅰ期進一步下降,Ⅲ、Ⅳ期之間SOD水平差異無統計學意義(P>0.05),但均較Ⅱ期低(P<0.01)。對照組與觀察組各分期血清GSH水平差異均無統計學意義(P>0.05);而關節液中,觀察組Ⅰ期OA患者GSH水平較對照組升高(P<0.05),至Ⅱ期GSH水平達到頂點(P<0.05),Ⅲ、Ⅳ期GSH水平下降,均低于對照組(P<0.05)。結論不同臨床分期OA患者血清及關節液氧化應激指標水平不同;關節液及血清氧化應激指標T-AOC、MDA、SOD和GSH可作為評估OA患者病情,判斷預后的依據。
【關鍵詞】膝關節;骨性關節炎;氧化應激;關節炎分期
項目來源:晉江市技術研究與開發項目(編號: 2011Z99)
膝關節骨性關節炎(osteoarthritis,OA)是最常見慢性疾病之一,主要表現為患者關節疼痛,運動功能缺失,其主要病理特點為軟骨細胞修復不良和關節結構的破壞。研究證實,軟骨細胞退行改變是由于機械損傷與生物化學因子共同作用的結果,生物化學因子活性氧簇(reactive oxygen species,ROS)在骨關節炎的發生發展中起了重要作用。我們通過檢測及分析2011 年7月至2013年6月,49例不同臨床分期的膝關節OA患者血清及關節液中脂質過氧化產物丙二醛(MDA),及抗氧化系統中總抗氧化能力T-AOC、氧化物歧化酶(SOD)和谷胱甘肽(GSH)的水平變化,評估氧化應激指標在臨床膝關節OA診治中的意義。
1 資料與方法
1.1一般資料2011年7月至2013年6月,收集安海醫院和福建醫科大學第一醫院診治的膝關節OA患者49例(觀察組),所有患者均滿足美國風濕病學會膝關節OA的診斷標準(ACR1995)[8],依據臨床癥狀、體征及影像學表現分為四期。Ⅰ期:關節炎的發生前期,關節在活動后稍有不適,活動增加后伴有關節的疼痛及腫脹,在X線及CT檢查上看不到明顯軟骨損害跡象。Ⅱ期:關節炎改變的早期,活動多后有明顯的疼痛,休息后減輕,X線觀察,改變較少,只有CT可見軟骨輕度損害,同位素檢查,被損關節可見凝聚現象。Ⅲ期:骨性關節炎的進展期,骨軟骨進一步損害,造成關節畸形,功能部分喪失,X線可見關節間隙變窄,關節周圍骨的囊性變,有時有游離體出現。Ⅳ期:骨關節炎的晚期,骨的增生、軟骨的剝脫以及導致功能完全喪失,關節畸形明顯,X線示關節間隙變窄,增生嚴重,關節變得粗大,甚至造成骨的塌陷。49例患者中,男24例,女41例;年齡47~85歲,平均年齡64歲;病程8~36個月,平均病程17.3個月;臨床分期為Ⅰ期者10例,Ⅱ期15例,Ⅲ期13例,Ⅳ期11例。排除標準:凡有以下情形之一的患者均不予納入本次觀察: (1)有嚴重的心、肝、腎、肺等器官疾患; (2)惡性腫瘤患者; (3)診斷有炎性關節炎、痛風、骨結核、骨髓炎或急性膝關節創傷及血管神經損傷患者; (4)繼發性膝骨性關節炎患者; (5)孕婦或哺乳期女性; (6)精神疾病患者。所有患者對實驗方案均知情同意,且得到醫院倫理道德委員會批準。另選擇同時期我院16例健康體檢志愿者作為對照組,其中男7例,女9例;平均年齡61歲,均無膝痛病史,X線片排除膝關節病變。
1.2主要試劑和儀器-80℃超低溫冰箱(海爾),超速低溫離心機(Allegra TM64R,Beckman),低速離心機(TDL-50C,上海安亭科學儀器廠),水浴恒溫器儀(HHS,上海醫療器械五廠),752S分光光度儀(上海醫療器械六廠),移液器(Appendorf公司); T-AOC、MDA、SOD和GSH檢測試劑盒均由南京建成公司提供,試劑盒變異系數<15%。
1.3檢測方法血清標本的采集與保存:所有受檢者均在安靜狀態下,清晨空腹抽取靜脈血5 ml。在采集后2 h內,3 500 r/min,離心10 min,取上清液置于EP管中,-80℃冰箱保存待測。關節液標本的采集與保存:取髕下外側入路行膝關節穿刺,首先注射0.9%氯化鈉溶液5 ml,關節屈伸活動1 min后回抽2~3 ml于離心管中,3 500 r/min,離心10 min,取上清液置于EP管中,-80℃低溫冰箱保存待測。WST-1法測定SOD活性,化學法測T-AOC、MDA和GSH水平。所有檢測均按照檢測試劑盒說明書進行。
1.4統計學分析應用SPSS 16.0統計軟件,計量資料以±s表示,多組間的比較采用單因素方差分析(One-Way ANOVA),2組比較采用獨立樣本t檢驗,P <0.05為差異有統計學意義。
2 結果
2.1一般資料觀察組與對照組之間年齡、性別構成差異無統計學意義(P>0.05);體重指數觀察組明顯大于對照組(P<0.01);與對照組相比,觀察組血清與關節液T-AOC,MDA均顯著增高(P<0.01),SOD、GSH顯著降低(P<0.01)。見表1、2。

表1 2組基本臨床資料比較
表2 OA患者血清及關節液T-AOC、MDA與SOD、GSH變化±s

表2 OA患者血清及關節液T-AOC、MDA與SOD、GSH變化±s
注:與對照組比較,*P<0.01
血清 關節液T-AOC 10.4±1.2 11.6±2.2 33.9±14.2* 40.0±16.6變量 對照組(n =16)OA組(n =49)血清 關節液* MDA(nmol/ml) 4.2±0.6 6.0±0.5 16.8±5.3* 11.6±4.5* SOD(U/ml) 125±13 176±21 67±8* 100±7* GSH(mg/ml)1 650±173 552±72 1 725±156 409±28
2.2血清及關節液T-AOC水平變化與對照組相比,觀察組Ⅰ期OA患者血清及關節液T-AOC水平即顯著升高,Ⅱ期兩者均進一步升高,Ⅲ期與Ⅳ期之間差異無統計學意義(P>0.05),但均較Ⅱ期高。見圖1、表3。
表3 5組血清和關節液觀察指標比較±s
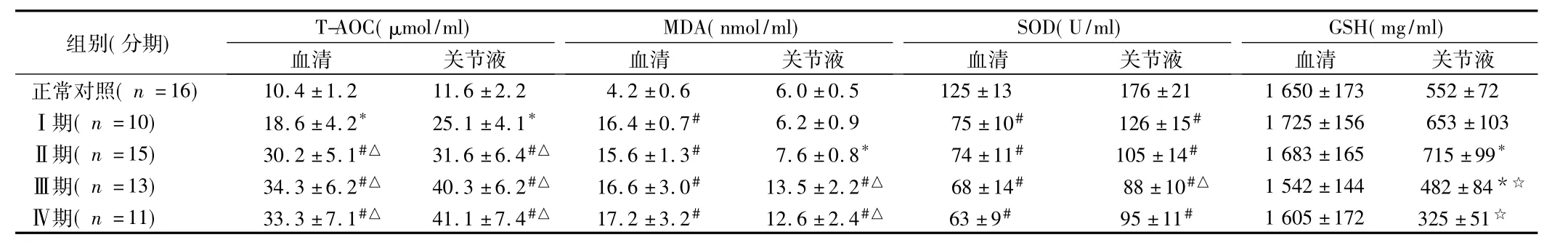
表3 5組血清和關節液觀察指標比較±s
注:與正常對照比較,*P<0.05,#P<0.01;與Ⅰ期比較,△P<0.05,與Ⅱ期比較,☆P<0.05
血清 關節液正常對照(n =16) 10.4±1.2 11.6±2.2 4.2±0.6 6.0±0.5 125±13 17組別(分期) T-AOC(μmol/ml)MDA(nmol/ml)SOD(U/ml)GSH(mg/ml)血清 關節液 血清 關節液 血清 關節液6±21 1 650±173 552±72Ⅰ期(n =10) 18.6±4.2* 25.1±4.1* 16.4±0.7# 6.2±0.9 75±10# 126±15# 1 725±156 653±103Ⅱ期(n =15) 30.2±5.1#△ 31.6±6.4#△ 15.6±1.3# 7.6±0.8* 74±11# 105±14# 1 683±165 715±99*Ⅲ期(n =13) 34.3±6.2#△ 40.3±6.2#△ 16.6±3.0# 13.5±2.2#△ 68±14# 88±10#△ 1 542±144 482±84*☆Ⅳ期(n =11) 33.3±7.1#△ 41.1±7.4#△ 17.2±3.2# 12.6±2.4#△ 63±9# 95±11# 1 605±172 325±51☆
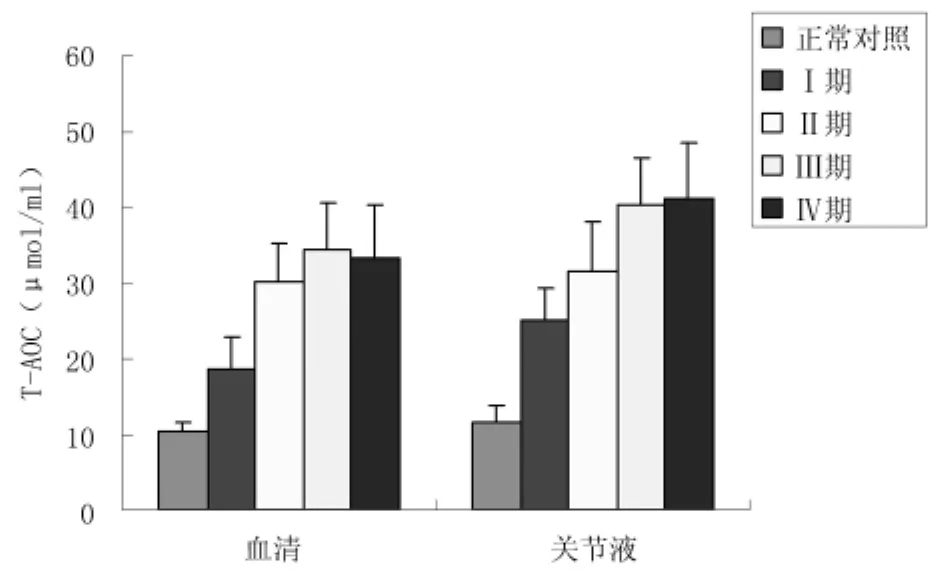
圖1 不同臨床分期OA患者血清及關節液T-AOC水平變化
2.3血清及關節液MDA水平變化與對照組相比,觀察組血清MDA水平升高(P<0.01),各分期之間MDA差異無顯著統計學意義(P>0.05);而關節液中,觀察組MDA水平與臨床分期顯著相關,Ⅱ期OA患者較Ⅰ期MDA水平顯著升高,Ⅲ、Ⅳ期MDA水平進一步升高,而兩期之間差異無統計學意義(P>0.05)。見圖2、表3。
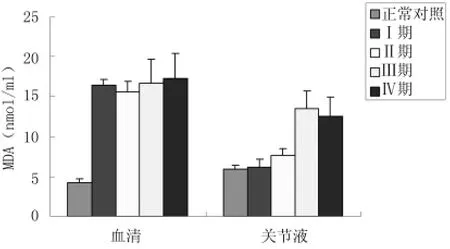
圖2 不同臨床分期OA患者血清及關節液MDA水平比較
2.4血清及關節液SOD水平變化與對照組相比,觀察組OA患者血清SOD活力均明顯降低(P<0.01),各期間SOD活力水平差異無統計學意義(P>0.05);而關節液中,OA患者SOD水平與臨床分期顯著相關,Ⅰ~Ⅳ期SOD水平逐漸下降,Ⅰ期患者SOD水平較對照組即明顯下降(P<0.01),Ⅱ期較Ⅰ期進一步下降,Ⅲ、Ⅳ期之間SOD水平差異無顯著的統計學意義(P>0.05),但均較Ⅱ期低(P<0.01)。見圖3、表3。
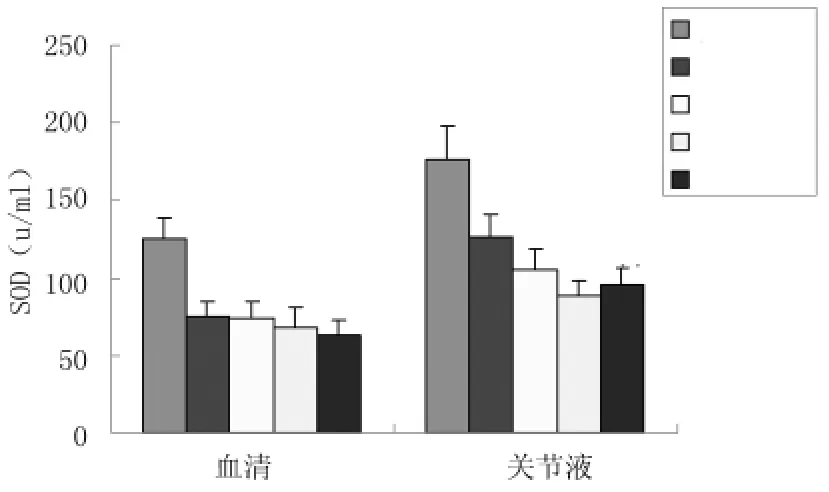
圖3 不同臨床分期OA患者血清及關節液SOD活力比較
2.5血清及關節液GSH水平變化對照組與觀察組各分期血清GSH水平差異均無顯著的統計學意義(P >0.05);而關節液中,觀察組Ⅰ期OA患者GSH水平較對照組升高(P<0.05),至Ⅱ期GSH水平達到頂點(P<0.05),Ⅲ、Ⅳ期GSH水平下降,均低于對照組(P<0.05)。見圖4、表3。
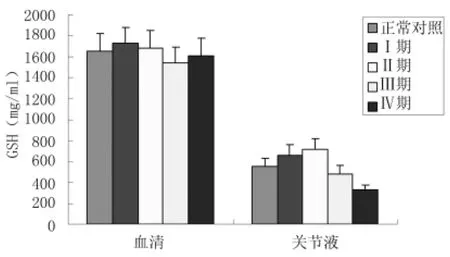
圖4 不同臨床分期OA患者血清及關節液SOD活力比較
3 討論
ROS包括超氧化物,過氧化氫,羥自由基及其代謝活性產物,過量ROS可介導細胞損傷,并參與細胞脂質及蛋白氧化,DNA變性[1]; ROS參與OA的病理生理過程[2,3]。有研究報道,OA患者血清與關節液中ROS水平顯著增加,軟骨細胞脂質氧化增強,OA患者后期關節軟骨細胞分泌與修復功能呈進行性退變;大量ROS主要攻擊的靶點為細胞膜不飽和脂肪酸脂質氧化,促使細胞結構與功能改變,并進一步導致過氧化物沉積[4]; MDA作為脂質氧化的重要產物,已廣泛應用并反映ROS脂質氧化水平,有報道證實在OA患者血清及關節液中ROS脂質氧化異常[5]; SOD是對抗ROS的第一道防線,將ROS超氧陰離子歧化反應成過氧化氫機體可減輕關節軟骨的氧化損傷[6]; GSH系統是抗氧化的重要組成,GSH通過酶性或非酶性的機制破壞ROS和其他自由基,降低ROS水平,其系統包括谷胱甘肽過氧化酶,谷胱甘肽轉移酶及谷胱甘肽[6]。Mccord等[7]認為在OA患者中抗氧化防御系統失常是導致關節氧化病理損傷重要因素,因而檢測患者血液和關節液氧自由基及抗氧化應激指標變化可間接判斷OA患者軟骨病變程度、預后以及對療效進行合理評價。
過度的氧化應激(oxidative stress)可促進炎癥、誘導細胞凋亡及破壞免疫耐受從而在自身免疫病的發展中起重要作用。多個研究者報道,OA中ROS水平的增高可能導致過氧化脂質(LPO)反應,軟骨細胞脂質氧化增強,使LPO過氧化,MDA水平升高。本研究中的OA患者血清及關節液MDA水平均顯著升高;同時我們也觀察到,OA患者血清與關節液T-AOC均高于正常組,表明MDA與ROS總氧化水平有關。Maneesh等[8]也觀察到OA病人的血清MDA水平與T-AOC高于正常人群。因此,這些發現是OA中氧自由基產生關節軟骨細胞損傷的可能證據。本研究又觀察到在不同OA臨床分期關節液T-AOC,MDA水平與臨床分期有直接的關系,即OA患者后期,T-AOC,MDA水平越高。因此,該指標可用于臨床估計OA病情進展或判定預后。但血清MDA無明顯變化,表明關節液MDA及氧化水平更能反映OA患者病情。本研究中的OA患者SOD活性顯著低于正常組。Karatas等[9]報道也證實抗氧化酶SOD活性在OA患者中顯著低于正常人群,認為OA病人中SOD活性的降低可能與過量氧自由基有關。同樣,Kalpakcioglu等[10]證實過量的過氧化氫抑制SOD活性,而在OA患者總氧化能力增強會導致過氧化氫過度積累最終抑制SOD活性; Ostalowska等[11]報道,在原發性和繼發性膝OA患者的滑膜液中發現SOD活性增高;與此相反,Scott等[12]發現在OA關節中的滑膜液SOD沒有活性;這種不一致的原因可能與OA患者關節病變程度有關。在我們結果中也發現這一現象,關節液SOD活性與OA病情有明顯相關性。Pinto等[13]的研究表明,GSH在OA患者中沒有顯著的改變,而Scott等[12]發現OA患者關節液中的GSH水平增加。這種不一致的原因可能與對象來源不同有關。本結果顯示,與對照組相比,觀察組OA患者血清GSH水平無明顯降低(P>0.05),而關節液中顯著降低(P<0.05)。進一步分析發現,血清GSH水平在不同分期患者中均無差別。而在關節液中,OA發病早期GSH水平呈反應性增加,發病后期明顯下降,這種現象從側面上反映了不同臨床分期OA患者之間,關節液中GSH水平存在差異。該結果可能解釋了上述研究結果存在不同結論的現象。
總之,我們的研究揭示了不同臨床分期OA患者血清及關節液中氧化應激指標的波動水平,這些指標的波動現象可作為臨床評估OA病情、判斷預后的依據。我們正進一步探索氧化應激指標作為判定關節置換指征及評估置換時機的可行性。
參考文獻
1 Kotani K,Sakane N,Kamimoto M,et al.Levels of reactive oxygen metabolites in patients with knee osteoarthritis.Australas J Ageing,2011,30: 231-233.
2 Henrotin Y,Kurz B,Aigner T.Oxygen and reactive oxygen species in cartilage degradation: friends or foes? Osteoarthritis and Cartilage,2005,13: 643-654.
3 Salvemini D,Little J W,Doyle T,et al.Roles of reactive oxygen and nitrogen species in pain.Free Radical Biology and Medicine,2011,51: 951-966.
4 Lipinska J,Lipinska S,Stanczyk J,et al.Reactive oxygen species and serum antioxidant defense in juvenile idiopathic arthritis.Clin Rheumatol,2014.
5 Suantawee T,Tantavisut S,Adisakwattana S,et al.Oxidative stress,vitamin e,and antioxidant capacity in knee osteoarthritis.J Clin Diagn Res,2013,7: 1855-1859.
6 Regan EA,Bowler RP,Crapo JD.Joint fluid antioxidants are decreased in osteoarthritic joints compared to joints with macroscopically intact cartilage and subacute injury.Osteoarthritis Cartilage,2008,16: 515-521.
7 Mccord JM,Edeas MA.SOD,oxidative stress and human pathologies: a brief history and a future vision.Biomed Pharmacother,2005,59: 139-142.
8 Maneesh M,Jayalekshmi H,Suma T,et al.Evidence for oxidative stress in osteoarthritis.Indian J Clin Biochem,2005,20: 129-130.
9 Karatas F,Ozates I,Canatan H,et al.Antioxidant status&lipid peroxidation in patients with rheumatoid arthritis.Indian J Med Res,2003,118: 178-181.
10 Kalpakcioglu B,Senel K.The interrelation of glutathione reductase,catalase,glutathione peroxidase,superoxide dismutase,and glucose-6-phosphate in the pathogenesis of rheumatoid arthritis.Clin Rheumatol,2008,27: 141-145.
11 Ostalowska A,Birkner E,Wiecha M,et al.Lipid peroxidation and antioxidant enzymes in synovial fluid of patients with primary and secondary osteoarthritis of the knee joint.Osteoarthritis Cartilage,2006,14: 139-145.
12 Scott JL,Gabrielides C,Davidson RK,et al.Superoxide dismutase downregulation in osteoarthritis progression and end-stage disease.Ann Rheum Dis,2010,69: 1502-1510.
13 Pinto S,Rao AV,Rao A.Lipid peroxidation,erythrocyte antioxidants and plasma antioxidants in osteoarthritis before and after homeopathic treatment.Homeopathy,2008,97: 185-189.
(收稿日期:2014-10-13)
doi:10.3969/j.issn.1002-7386.2015.06.013
【文章編號】1002-7386(2015)06-0845-04
【文獻標識碼】A
【中圖分類號】R 684.3

