GLP-1對非酒精性脂肪肝病大鼠胰島素抵抗及PKCε的影響*
周小俐, 李東風, 徐麗姝△
(1南方醫科大學,廣東 廣州 510515; 2廣東省人民醫院,廣東省醫學科學院,廣東省老年醫學研究所消化科,廣東 廣州 510080)
?
GLP-1對非酒精性脂肪肝病大鼠胰島素抵抗及PKCε的影響*
周小俐1, 李東風2, 徐麗姝2△
(1南方醫科大學,廣東 廣州 510515;2廣東省人民醫院,廣東省醫學科學院,廣東省老年醫學研究所消化科,廣東 廣州 510080)
目的: 探討胰高血糖素樣肽1(GLP-1)對非酒精性脂肪肝病SD大鼠的治療作用及可能的機制。方法: 32只SPF級雄性SD大鼠(體重約130 g)隨機抽取21只予高脂飲食(88%普通飼料+10%豬油+2%膽固醇),余下11只予普通飼料飲食作為空白對照組;12周后,將高脂飲食大鼠隨機分為2組,每組10只:高脂組予高脂飲食并腹腔注射等體積的無菌生理鹽水,治療組予高脂飲食并腹腔注射利拉魯肽(GLP-1類似物)注射液(0.6 mg·kg-1·d-1)。治療4周后處死全部大鼠抽取靜脈血并取肝臟組織。全自動生化儀檢測血清谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、甘油三酯(TG)、總膽固醇(TC)及葡萄糖(GLU)含量;ELISA法測定血清胰島素含量。石蠟包埋肝組織做病理切片及HE染色;real-time PCR法測定肝組織蛋白激酶Cε(PKCε)mRNA的表達,Western blot 測定肝組織胞漿PKCε蛋白表達。結果: 與正常對照組相比,高脂組的ALT、AST、TG、TC、胰島素抵抗指數及肝脂數均明顯升高;GLP-1治療組與高脂組相比ALT、AST、TG、TC、胰島素抵抗指數及肝脂數均下降,差異有統計學意義(P<0.05); real-time PCR及Western blot結果提示高脂組PKCε mRNA及蛋白表達減少 (P<0.05);GLP-1治療組PKCε mRNA及蛋白表達增多(P<0.05)。結論: GLP-1類似物可改善非酒精性脂肪肝的脂質代謝及胰島素抵抗,該過程可能與PKCε有關。
胰高血糖素樣肽1; 非酒精性脂肪肝; 胰島素抵抗; 蛋白激酶Cε
非酒精性脂肪肝(non-alcoholic fatty liver di-sease,NAFLD)是一種以肝臟內甘油三酯(triglyceride,TG)積聚為特征的肝臟疾病,病理組織學光鏡下約5%的肝細胞可以看到脂肪樣變,或者甘油三酯較正常人高出95%以上[1]。隨著人們生活水平的提高,該病發病率逐年上升,在發達國家成年人的發病率約30%,兒童的發病率近10%[2]。 非酒精性脂肪肝的發病機制尚未明確,目前推崇“二次打擊學說”即胰島素抵抗和氧化應激。目前的治療方法主要以改變生活方式和調整飲食結構及加強運動為主,尚缺乏有效的治療藥物。因此近年非酒精性脂肪肝的發病機制及尋求治療藥物的研究成為熱點[3]。蛋白激酶Cε(protein kinase Cε,PKCε)是胰島素抵抗高度相關的一種蛋白,在胰島素抵抗發生發展的細胞內信號通路中起著重要的作用。胰高血糖素樣肽1(glucagon-like peptide 1,GLP-1)是一種內源性腸促胰島素激素,能夠促進胰腺β細胞葡萄糖濃度依賴性地分泌胰島素[4]。最近研究發現人肝細胞存在GLP-1受體;在HepG2和Huh7肝細胞株的培養液中加入GLP-1受體興奮劑后可以減少脂肪的產生[5]。利拉魯肽是一種GLP-1類似物,與人GLP-1具有97%的序列同源性,人GLP-1可以結合并激活GLP-1 受體。此外,它能夠以葡萄糖濃度依賴的模式刺激胰島素的分泌,同時以葡萄糖濃度依賴的模式降低過高的胰高血糖素的分泌。因此,當血糖升高時,胰島素分泌受到刺激,同時胰高血糖素分泌受到抑制。與之相反,在低血糖時利拉魯肽能夠減少胰島素分泌,且不影響胰高糖素的分泌。那么利拉魯肽能否有望成為NAFLD的一種治療藥物呢?本研究通過利拉魯肽干預NAFLD大鼠模型,來探討GLP-1對NAFLD大鼠脂質代謝、肝功能、胰島素抵抗等的影響,并進一步探討其對PKCε的影響。
材 料 和 方 法
1 動物與試劑
32只SPF級雄性SD大鼠體重為(120±10)g,購自中山大學實驗動物中心,實驗動物合格證編號為44008500003375,動物實驗得到倫理委員會批準;高脂飼料購自廣東省動物實驗中心,配方為88%普通飼料+10%豬油+2%膽固醇;動物實驗場所為中山大學北校區實驗動物中心,實驗合格證編號為00061632。
GLP-1(商品名為利拉魯肽)購自丹麥諾和德公司; 葡萄糖測定試劑盒、甘油三酯測定試劑盒和膽固醇試劑盒購自北京中生北控生物科技有限公司;胰島素測定試劑盒購自上海依科賽生物科技有限公司;逆轉錄試劑盒、熒光染料均購自Thermo;細胞漿蛋白抽提液購自凱基生物技術有限公司; PKCε的 I 抗購自Abcam;II 抗購自北京博森生物科技有限公司;其它常用試劑均由廣東省人民醫院醫學實驗中心提供。
2 方法
2.1 高脂飲食誘導SD大鼠形成NAFLD模型的判斷標準[6]高脂喂養12周后,隨機抽取2只處死,檢測到血清TG、總膽固醇(total cholesterol,TC)、谷草轉氨酶(aspartate aminotransferase,AST)、谷丙轉氨酶(alanine aminotransferase,ALT)異常升高,肝組織HE染色有大量脂滴形成者可認為NAFLD造模成功。
2.2 動物喂養、造模及病變觀察 32只雄性SD大鼠適應性喂養1周后,隨機分為2組,標準普通飼料喂養11只,高脂飼料喂養21只,各組均自由飲水。第12周末2組分別隨機抽取1只大鼠,禁食12 h后,水合氯醛麻醉后抽取靜脈血5 mL用來檢測血清TC、TG、AST、ALT、空腹血糖(fasting plasma glucose,FPG)。動物處死后取出肝臟做病理切片,HE染色觀察肝組織脂肪變情況。
2.3 實驗分組及干預 第13周開始,標準飼料喂養組10只作為正常對照(normal control,NC)組,高脂飲食的20只大鼠隨機分為2組,其中一組為高飲食(high-fat diet,HFD)組,另一組為GLP-1干預(HFD+GLP-1)組。各組分別按下述進行干預:NC組10只,標準飼料喂養+生理鹽水0.6 mg·kg-1·d-1腹腔注射,時長4周;HFD組10只,高脂飼料喂養+生理鹽水0.6 mg·kg-1·d-1腹腔注射, 時長4周;HFD+GLP-1干預組10只,高脂飼料喂養+利拉魯肽注射液0.6 mg·kg-1·d-1,時長4周。干預期間注意觀察大鼠的毛發改變,食欲、大小便、活動、體重等變化情況,根據體重及大鼠的體質調整藥物劑量。
2.4 標本采集 在干預4周后,禁食12 h。稱取體重,10%水合氯醛3.5 mL/kg腹腔注射進行麻醉,腹主靜脈抽取10 mL靜脈血置4 ℃ 30 min,3 500 r/min離心15 min后取上層血清至1.5 mL EP管中并做好標記,-80 ℃保存待測生化指標及胰島素。快速完整剝離肝組織,生理鹽水漂洗血液,濾紙吸干后稱量體重并做好記錄;取肝左葉內側大小約1.0 cm×0.5 cm肝組織各1塊,10%中性甲醛固定用于石蠟包埋切片,HE染色。肝右葉同等部位取多塊肝組織,重約0.5 g~1.0 g放入1.5 mL EP管中標記好放入液氮罐速凍后轉移至-80 ℃冰箱,用于real-time PCR及Western blot檢測。
2.5 生化指標檢測 用全自動生化儀檢測血清TG、TC、FPG、AST、ALT。
(3)焊接變形控制 高強度厚板的焊接變形后期矯正很困難,因此采取合理的焊接工藝是控制小直徑鋼管焊接變形的關鍵。
2.6 血清胰島素測定 ELISA法檢測血清空腹胰島素(fasting insulin,FIN)。計算胰島素抵抗指數(insulin resistance index,HOMA-IR)。計算公式為: HOMA-IR=(FPG×FIN)/22.5(FPG 單位為mmol/L;FIN 單位為mIU/L)。
2.7 肝組織石蠟包埋切片和HE染色普通光鏡下觀察肝臟形態 取大小約0.5 cm×0.5 cm×0.5 cm 的肝組織,用10%中性甲醛固定24 h,石蠟包埋、切片,HE染色,光鏡下觀察肝臟形態學的改變對脂肪變性進行評估。
2.8 提取肝組織RNA,real-time PCR檢測PKCε mRNA表達 取50~100 mg肝組織研缽中液氮下磨成粉末狀轉移至無酶EP管中,加入1 mL TRIzol吹打混勻,冰上靜置10 min,加入0.2 mL氯仿,劇烈振蕩15 s,靜置3 min,4 ℃ 1 200×g離心15 min;取上清加入等體積異丙醇,靜置5 min,4 ℃ 1 200×g離心15 min;棄上清加入1 mL 75%乙醇充分洗滌沉淀后,4 ℃ 1 200×g離心8 min;室溫干燥,加入30~70 μL DEPC水溶解沉淀。RNA濃度測定后進行逆轉錄,real-time PCR檢測PKCε mRNA 表達。PKCε上游引物序列為5’-GAGGTCATCTGCTCTCATGTTTA-3’,下游引物序列為5’-TCCTTGCACATCCCAAAGTCA-3’。以GAPDH為內參照。PCR循環參數為95 ℃ 1 min;隨后95 ℃ 5 s,55 ℃ 15 s,72 ℃ 5 s,共45個循環;95 ℃ 60 s,50 ℃ 30 s,60 ℃,30 s。每個樣本重復3次,每次包括3個不加cDNA模板的陰性對照和只加DEPC水的空白對照。取Ct平均值,采用相對定量法分析結果,以2-ΔΔCt方法判定HFD組及GLP-1干預組相對于空白對照組肝組織中PKCε基因的相對表達倍數。Ct代表目標擴增產物達到設定閾值所經歷的循環數,ΔΔCt=(CtPKCε-CtGAPDH)處理組-(CtPKCε-CtGAPDH)對照組。
2.9 細胞漿蛋白抽提及Western blotting檢測PKCε蛋白的表達 取適量肝組織液氮下研磨成粉末,加入1 mL漿蛋白抽提液冰上裂解1 h。4 ℃ 14 000×g離心30 min取上清。BCA法測定蛋白濃度,按上樣量50 μg進行SDS-PAGE,60 V恒壓30 min,110 V恒壓60 min。采用濕轉法進行轉膜(250 mA,150 min);5%脫脂奶進行封閉2 h;I 抗(1∶500)4 ℃孵育大于12 h,II 抗(羊抗兔1∶3 000)室溫孵育1 h,ECL液進行曝光。
3 統計學處理
數據以均數±標準差(mean±SD)表示,采用SPSS 13.0 統計軟件進行正態性、方差齊性檢驗,若資料符合正態性、方差齊,采用完全隨機設計的方差分析;方差不齊時采用近似F檢驗的Welch法;多重比較用LSD法;以P<0.05為差異有統計學意義。
結 果
高脂飲食第12周,普通飼料飲食組及高脂飲食組各隨機處死1只,HFD組大鼠肝病理檢查有明顯脂肪變性。干預過程中正常對照組活動度好,飲食正常,皮毛整潔。HFD組活動減少,飲食增多,毛發凌亂黃膩。GLP-1干預組大鼠的一般情況與正常對照組相似。
2 各組大鼠體質量、肝重量、肝指數的改變
與正常對照組比,HFD組的肝指數明顯升高(P<0.05);與HFD組相比,給藥4周后,GLP-1干預組的肝指數顯著降低(P<0.05),見表1。

表1 各組體質量、肝質量、肝指數
*P<0.05vsNC group;#P<0.05vsHFD group.
3 各組血清脂質及肝功能的改變
與正常對照組比,HFD組血清的TG、TC、ALT和AST明顯升高(P<0.05);與HFD組比,給藥4周后,GLP-1干預組血清的TG、TC、ALT和AST均明顯減低(P<0.05),見表2。
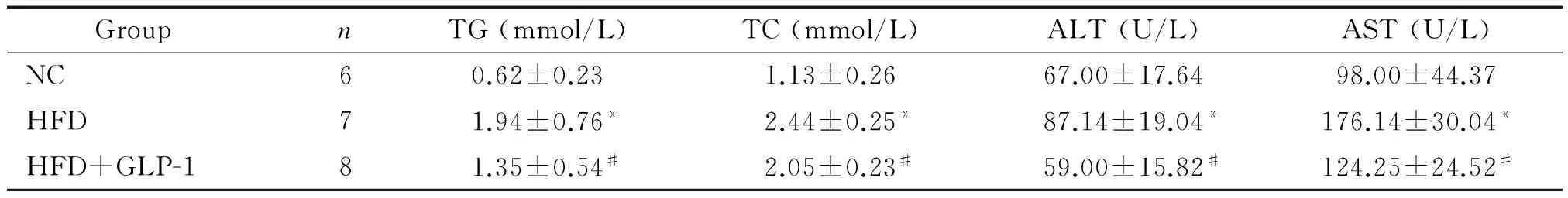
表2 各組血清脂質與肝功能
*P<0.05vsNC group;#P<0.05vsHFD group.
4 各組血糖、胰島素、HOMA-IR的變化
與正常對照組比,HFD組的胰島素、HOMA-IR均明顯升高(P<0.05);與HFD組比,給藥4周后,GLP-1干預組的胰島素、HOMA-IR均降低(P<0.05),見表3。

表3 各組血糖、胰島素變化
*P<0.05vsNC group;#P<0.05vsHFD group.
5 各組病理變化情況
HE染色觀察各組病理變化。正常對照組大鼠的肝臟組織結構正常,肝小葉結構明顯,肝細胞索呈放射狀排列,肝細胞無變性。HFD組的肝細胞彌漫小泡性脂肪空泡變性、重度水樣變性,細胞核被擠壓變形部分消失,肝索紊亂,肝竇狹窄或消失,但未見明顯炎癥、纖維化、壞死等病灶。GLP-1干預組的肝臟組織可見脂肪變性和水樣變性,程度較HFD組明顯減輕,見圖1。
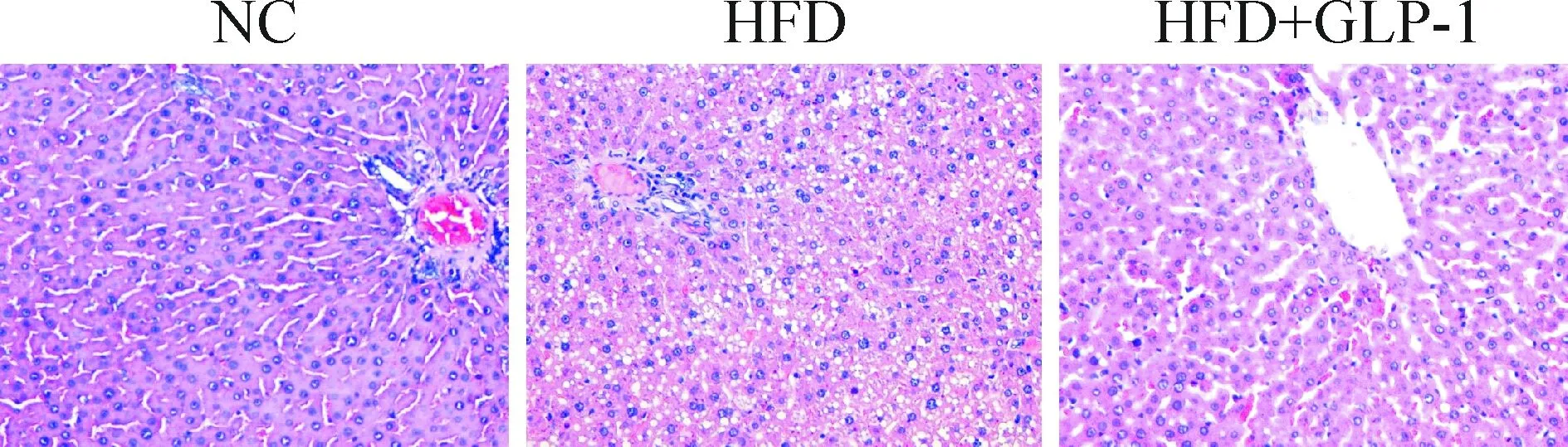
Figure 1.HE staining of the liver tissues (×200).
圖1 各組肝組織HE染色觀察
6 各組PKCε mRNA的表達
Real-time PCR結果可見PKCε mRNA HFD組較正常對照組表達下降(P<0.05),而GLP-1干預組較HFD組表達升高(P<0.05),見圖2。
7 各組PKCε蛋白的表達
Western blot結果可見PKCε蛋白HFD組較正常對照組表達下降,而GLP-1干預組較模型對照組表達升高,見圖3。
討 論
非酒精性脂肪肝發病機制復雜,目前較為經典的機制是“二次打擊學說”,即肝臟胰島素抵抗和氧化應激[2]。在NAFLD的病程進展中,胰島素抵抗扮

Figure 2.The mRNA expression of PKCε in the liver tissues detected by real-time PCR. Mean±SD.n=8.*P<0.05vsNC group;#P<0.05vsHFD group.
圖2 Real-time PCR 檢測肝臟組織PKCε mRNA表達
演著重要的角色,研究表明在高脂飲食的大鼠模型中產生了胰島素抵抗,同時肝臟也存在胰島素抵抗[7],長期高脂飲食大鼠甚至還存在胰島炎癥[7-8]。當營養輸入過多時,肝臟中脂質積聚,異位脂質的積聚可引起NAFLD的病理生理進展及胰島素抵抗[9]。PKCε是PKC家族的一種亞型,通常PKC在肝臟中的表達較低,但是PKCε在肝臟中的表達較高,研究已經表明在非酒精性脂肪肝中PKCε可被激活,主要表現為PKCε由胞漿轉位至包膜上呈現表達下降,在嚙齒類動物模型實驗中已經證實PKCε與肝臟胰島素抵抗密切相關[10]。當PKCε相關基因下調時,胰島素抵抗可被抑制。人體及NAFLD動物模型均表明肝臟內脂質、二酰甘油(diacylglycerol,DAG )的積聚可活化PKCε從而引起肝臟的胰島素抵抗。此外,近期研究還發現肝細胞內過多的DAG是促成肝臟胰島素抵抗的關鍵性因素,DAG激活PKCε可能是NAFLD相關胰島素抵抗的重要途徑[11]。PKCε的激活主要是通過該蛋白的膜轉位實現的,當PKCε由胞漿轉移到胞膜時其活性增加。研究證明非酒精性脂肪肝病動物模型肝組織中PKCε的活性增加,表現為PKCε膜轉位增加[10]。因此,如果藥物可以抑制PKCε的活性,則對非酒精性脂肪肝的胰島素抵抗可有一定的改善作用。

Figure 3.The protein expression of PKCε in the liver tissues detected by Western blot. Mean±SD.n=8.*P<0.05vsNC group;#P<0.05vsHFD group.
圖3 Western blot 檢測肝臟組織胞漿中PKCε的蛋白表達
GLP-1已廣泛用于2型糖尿病的治療,在小鼠模型中可降低轉氨酶水平和甘油三酯的積聚并改善胰島素抵抗[12]。前期研究已證明利拉魯肽不僅可改善非酒精性脂肪肝大鼠模型的氧化應激水平和降低TNF-α及TGF-β1炎癥因子水平[13],還能改善胰島素抵抗[14]。本實驗利用GLP-1類似物利拉魯肽腹腔注射治療NAFLD SD大鼠模型4周后,可以使轉氨酶水平下降;同時甘油三酯及總膽固醇水平下降;病理組織染色也提示肝脂肪變性明顯改善;HFD組胰島素水平明顯高于GLP-1治療組的胰島素水平;這是由于GLP-1的作用機制是通過葡萄糖依賴性的調節來刺激胰島β細胞釋放胰島素,當血糖水平較低時其刺激作用消失,這在治療NAFLD時恰恰是種優勢,不會出現低血糖的不良反應。同時HFD組中肝組織PKCε的活性增強,和文獻報道相一致,GLP-1治療組的PKCε活性下降,表明該藥物可以影響胰島素抵抗的相關信號通路從而阻止了胰島素抵抗的進展,增強了胰島素的敏感性。
[1] Stefan N, Haring HU. The metabolically benign and malignant fatty liver[J]. Diabetes, 2011, 60(8):2011-2017.
[2] Cohen JC, Horton JD, Hobbs HH. Human fatty liver disease: old questions and new insights[J]. Science, 2011, 332(6037):1519-1523.
[3] Malinowski SS, Byrd JS, Bell AM, et al. Pharmacologic therapy for nonalcoholic fatty liver disease in adults[J]. Pharmacotherapy, 2013, 33(2):223-242.
[4] Sharma S, Mells JE, Fu PP, et al. GLP-1 analogs reduce hepatocyte steatosis and improve survival by enhancing the unfolded protein response and promoting macroautophagy[J]. PLoS One, 2011, 6(9):e25269.
[5] Svegliati-Baroni G, Saccomanno S, Rychlicki C, et al. Glucagon-like peptide-1 receptor activation stimulates hepatic lipid oxidation and restores hepatic signalling alteration induced by a high-fat diet in nonalcoholic steatohepatitis[J]. Liver Int, 2011, 31(9):1285-1297.
[6] 潘 勤,范建高. 高脂飲食誘導非酒精性脂肪性肝病動物模型的研究進展[J]. 國際消化病雜志, 2009, 29(4):255-257.
[7] 李蘭芳,郭 玉,唐國濤,等. 高脂飲食導致大鼠肝臟胰島素抵抗的作用機制研究[J].中國病理生理雜志, 2011, 27(2):310-314.
[8] 李 新,袁 莉,李 進,等. 長期高脂喂養大鼠胰島功能改變與胰島炎癥反應有關[J]. 中國病理生理雜志, 2009, 25(5):949-954.
[9] Birkenfeld AL, Shulman GI. Nonalcoholic fatty liver disease, hepatic insulin resistance, and type 2 diabetes[J]. Hepatology, 2014, 59(2):713-723.
[10]Samuel VT, Liu ZX, Qu X, et al. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease[J]. J Biol Chem, 2004, 279(31):32345-32353.
[11]Samuel VT, Petersen KF, Shulman GI. Lipid-induced insulin resistance: unravelling the mechanism[J]. Lancet, 2010, 375(9733):2267-2277.
[12]Gupta NA, Mells J, Dunham RM, et al. Glucagon-like peptide-1 receptor is present on human hepatocytes and has a direct role in decreasing hepatic steatosisinvitroby modulating elements of the insulin signaling pathway[J]. Hepatology, 2010, 51(5):1584-1592.
[13]高慧亭,徐麗姝,李東風,等. GLP-1對非酒精性脂肪肝大鼠肝氧化應激及TNF-α、TGF-β1的影響[J]. 南方醫科大學學報, 2013, 33(11):1661-1664.
[14]曾志剛,徐麗姝,關麗嫦,等. 利拉魯肽對非酒精性脂肪肝大鼠脂聯素及胰島素抵抗的影響[J]. 中國病理生理雜志, 2014, 30(3):533-537.
Effect of GLP-1 on insulin resistance and PKCε in rats with nonalcoholic fatty liver disease induced by high fat diet
ZHOU Xiao-li1, LI Dong-feng2, XU Li-shu2
(SouthernMedicalUniversity,Guangzhou510515,China;2DepartmentofGastroenterology,GuangdongAcademyofMedicalSciences,GuangdongGeneralHospital,GuangdongProvincialInstituteofGeriatrics,Guangzhou510080,China.E-mail:xulishu70@163.com)
AIM: To observe the therapeutic effect of glucagon-like peptide 1 (GLP-1) analog on nonalcoholic fatty liver disease of rats and to investigate the underlying mechanism. METHODS: SD rats (n=21) were used to establish a nonalcoholic fatty liver disease model by feeding a high fat diet for 12 weeks, and other 11 rats were fed with a normal diet for 16 weeks. The model rats were randomly divided into 2 equal groups: one group was treated with glucagon-like peptide 1 analog (0.6 mg·kg-1·d-1) by intraperitoneal injection for 4 weeks, the other group using saline as a control. After treatment, fasting blood glucose, serum insulin, blood lipids, liver function and the pathological changes of the hepatic tissues were evaluated and the expression of PKCε at mRNA and protein levels in the liver tissues was detected by real-time PCR and Western blot, respectively. RESULTS: Compared with model group, the intervention of GLP-1 significantly reduced insulin resistance index (HOMA-IR), improved the liver function (P<0.05), decreased the liver index and blood lipids (P<0.05). HE staining showed obvious pathological changes of the hepatic tissues in model group, and the intervention of GLP-1 significantly reduced lipid droplets in the hepatocytes and improved the structural damage of the liver. The expression of hepatic protein kinase Cε (PKCε) at mRNA and protein levels significantly decreased which were reversed by treating with GLP-1. CONCLUSION: GLP-1 shows good therapeutic effect on nonalcoholic fatty liver disease of rats, possibly by controlling lipid metabolism and reducing insulin resistance, which may be related to PKCε expression.
Glucagon-like peptide 1; Non-alcoholic fatty liver disease; Insulin resistance; Protein kinase Cε
1000- 4718(2015)04- 0690- 05
2014- 12- 18
2015- 03- 11
廣東省自然科學基金資助項目(No. S2012010010953)
R363.2
A
10.3969/j.issn.1000- 4718.2015.04.021
△通訊作者 Tel: 020-83827812; E-mail: xulishu70@163.com

