不同途徑輸注DC-CIK聯合TACE治療進展期肝癌的臨床研究
邱寶安,吳印濤,趙文超,夏念信,楊英祥,劉 鵬,祝建勇,安 陽,王敬晗
?
·論著·
不同途徑輸注DC-CIK聯合TACE治療進展期肝癌的臨床研究
邱寶安,吳印濤,趙文超,夏念信,楊英祥,劉 鵬,祝建勇,安 陽,王敬晗
目的 探討不同途徑輸注DC-CIK聯合TACE對進展期肝細胞癌的治療價值。方法 自2011年3月1日—2014年1月1日,選取收治入院的進展期肝細胞癌146例,隨機分成3組。A組51例,單純行TACE治療;B組46例,行TACE治療+外周靜脈回輸DC-CIK細胞治療;C組49例,行TACE治療+肝動脈回輸DC-CIK細胞治療。觀察治療后AFP、肝功能、腫瘤進展情況、T細胞亞群變化、毒副作用及病人生存率情況。結果 治療后B組CD3+、CD4+和C組CD3+、CD4+、CD8+及CD4+/CD8+均高于A組和本組治療前(P<0.05);B、C組間比較無顯著差異(P>0.05)。A組和B組半年進展率、生存率比較無顯著差異(P>0.05);C組與其余兩組比較差異有統計學意義(P<0.05)。結論 局部應用CIK聯合TACE較全身應用CIK聯合TACE是安全的方法,可提高治療效果,延長患者生存期,具有一定的臨床意義。
肝腫瘤;樹突細胞;細胞因子誘導殺傷細胞;輸注,動脈內;輸注,靜脈內
臨床上,進展期肝細胞癌在肝癌占有著重要的比例,有報道指出高達70%~80%[1-2],對于此類患者,已經失去手術機會,傳統的介入治療水平也已達到療效瓶頸,很難有進一步提升的空間。近年研究表明,樹突狀細胞-細胞因子激活的殺傷細胞(DC-CIK)可明顯地抑制腫瘤生長,并且DC-CIK可以抑制乙肝病毒復制,抑制病毒性肝炎的進展[3-5]。研究表明,DC-CIK治療效果與其數量、細胞活性存在相關性[6];因此,有必要觀察腫瘤局部應用與全身應用療效的差異,進一步探討提高進展期肝癌療效的可能性。
1 對象與方法
1.1 研究對象 入選標準:選取2011年3月1日—2014年1月1日收治的不符合手術指征的進展期肝細胞癌患者,均經病理學、影像學或腫瘤標志物確診;排除標準:Child-Pugh肝功能分級為C、肝外存在腫瘤轉移者、碘制劑過敏難以治療、患者及家屬不同意入組者。共選取146例,男128例,女18例,年齡35~72歲(平均55.7歲),所有入組患者采用抽簽隨機分為A、B、C組,3組間患者數量、性別、年齡、甲胎蛋白(AFP)值、肝功能分級、腫瘤大小、數量及有無門靜脈癌栓等一般資料比較差異無統計學意義(P>0.05),具有可比性,見表1。所有入組患者均已簽署知情同意書,并經醫院倫理委員會批準。

表1 3組患者一般資料比較
注:A組僅給予TACE治療,B組給予外周靜脈輸注DC-CIK+TACE治療,C組給予肝動脈輸注DC-CIK+TACE治療
1.2 治療方法 B組在行肝動脈化療栓塞術(transarterial chemoembolization, TACE)前一天抽血采集細胞進行培養擴增,TACE術后2周,待化療藥物洗脫后行外周靜脈輸注DC-CIK,分兩天給予。C組同樣在TACE前一天抽血采集細胞進行培養擴增,兩周藥物洗脫后行肝動脈造影,腫瘤區域供應的動脈內輸注DC-CIK,另外一次隔日外周輸注DC-CIK。A組僅行TACE,不行DC-CIK輸注。
1.3 DC-CIK細胞的制備 所有入組患者均簽署知情同意書,在行TACE治療當天早晨空腹用真空采血管采集外周靜脈血54 ml,然后在藥品生產質量管理規范(GMP)實驗室分離單個核細胞(peripheral blood mononuclearcells, PBMC),用GT-T551無血清淋巴細胞培養液調整細胞濃度為1×106個/ml,在每毫升細胞懸液中加入α-干擾素(IFN-α)800 U/ml,加入10%的自體血漿,轉入用5 μg/ml CD3單抗預先包被的培養瓶中,放置37℃,5%CO2培養箱中培養,第2天添加培養液并加入重組人白介素-2(rhIL-2)1000 U/ml,期間根據細胞生長情況補充GT-T551培養液、自體血漿和相應的rhIL-2,培養至第5天,根據細胞增殖情況調整細胞密度,并轉入GTT610(A)透氣培養袋進行擴大培養,每2~3天根據細胞的生長增殖情況,補充GT-T551淋巴細胞培養液、相應的rhIL-2和自體血漿。并采用臺盼藍拒染法計數,檢測細胞表面標記CD3、CD4、CD8以鑒定DC-CIK細胞。并在培養的第5、10、12天分別取樣行細菌和真菌培養,并于回輸前取樣行內毒素和支原體檢測,所有結果均為陰性才能收獲細胞并計數,臺盼藍染色法檢測細胞活力,每次回輸的細胞數量>2×109個,共回輸細胞數量>1×1010個,細胞活率>95%。收獲細胞經洗滌配成200 ml細胞懸液,加入5%的人血白蛋白和20萬單位白細胞介素-2,混勻后送病房立即給患者回輸。以上操作除采血外,其余均在我院生物醫學治療中心進行[6]。
1.4 TACE治療 應用Seldinger技術,經股動脈穿刺置管,選擇性插入腫瘤供應靶動脈,造影明確后進行化療及栓塞。化療方案為:替加氟1000 mg,表阿霉素20~30 mg,卡鉑40 mg。栓塞劑選用碘化油,用量以腫瘤區域無明顯血供為準,劑量范圍20~60 ml。TACE合并DC-CIK全身或局部應用患者,在栓塞后2周藥物洗脫后進行。
1.5 DC-CIK細胞的回輸 采血后2周進行CIK細胞收獲,立即無菌運送到病房給患者回輸,共進行兩次回輸。B組兩次均采用外周靜脈回輸,輸注前常規靜脈應用甲潑尼龍20 mg。C組第1次細胞回輸采取經股動脈穿刺置管,經肝固有動脈回輸的方法,第2次采取外周靜脈回輸的方法。B、C兩組均當日回輸DC-CIK細胞5×109個,隔日再次回輸5×109個,回輸細胞總數共計>10×109個。
1.6 觀察指標 觀察指標包括AFP、肝功能、腫瘤進展情況、T細胞亞群變化、毒副作用及患者生存率,術后每1個月復查1次肝臟CT或B超。DC-CIK細胞治療前及治療后2周,用流式細胞儀檢測3組患者外周血T細胞亞群(CD3+、CD4+、CD8+、CD4+/CD8+)。細胞回輸過程中,觀察患者有無過敏、休克等不良反應。
2 結果
2.1 T細胞亞群 治療后B組CD3+、CD4+均高于A組和治療前(P<0.05),C組CD3+、CD4+、CD8+均高于A組和治療前(P<0.05),治療后B組CD8+、CD4+/CD8+和C組CD4+/CD8+與A組及治療前比較,差異無統計學意義(P>0.05),治療后B組和C組CD3+、CD4+、CD8+及CD4+/CD8+比較差異無統計學意義(P>0.05),見表2。
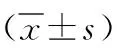
表2 3組患者治療前后T細胞亞群變化比較
注:A組僅給予TACE治療,B組給予外周靜脈輸注DC-CIK+TACE治療,C組給予肝動脈輸注DC-CIK+TACE治療;與治療前比較,aP<0.05;與A組治療后比較,cP<0.05
2.2 AFP變化情況 患者行TACE術后均有一定程度的肝損害,表現為轉氨酶的升高或合并輕度膽紅素的改變,經保肝等對癥處理后1周左右,肝功能基本恢復正常。AFP的變化:各組術前AFP升高的患者,TACE術后均有不同程度的降低,A組、B組和C組分別為35例、32例、33例,分別占68.6%、69.6%和67.3%,3組間比較差異無統計學意義(P>0.05)。
2.3 毒副反應 在DC-CIK細胞輸注的毒副作用方面,主要表現為術后一過性發熱(8/95),未見其他不良反應,對癥處理后緩解。B組術后出現3例一過性發熱,C組術后出現5例一過性發熱,兩組間比較差異無統計學意義(P>0.05)。
2.4 腫瘤進展與患者生存情況 全部患者腫瘤進展均得到一定的控制,半年后仍有一定的患者出現腫瘤進展,表現為腫瘤體積增大、出現新的病灶及AFP的進一步升高。A組和B組的半年進展率各為37.3%(19/51)和39.1%(18/46),兩組比較差異無統計學意義(P>0.05);C組為18.4%(9/49),與其余兩組比較差異有統計學意義(P<0.05)。
在生存率方面,進展期肝癌患者半年生存率,A組與B組分別為70.6%(36/51)和73.9%(34/46),兩組間比較差異無統計學意義(P>0.05),提示外周輸注DC-CIK細胞可以改善T細胞亞群的功能,但對生存影響有限;C組為91.8%(45/49),與其余兩組比較差異有統計學意義(P<0.05),考慮局部沉積的DC-CIK細胞可能在控制腫瘤發展,改善早期患者生存中具有一定作用。3組患者1年生存率比較差異無統計學意義(P>0.05),見圖1。
3 討論
肝癌為影響我國人民身體健康第二大疾病。由于我國乙型肝炎患者數量眾多,大約有20%的乙型肝炎患者轉化為乙肝肝硬化[7-8]。肝炎、肝硬化、肝癌被公認是肝癌三步曲。肝癌發病隱襲,進展迅速,患者就診時往往已屬中晚期,絕大多數已失去手術機會。TACE被普遍認為是不能手術切除肝癌的首選治療方法[9]。但是,許多單純TACE治療的肝癌患者,即使多次重復治療,腫瘤病灶內仍有癌細胞殘存[10-11]。與此同時,TACE難以徹底殺滅腫瘤,對于大多數患者難以維持長期生存,其治療方法已經達到峰值,難有進一步提升空間。

圖1 3組進展期肝癌患者生存曲線
A組僅給予TACE治療,B組給予外周靜脈輸注DC-CIK+TACE治療,C組給予肝動脈輸注DC-CIK+TACE治療
DC-CIK作為近年來廣泛應用的抗腫瘤治療,研究表明,多種細胞因子誘導的殺傷細胞(CIK)細胞可直接殺傷腫瘤細胞,通過黏附因子LFA-1/ICAM-1途徑與腫瘤細胞結合后,分泌含大量BLT酯酶的顆粒,這些顆粒能穿透靶細胞膜,導致腫瘤細胞的裂解[12]。同時,CIK細胞可通過釋放多種細胞因子殺傷腫瘤細胞,這些腫瘤因子不僅對腫瘤細胞有直接抑制作用,還可通過調節免疫系統間接殺傷瘤細胞。CIK細胞可以分泌大量的IFN-α。IFN-α是由CD4+或CD8+細胞產生的同源二聚體糖蛋白,可通過多種途徑直接或間接發揮抗腫瘤作用,增強自然殺傷細胞(NK)、巨噬細胞(M5)以及細胞毒性T細胞(CTL)的活性;IFN-α還可以促進腫瘤細胞表達MHC-類分子,有助于腫瘤抗原的遞呈和激活細胞毒性T淋巴細胞。CIK細胞誘導腫瘤細胞凋亡及壞死,能活化腫瘤細胞凋亡基因。[13-14]
與此同時,研究表明DC-CIK細胞溶瘤作用與其數量及功能密切相關[13-14]。回輸細胞數量越多治療效果越好,并要求于手術或放、化療之后過繼性細胞免疫治療越早效果越好。回輸的細胞組成以免疫效應細胞為主,要求FACS檢測CD3+、CD56+細胞≥30%,CD3+、CD8+≥60%,細胞活力≥95%。單純CIK的溶瘤率為15%,而共培養的DC-CIK的溶瘤率可達71%,并且分泌更多的γ-干擾素,增強TH1型細胞免疫功能[13-14]。臨床上,過繼性免疫細胞主要通過靜脈途徑回輸。這些細胞進入人體以后首先到達肺臟,并于2~4 h達到高峰,隨后分布到肝、腎、脾等部位,24 h趨于穩定[15]。類似于藥物的首過效應,過繼性免疫細胞最先到達的器官獲得最大限度的截留[15]。肺癌治療例數最多或是原因之一[16]。過繼性免疫細胞對腫瘤組織是否具有偏嗜性尚有爭議。理論上,灌注治療能實現CIK細胞的肝臟聚集,因此治療效果較好[17-23]。但由于肝動脈造影是有創治療,會對患者造成傷害,治療次數應有限制,因此選擇前期DC-CIK細胞灌注沖擊治療一定療程,患者病情穩定后予以CIK細胞靜脈回輸鞏固治療比較合理。本組臨床觀察發現,采取肝動脈直接將DC-CIK細胞回輸入肝臟可以提升療效,提高患者的生存質量。本研究顯示,局部動脈應用DC-CIK細胞與外周靜脈應用比較,雖然A、B組對血液T細胞亞群的影響并無明顯差異,但腫瘤進展率及患者半年生存率有明顯差異,體現局部應用可以提高CIK細胞效果。通過肝動脈局部應用DC-CIK細胞導致腫瘤進展時間延長的機制尚不清楚,這可能與局部DC-CIK細胞在腫瘤附近存留的數量存在一定關系。此外,臨床可觀察到B、C組少數患者(3/95)出現了非常令人振奮的現象,DC-CIK免疫細胞治療使乙肝患者表面抗原轉陰,使肝癌患者在病毒清除方面獲益,但其具體機制尚不明確,這些治療作用為治療計劃的制定提供了新的思路,這將是我們今后工作的重點。
綜上所述,DC-CIK細胞聯合TACE治療是進展期肝癌治療的一種有效方法,尤其是結合局部輸注DC-CIK細胞,可以殺傷腫瘤細胞,同時減少乙肝病毒數量,值得進一步擴大樣本量,進行更廣泛和深入的研究。
[1] 錢建民.肝癌外科治療的臨床進展[J].中國腫瘤外科雜志,2009,1(1):7-10.
[2] 楊秉輝.原發性肝癌的診療進展[J].中國臨床醫學2002,9(3):201-202.
[3] Kim H M, Lim J, Yoon Y D,etal. Anti-tumor activity of ex vivo expanded cytokine-induced killer cells against human hepatocellular carcinoma[J].Int Immunopharmacol, 2007,7(13):1793-1801.
[4] Mesiano G, Todorovic M, Gammaitoni L,etal. Cytokine-induced killer (CIK) cells as feasible and effective adoptive immunotherapy for the treatment of solid tumors[J].Expert Opin Biol Ther, 2012,12(6):673-684.
[5] 全玲麗,唐雪元.DC-CIK治療惡性腫瘤的進展[J].中國醫藥指南,2013,(31):59-60.
[6] 馬學斌,馬聰,邱偉等.CIK細胞治療90例腫瘤患者的安全性分析[J].腫瘤學雜志,2014,20(3):230-233.
[7] 吳孟超.肝癌外科綜合治療的現狀和前景[J].中華肝膽外科雜志,2006,12(1):1-4.
[8] 湯釗猷.肝癌外科若干問題的我見[J].中華肝膽外科雜志,2006,12(2):73-74.
[9] Ueno K, Miyazono N, Inoue H,etal. Transcather arterial chemoembolization therapy using iodized oil for patients with unresectable hepatocellular carcinoma: evaluation of three kinds of regimens and analysis of prognostic factors[J].Cancer, 2000,88(7):1574-1581.
[10]黃潔夫,李錦清,梁力建,等.合理運用經導管肝動脈化療栓塞治療原發性肝癌[J].癌癥,1999,18(2):113-115.
[11]茅國新,于志堅,張一心,等.經導管肝動脈和B超引導下經細針門靜脈雙重化療栓塞治療原發性肝癌[J].中華腫瘤雜志,2002,24(4):391-393.
[12]Lin G, Wang J, Lao X,etal. Interleukin-6 inhibits regulatory T cells and improves the proliferation and cytotoxic activityof cytokine-induced killer cells[J].J Immunother, 2012,35(4):337-343.
[13]Wang Q J, Wang H, Pan K,etal. Comparative study on anti-tumor immune response of autologous cytokine-induced killer(CIK) cells, dendritic cell-CIK(DC-CIK),and semi-allogeneic DC-CIK[J].Chin J Cancer, 2010,29(7):641-648.
[14]Skitzki J, Craig R A, Okuyama R,etal. Donor cell cycling, trafficking and accumulation during adoptive immunotherapy for murine lung metastases[J].Cancer Res, 2004,64(6):2183-2191.
[15]Ai J,Bai Y M, Li Q X,etal. Anti-tumor activity of CIK cells on cervical cancer Hela cells in vitro and in vivo and their distribution characteristics in tumor-bearing mice[J].Chinese Journal of Cancer Biotherapy,2012,19(4):374-380.
[16]Zheng F C, Zhang X Y,Feng H Z,etal. Clinical study of stereotactic conformal body ?-knife combined with adoptive immunotherapy (dendritic cell and cytokine-inducedkiller cell) in the treatment for advanced non-small cell lung cancer[J].Journal of Chinese Oncology, 2012,18(11):815-818.
[17]陳曉,何敏潔,董堅,等.TACE聯合CIK治療原發性肝癌方案分析[J].西部醫學,2012,24(9):1686-1688.
[18]侍作亮,張蘊春,卞建民,等.小劑量白細胞介素2聯合肝動脈化療栓塞術和CT引導下射頻消融術治療大于5 cm原發性肝癌的療效和安全性[J].中國醫藥,2015,10(1):17-21.
[19]陳玉,馮大剛,羅先欽,等.半枝蓮和白花蛇舌草總多糖對肝癌脾虛證候動物模型的干預研究[J].中國醫藥,2014,9(10):1501-1505.
[20]陳生貴,李勁,陳首名,等.原發性肝癌合并胰腺癌一例[J].中華消化外科雜志,2014,13(10):816-817.
[21]段昌虎,蘇志雷,李春龍,等.肝癌合并下腔靜脈癌栓的外科治療[J].中華消化外科雜志,2014,13(9):722-725.
[22]夏景林.原發性肝癌的規范化診療[J].中國臨床醫生,2012,40(1):26-30.
[23]趙峰,鄂亞軍.經導管動脈化療栓塞聯合射頻消融治療原發性肝癌臨床觀察[J].解放軍醫藥雜志,2014(8):60-63.
A Clinical Study of Different Approaches of DC-CIK Infusion Combined with TACE in Treatment of Aggressive-phase Hepatocellular Carcinoma
QIU Bao-an, WU Yin-tao, ZHAO Wen-chao, XIA Nian-xin, YANG Ying-xiang, LIU Peng, ZHU Jian-yong, AN Yang, WANG Jing-han
(Department of Genneral Surgery, General Hospital of the Chinese Navy, Beijing 100048, China)
Objective To explore therapeutic value of different approaches of DC-CIK (dendritic cell- cytokine-induced killer cells) infusion combined with TACE in treatment of aggressive-phase hepatocellular carcinoma. Methods A total of 146 inpatients with aggressive-phase hepatocellular carcinoma admitted during Mar 1, 2011 and Jan 1, 2014 were divided into group A (n=51)undergoing single TACE therapy, group B (n=46) undergoing TACE and peripheral vein return infusion of DC-CIK and group C (n=49) undergoing TACE and hepatic artery return infusion of DC-CIK. The conditions of AFP (alpha-fetoprotein), liver function, tumor progression, T-cell subset changes, toxic and side-effect and survival rate of patients after the therapy were observed. Results The levels of CD3 and CD4 in group B and levels of CD3, CD4, CD8 and CD4/CD8 after the therapy in group C were significantly higher than those in group A and those before the therapy in the same group (P<0.05); but the differences between group B and C were not statistically significant (P>0.05). The differences in progression and survival rates of six months between group A and B were not statistically significant (P>0.05); while the differences between group C and group A and B were statistically significant (P<0.05). Conclusion Local use of CIK-DC combined with TACE is safer than the total use of CIK-DC combined with TACE, and it can improve treatment effectiveness and increase life span of patients, which has certain clinical significance.
Liver neoplasms; Dendritic cells; Cytokine-induced killer cells; Infusions, intra-arterial; Infusions, intravenous
北京市科委“首都市民健康培育項目”(Z141100002114015)
100048 北京,海軍總醫院肝膽外科
邱寶安,Email:luckqiu@medmail.com
R735.7
A
2095-140X(2015)03-0058-05
10.3969/j.issn.2095-140X.2015.03.014
2014-10-30 修回時間:2015-01-01)

