MADPH氧化酶抑制劑對晚期氧化蛋白產物誘導內皮細胞高通透性的影響及機制*
張 瑛,夏學穎,王春筱,王曉紅,鄒和群△(南方醫科大學第三附屬醫院腎內科,廣東廣州5060;廣東省婦幼保健院整形外科,廣東廣州5000;中山大學眼科中心,廣東廣州50060)
MADPH氧化酶抑制劑對晚期氧化蛋白產物誘導內皮細胞高通透性的影響及機制*
張瑛1,夏學穎2,王春筱3,王曉紅1,鄒和群1△
(1南方醫科大學第三附屬醫院腎內科,廣東廣州510630;2廣東省婦幼保健院整形外科,廣東廣州510010;3中山大學眼科中心,廣東廣州510060)
[摘要]目的:探討NADPH氧化酶( Nox)抑制劑對晚期氧化蛋白產物( AOPP)刺激下血管內皮的保護作用。方法:體外培養人臍靜脈內皮細胞進行實驗,人血清白蛋白( HSA)作為陰性對照,用不同濃度( 50、100和200 mg/L) AOPP-HSA共同孵育8 h后,利用5-氯甲基二乙酸熒光素標記人急性單核細胞白血病細胞株THP-1的細胞滲出數量反映內皮細胞的通透性,研究不同濃度AOPP-HSA對單層細胞通透性的影響。此外,另將細胞分為HSA組、AOPP-HSA組和AOPP-HSA +二聯苯碘( DPI)組,進而探討AOPP-HSA對Nox活化水平的影響以及DPI對內皮細胞骨架重構和細胞通透性改變的作用。結果: AOPP-HSA可使血管內皮細胞通透性明顯增加( P<0. 05)。AOPP-HSA可導致Nox磷酸化水平上升,并呈劑量依賴性。Nox抑制劑DPI預處理組可抑制AOPP-HSA刺激下Nox磷酸化水平的上升,從而抑制血管內皮細胞通透性增加及細胞骨架重構。結論: AOPP-HSA可通過激活Nox導致血管內皮細胞通透性受損,Nox抑制劑DPI可以降低其通透性及細胞骨架重構,起到一定的保護作用。
[關鍵詞]NADPH氧化酶;晚期氧化蛋白產物;內皮細胞;氧化應激;細胞通透性
慢性腎臟病( chronic kidney disease,CKD)是威脅人類健康的一類重大疾病,其發病率高,危害大[1]。目前,CKD已成為中國嚴重的公共衛生問題[2]。心血管疾病是CKD患者主要的死亡原因,據統計,大于50%的腎病患者死于心血管疾病,而其病理變化主要為動脈粥樣斑塊形成[3]。內皮作為血管系統的屏障,內皮氧化應激損傷被視為動脈粥樣硬化的始動環節[4]。
還原型煙酰胺腺嘌呤二核苷酸磷酸( reduced nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶( NADPH oxidase,Nox)作為一種廣泛存在的過氧化物酶,是由膜亞基gp91phox和p22phox,以及胞漿內亞基p47phox、p67phox、p40phox和小分子GTPases結合蛋白Rac等組成的酶復合體,在人體多種組織內催化產生活性氧,參與介導氧化應激損傷。在血管細胞中,Nox受一系列與動脈粥樣硬化有關的病理生理刺激物的調節[5]。在近期的研究顯示晚期氧化蛋白終產物( advanced oxidation protein products,AOPP)可能與加速性動脈硬化有關,是動脈粥樣硬化發展過程中的關鍵致病因子[6]。本研究利用5-氯甲基二乙酸熒光素( 5-chloromethylfluorescein diacetate,CMFDA)標記人急性單核細胞白血病( human acute monocytic leukemia)細胞株THP-1的滲出數量反映內皮細胞的通透性,觀察不同AOPP-人血清白蛋白( human serum albumin,HSA)對人臍靜脈內皮細胞( human umbilical vein endothelial cells,HUVECs)通透性的損傷情況,同時研究Nox抑制劑二聯苯碘( diphenyleneiodonium,DPI)對于通透性損傷的影響作用,為進一步研究AOPP-HSA誘導血管內皮細胞屏障功能受損的作用機制奠定基礎。
材料和方法
1材料
健康產婦正常分娩新生兒臍帶; HSA、牛血清白蛋白( bovine serum albumin,BSA)和D-葡萄糖( Sigma) ;胰蛋白酶( Amersco) ;羅丹明-鬼筆環肽和CMFDA購自Invitrogen; Nox抑制劑DPI( Millipore) ; RPMI-1640培養基、胎牛血清和小牛血清( Gibco) ; Transwell板( BD) ;兔抗p47phox抗體( Millipore) ;免抗p-p47phox( Ser)抗體( Abcam) ;兔抗β-actin多克隆抗體和羊抗兔II抗(北京中杉金橋公司)。
2方法
2.1細胞培養( 1) HUVECs的培養:無菌條件下,取新鮮新生兒臍帶20~35 cm( 4℃保存不超過12 h),按照Jaffe等[6]的方法分離培養HUVECs,在37℃、5% CO2條件下培養,用原代或第2代細胞進行實驗。( 2) THP-1細胞的復蘇、培養: THP-1細胞采用ATCC細胞株,復蘇后在37℃、5% CO2條件下含10%胎牛血清的RPMI-1640培養液培養。
2.2AOPP-HSA的制備按文獻方法體外制備AOPP-HSA修飾蛋白[7]。將20 g/L HSA與40 mmol/L次氯酸等體積混合,室溫放置30 min,制備出HSA與次氯酸摩爾比為1∶140的AOPP-HSA。制備的AOPP-HSA在無內毒素PBS中透析24 h,除去游離的次氯酸。用0. 22 μm的微孔濾膜過濾除菌后4℃保存。20 g/L HSA與PBS等體積混合,作為對照。AOPP-HSA和未經修飾的HSA的蛋白濃度分別為7. 13 g/L和10. 3 g/L。AOPP-HSA含量通過測定酸性條件下340 nm的光吸收,以氯胺T為標準取得。
2.3AOPP-HSA對HUVECs單細胞層的通透性影響為研究不同濃度的AOPP-HSA對于HUVECs單細胞層的通透性變化,按不同濃度分組干預處理,可分為: ( 1)對照組,為RPMI-1640培養基培養; ( 2) HSA組,為RPMI-1640培養基+ HSA( 200 mg/L) ; ( 3) AOPP-HSA刺激組,為分別含AOPP-HSA( 50、100和200 mg/L)的RPMI-1640培養基。根據實驗結果,采用200 mg/L的AOPP-HSA為最佳濃度刺激組,進一步探討Nox抑制劑DPI對于通透性改變的作用。實驗分為HSA組、AOPP-HSA組和AOPPHSA + DPI組(采用100 μmol/L DPI預處理1 h)。
2.4Transwell實驗檢測內皮細胞通透性按照我們之前報道的方法進行[8],將HUVECs按1×105/ cm2接種于嵌套小室的濾膜上,細胞生長至融合,分別與50、100和200 mg/L的AOPP-HSA刺激8 h,200 mg/L的HSA作為陰性對照。將生長狀態良好的THP-1細胞離心收獲細胞,用無血清培養基重懸細胞,THP-1細胞在無血清培養基中培養24 h。吸走上清,用預溫好的工作液輕輕重懸細胞,將細胞放在培養箱培養45 min。離心收獲細胞,移走工作液,用預溫的PBS洗細胞,離心收獲細胞,用新鮮的無血清培養基重懸THP-1細胞,均勻在各組加入200 μL的懸液,細胞計數達每孔105個,下室加入20%胎牛血清的RPMI-1640培養基,共同孵育3 h。計數:移走上室,熒光顯微鏡下計數進入下室的THP-1細胞數。每組隨機選擇5個視野,計數求均值。
2.5 AOPP-HSA對HUVECs細胞骨架重構的影響
HUVECs接種至置有蓋玻片的6孔細胞培養板上,細胞生長至融合,在無血清的RPMI-1640培養基中靜置12 h后,與DPI預孵育1 h后,加入200 mg/L的AOPP-HSA孵育8 h,以200 mg/L的HSA作為對照。刺激結束,PBS洗細胞3次。吸出PBS,固定、封閉、透化、染色、封片。在免疫熒光顯微鏡下觀察、攝像。
2.6Western blot法檢測蛋白水平HUVECs接種于6孔板上,細胞生長至融合,無血清RPMI-1640培養基中靜置12 h,根據實驗分組分別加入200 mg/L 的HSA作為對照,200 mg/L的AOPP-HSA,于15 min收集細胞;在阻斷實驗中,HUVECs與DPI ( 100 μmol/L)預孵育1 h后,加入200 mg/L的AOPP-HSA刺激15 min后收集細胞,提取蛋白。免疫沉淀、Western blot檢測p-p47phox( Ser)和p47phox蛋白含量。各組分別取100 μL蛋白,加入400 μL PBS、10 μL agarose和5 μL p47phox,混勻,4℃搖蕩過夜; 12 000 r/min 4℃離心5 min,棄上清,用IP洗液洗3次(每次5 min),離心,棄上清;每管加入20 μL 2×上樣緩沖液及3 μL 1 mol/L DTT,煮沸5 min,離心。灌制10%的分離膠和5%的濃縮膠,加樣。電泳、轉膜、封閉、顯影、定影。凝膠圖像分析系統分析結果。
2.7p47phox膜遷移測定用免疫熒光化學染色法測定p47phox膜遷移[8]。細胞培養于置有蓋玻片的細胞培養板,生長至70%融合,靜止后,用200 mg/L AOPP-HSA或未經修飾的HSA刺激細胞15 min。固定、漂洗、封閉后,加入小鼠抗p47phox抗體( 1∶50),4℃過夜,FITC標記兔抗小鼠Ⅱ抗( 1∶20) 37℃避光孵育45 min。漂洗,PI( 10 mg/L)室溫避光孵育10 min。熒光顯微鏡下攝像。
3統計學處理
采用SPSS 13. 0統計軟件進行統計學分析。所有數據均以均數±標準差( mean±SD)表示,多個樣本均數的比較采用單因素方差分析( one-way ANOVA),組間兩兩比較采用LSD法。以P<0. 05為差異有統計學意義。
結果
1內皮細胞通透性的變化及Nox抑制劑DPI對于AOPP-HSA導致的內皮細胞通透性增加的影響
熒光顯微鏡下觀察CMFDA標記的THP-1細胞帶綠色熒光,呈圓形,散在分布于Transwell模型的下室。不同濃度的AOPP-HSA與內皮細胞共培養8 h后,進入下室的THP-1細胞的數目與濃度呈正相關,均與對照組有顯著差異( P<0. 05),且在200 mg/L達高峰,見圖1。
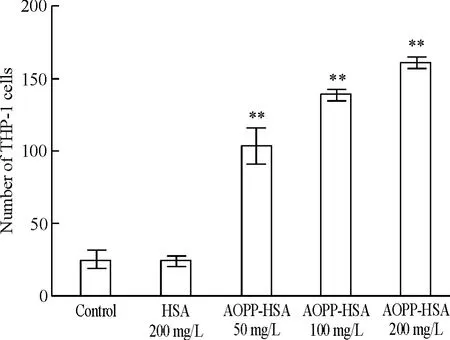
Figure 1.The effect of AOPP-HSA on the permeability of HUVECs.Mean±SD.n = 3.**P<0. 01 vs control group.圖1 AOPP對內皮細胞通透性的影響
根據實驗結果采用200 mg/L的AOPP-HSA為最佳濃度刺激組。用Nox抑制劑DPI( 100 μmol/L)預處理1 h后,再加入AOPP-HSA刺激( 200 mg/L) 15 min,進一步測定內皮細胞通透性。鏡下觀察發現,AOPP-HSA + DPI組與AOPP-HSA組相比通透性明顯降低,兩兩比較差異顯著( P<0. 01),見圖2。
2內皮細胞骨架重構及Nox抑制劑DPI對于AOPP-HSA導致的內皮細胞骨架重構的影響
AOPP-HSA增加應力纖維的形成,HUVECs與200 mg/L AOPP-HSA共同孵育0或8 h,熒光顯微鏡下觀察,在正常情況下F-actin主要分布在細胞周邊,線條光滑,完整連續,界限分明,稱為外周致密束;作用8 h后F-actin變得不光滑,成鋸齒樣分布,細胞收縮。而200 mg/L HSA則對應力纖維的形成沒有影響。而DPI則可以減少AOPP-HSA導致應力纖維的形成,見圖3。
3 AOPP-HSA對內皮細胞Nox磷酸化水平的影響
AOPP-HSA刺激可活化Nox,AOPP-HSA組內皮細胞中Nox p47phox總蛋白水平變化不明顯,而Nox p47phox磷酸化水平與對照組相比差異顯著( P<0. 01)。Nox抑制劑DPI預處理1 h后再加AOPPHSA刺激( 200 mg/L),可明顯降低p47phox磷酸化水平( P<0. 01),見圖4。
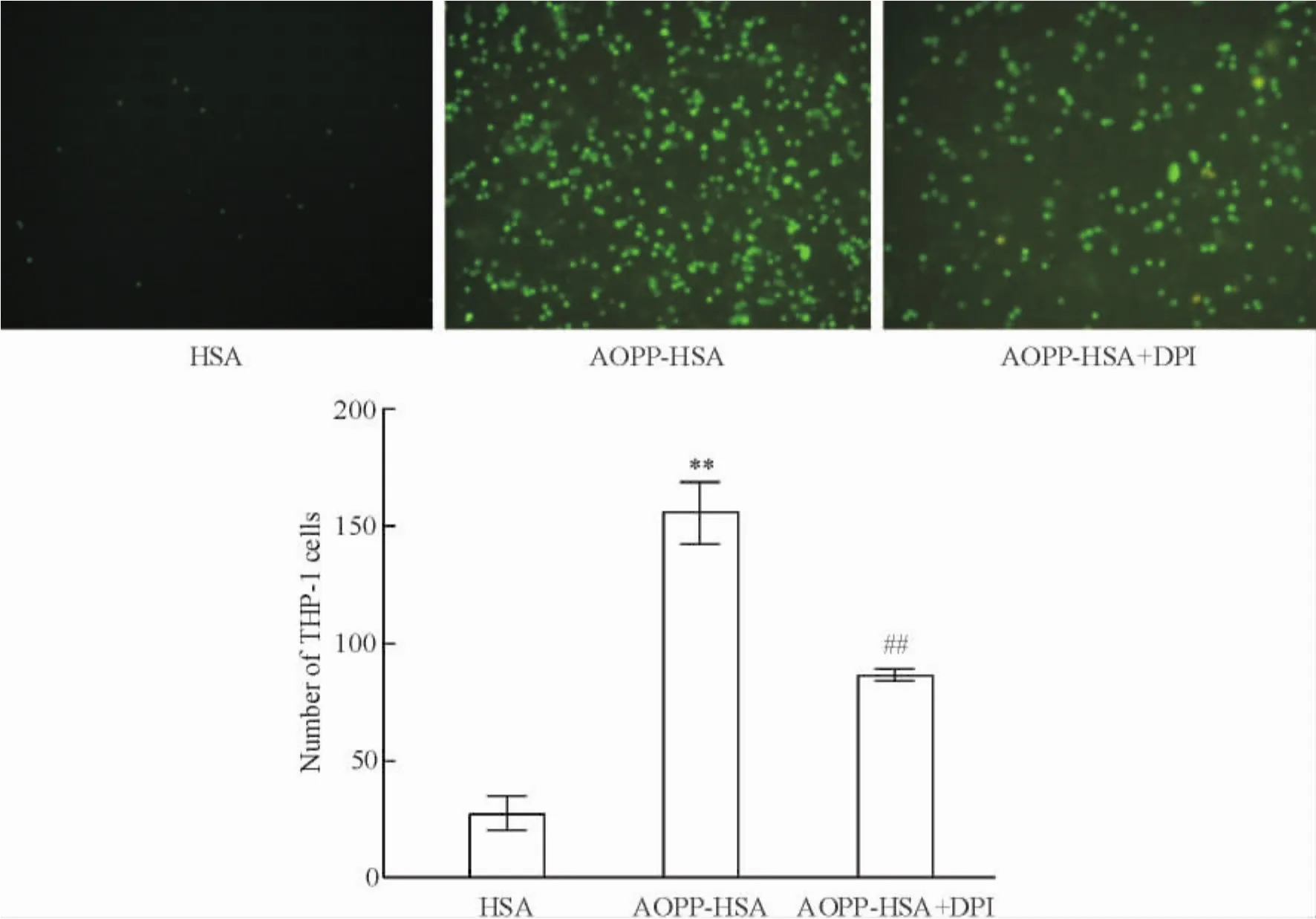
Figure 2.The effect of DPI on the permeability of HUVECs (×400).Mean±SD.n =3.**P<0. 01 vs HSA group;##P<0. 01 vs AOPP-HSA group.圖2 氧化酶抑制劑DPI對于AOPP-HSA導致的內皮細胞通透性增加的影響
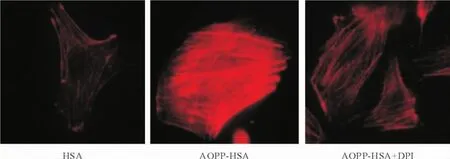
Figure 3.The effect of AOPP-HSA on the rearragement of cystoskeleton in the HUVECs (×400).圖3 AOPP對細胞骨架重構的影響
4 AOPP-HSA對p47phox膜遷移的影響
免疫熒光結果顯示,與未經修飾的HSA相比,200 mg/L AOPP-HSA刺激細胞15 min,可誘導p47phox明顯膜遷移,見圖5。
討論
慢性腎臟病是嚴重危害人類健康的常見病,已成為全球公共健康問題。流行病學資料顯示,心血管疾病是CKD最常見的嚴重并發癥。CKD患者動脈粥樣硬化的發生率較同一年齡人群高5~10倍,發病年齡提前至30~40歲,稱為加速型動脈硬化。CKD患者動脈粥樣硬化快速發生、發展的原因目前尚未闡明。
近年來,AOPP作為一種新型的炎癥介質引起了廣泛關注,與多種疾病密切相關[9-11]。研究提示AOPP修飾蛋白可能是動脈粥樣硬化發展過程中的關鍵致病因子[6]。我們CMFDA標記THP-1細胞的滲出數量反映內皮細胞的通透性,觀察不同濃度AOPP-HSA對人臍靜脈內皮細胞單層細胞間通透性的損傷情況。從實驗結果來看,內皮細胞經AOPPHSA作用后,內皮細胞通透性增加并與濃度呈正相關,而未經氧化修飾的HSA則無上述作用。我們再用免疫熒光法觀察到AOPP-HSA組的應力纖維形成明顯增加,而應力纖維的形成使得細胞間的間隙增大,使得內皮細胞的聯系不緊密,最終導致內皮細胞的通透性增加。內皮細胞通透性增加即內皮細胞屏障受損,而這也是動脈粥樣硬化早期病理改變基礎。
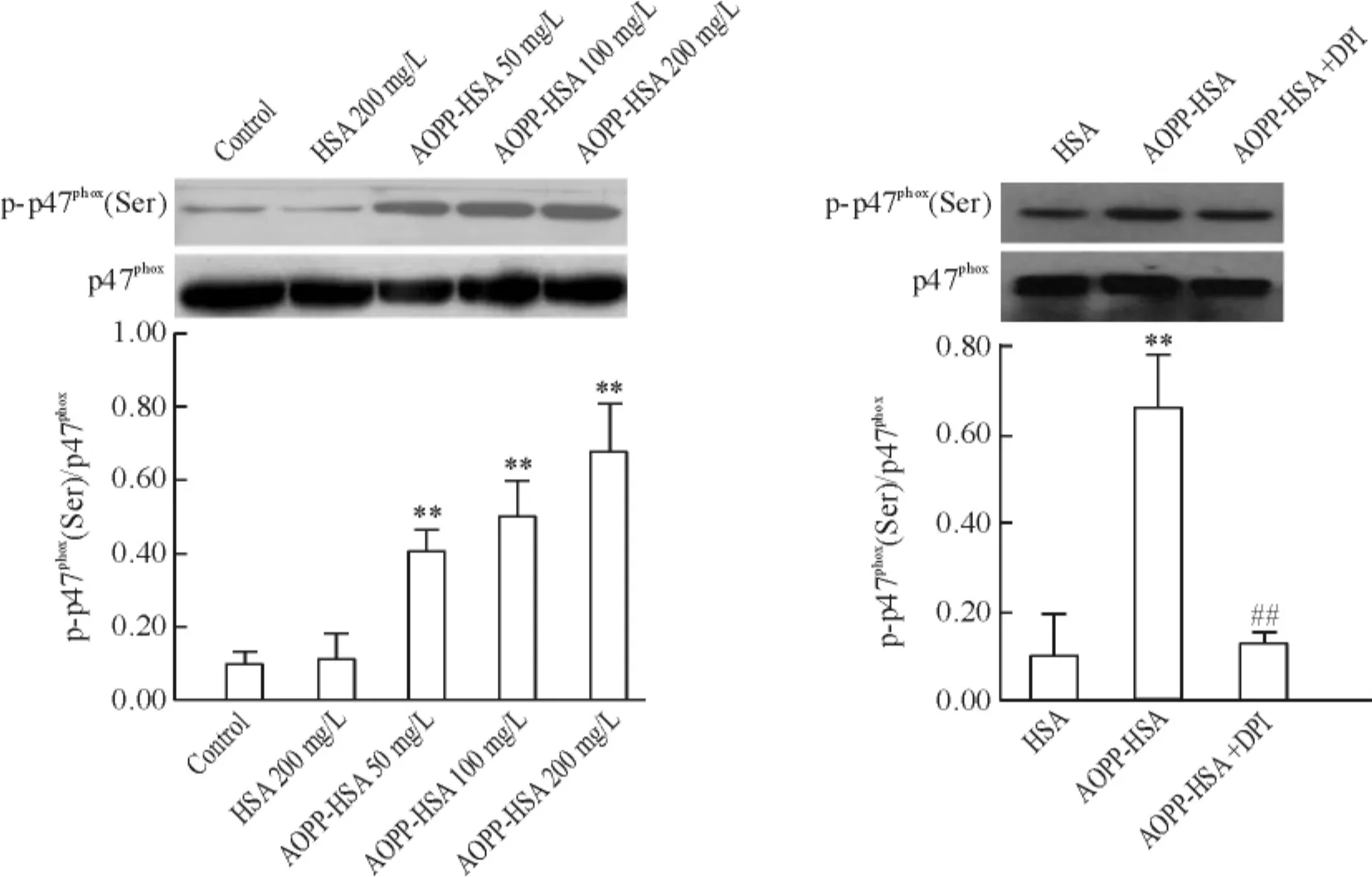
Figure 4.The effect of AOPP-HSA on Nox phosphorylation in HUVECs.Mean±SD.n =3.**P<0. 01 vs HSA group;##P<0. 01 vs AOPP-HSA group.圖4 AOPP對Nox磷酸化水平的影響
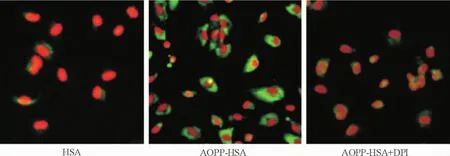
Figure 5.The effect of AOPP-HSA on p47phoxmigration (×400).圖5 AOPP對p47phox膜遷移的影響
過多活性氧的生成可能在動脈粥樣硬化發生中起很大的作用[12],Nox及其催化亞單位是唯一已知的僅僅產生活性氧的酶家族[13]。糖尿病患者加速性動脈粥樣硬化的機制尚未闡明,但過多ROS的生成在其中起到了主要的作用[14]。此外,AOPP觸發脂肪細胞炎癥反應依賴于Nox產生活性氧[15]。這些都提示AOPP可能通過Nox依賴的信號通路導致內皮細胞功能受損。為了進一步探討AOPP-HSA誘導內皮細胞通透性增加的機制,我們用200 mg/L的AOPP-HSA作為刺激物,并用Nox特異性抑制劑DPI預處理細胞觀察是否能阻斷上述效應。結果顯示,在AOPP-HSA的作用下,Nox激活,p47phox迅速出現磷酸化和膜遷移,應力纖維形成增加,內皮細胞的通透性明顯增高。Nox的特異性抑制劑DPI可減弱這一效應的產生。提示AOPP-HSA激活Nox導致血管內皮細胞的通透性增高,并且這種作用是由于白蛋白氧化修飾所致而非白蛋白本身。之前已有研究證實晚期糖基化終產物可引起內皮細胞的氧化應激導致血管內皮細胞通透性增加[16],本研究證實AOPP是通過依賴于Nox的信號途徑導致內皮細胞受損,這也印證了AOPP具有與晚期糖基化終產物相似的生物學活性[15,17-19]。
綜上所述,AOPP-HSA通過Nox依賴的信號途徑誘導血管內皮通透性增高,可能是CKD患者血管并發癥發生和發展的重要因素。因此,對Nox激活的干預可能改善內皮炎癥反應和內皮功能失常,延緩和逆轉血管并發癥。
[參考文獻]
[1]劉志紅,李貴森.重視慢性腎臟病-礦物質和骨異常的診斷和治療[J].腎臟病與透析腎移植雜志,2013,22 ( 6) : 2501-2503.
[2]Zhang L,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China: a cross-sectional survey[J].Lancet,2012,379( 9818) : 815-822.
[3]唐學琴,甘華,陳澤君.尿毒癥動脈粥樣硬化的研究進展[J].醫學綜述,2014,20( 1) : 63-65.
[4]Cybulsky MI,Gimbrone MA Jr.Endothelial expression of a mononuclear leukocyte adhesion molecule during atherogenesis[J].Science,1991,251( 4995) : 788-791.
[5]Harrison D,Griendling KK,Landmesser U,et al.Role of oxidative stress in atherosclerosis[J].Am J Cardiol,2003,91( 3A) : 7A-11A.
[6]Guo ZJ,Niu HX,Hou FF,et al.Advanced oxidation protein products activate vascular endothelial cells via a RAGE-mediated signaling pathway[J].Antioxid Redox Signal,2008,10( 10) : 1699-1712.
[7]Witko-Sarsat V,Gausson V,Nguyen AT,et al.AOPPHSA-induced activation of human neutrophil and monocyte oxidative metabolism: a potential target for N-acetylcysteine treatment in dialysis patients[J].Kidney Int,2003,64( 1) : 82-91.
[8]張瑛,郭志堅,胡麗莉.一種單核細胞滲出模型的建立及其在內皮細胞通透性檢測中的應用[J].臨床腎臟病雜志,2011,6( 11) : 279-282.
[9]Wei Y,Sowers JR,Nistala R,et al.AngiotensinⅡ-induced NADPH oxidase activation impairs insulin signaling in skeletal muscle cells[J].J Biol Chem,2006,281 ( 46) : 35137-35146.
[10]Witko-Sarsat V,Friedlander M,Nguyen Khoa T,et al.Advanced oxidation protein products as novel mediators of inflammation and monocyte activation in chronic renal failure[J].J Immunol,1998,161( 5) : 2524-2532.
[11]KalousováM,Skrha J,Zima T.Advanced glycation endproducts and advanced oxidation protein products in patients with diabetes mellitus[J].Physiol Res,2002,51 ( 6) : 597-604.
[12]Ozenirler S,Erkan G,Gülbahar O,et al.Serum levels of advanced oxidation protein products,malonyldialdehyde,and total radical trapping antioxidant parameter in patients with chronic hepatitis C[J].Turk J Gastroenterol,2011,22( 1) : 47-53.
[13]Li H,Horke S,Frstermann U.Vascular oxidative stress,nitric oxide and atherosclerosis[J].Atherosclerosis,2014,237( 1) : 208-219.
[14]Touyz RM,Briones AM,Sedeek M,et al.NOX isoforms and reactive oxygen species in vascular health[J].Mol Interv,2011,11( 1) : 27-35.
[15]Gray SP,Di Marco E,Okabe J,et al.NADPH oxidase 1 plays a key role in diabetes mellitus-accelerated atherosclerosis[J].Circulation,2013,127( 18) : 1888-1902.
[16]Zhou QG,Zhou M,Lou AJ,et al.Advanced oxidation protein products induce inflammatory response and insulin resistance in cultured adipocytes via induction of endoplasmic reticulum stress[J].Cell Physiol Biochem,2010,26 ( 4-5) : 775-786.
[17]Guo XH,Wang LG,Chen B,et al.ERM protein moesin is phosphorylated by advanced glycation end products and modulates endothelial permeability[J].Am J Physiol Heart Circ Physiol,2009,297( 1) : H238-H246.
[18]Tang J,Yan H,Zhuang S.Inflammation and oxidative stress in obesity-related glomerulopathy[J].Int J Nephrol,2012,2012: 608397.
[19]Yamagishi S,Maeda S,Matsui T,et al.Role of advanced glycation end products ( AGEs) and oxidative stress in vascular complications in diabetes[J].Biochim Biophys Acta,2011,1820( 5) : 663-671.
Protective effect of diphenyleneiodonium,a NADPH oxidase inhibitor,on hyperpermeability of endothelial cells exposed to AOPP-HSA in vitro
ZHANG Ying1,XIA Xue-ying2,WANG Chun-xiao3,WANG Xiao-hong1,ZOU He-qun1
(1Department of Nephrology,The Third Affiliated Hospital of Southern Medical University,Guangzhou 510630,China;2Department of Plastic Surgery,Guangdong Women and Children Hospital,Guangzhou 510010,China;3Zhongshan Ophthalmic Center,Sun Yat-sen University,Guangzhou 510060,China.E-mail: hequnzou@ hotmail.com)
[ABSTRACT]AIM: To investigate the effect of advanced oxidation protein product-human serum albumin ( AOPP-HSA) at different concentrations on the permeability of human umbilical vein endothelial cell ( HUVEC) monolayer and the protective effect of NADPH oxidase inhibitor diphenyleneiodonium ( DPI) against AOPP-HSA exposure.METHODS: Cultured HUVECs were exposed to 200 mg/L HSA ( control) or AOPP-HSA ( 50,100 and 200 mg/L).The permeability of the endothelial monolayer was assessed by measuring CMFDA-labeled THP-1 cells across the endothelial cells.The cultured HUVECs were treated with HSA ( 200 mg/L),AOPP-HSA ( 200 mg/L),or AOPP-HSA ( 200 mg/L) + DPI ( 100 μmol/L),and the activation of NADPH oxidase,endothelial monolayer permeability and cytoskeleton rearrangement were evaluated.RESULTS: AOPP-HSA increased the permeability of the endothelial cell monolayer,and AOPP-HSA at 200 mg/L significantly increased the phosphorylation level of NADPH oxidase in the cells.Treatment with 100 μmol/L DPI obviously attenuated AOPP-HSA-induced NADPH oxidase activation,the increase in the permeability of the cell monolayer and the cytoskeleton rearrangement.CONCLUSION: AOPP-HSA increases the hyperpermeability of HUVEC monolayer via the phosphorylation of NADPH oxidase,and the NADPH oxidase inhibitor DPI reverses such effects.
[KEY WORDS]NADPH oxidase; Advanced oxidation protein products; Endothelial cells; Oxidative stress; Permeability
通訊作者△Tel: 020-62784398; E-mail: hequnzou@ hotmail.com
*[基金項目]廣東省醫學科研基金資助項目( No.B2012244) ;南方醫科大學青年科技人員培育項目( No.201201547) ;南方醫科大學第三附屬醫院院長基金資助項目( No.B20111109)
[收稿日期]2014-11-24[修回日期]2015-04-21
[文章編號]1000-4718( 2015)07-1172-06
[中圖分類號]R363
[文獻標志碼]A
doi:10.3969/j.issn.1000-4718.2015.07.004

