不同胰腺提取物對大鼠骨髓間充質干細胞分泌細胞因子的影響
許聿新,井慶平
(淄博市第一醫院,山東淄博255200)
不同胰腺提取物對大鼠骨髓間充質干細胞分泌細胞因子的影響
許聿新,井慶平
(淄博市第一醫院,山東淄博255200)
目的 探討不同胰腺提取物對大鼠骨髓間充質干細胞分泌細胞因子的影響。方法 制備模擬胰腺微環境的大鼠正常及再生性胰腺提取物,同時分離培養鑒定大鼠骨髓間充質干細胞。分別應用正常及再生性胰腺提取物孵育間充質干細胞獲得條件培養液,并設立無胰腺提取物處理的對照組;ELISA法檢測三組條件培養液中胰島素樣生長因子-1(IGF-1)、肝細胞生長因子(HGF)、血管內皮生長因子(VEGF)及堿性表皮生長因子(bFGF)的含量,應用RT-PCR分析胰腺提取物對間充質干細胞中四種細胞因子 mRNA的改變。結果 三組均可以檢測到IGF-1、HGF、bFGF及VEGF,其中再生性胰腺提取物處理的條件培養液組中四種細胞因子含量最高,與其他兩組相比差異有統計學意義(P均<0.05)。再生性胰腺提取物處理的骨髓間充質干細胞的IGF-1、HGF、VEGF及bFGF的mRNA相對表達量與其他兩組相比均明顯升高(P均<0.05)。結論 模擬糖尿病胰腺微環境的再生性大鼠胰腺提取物可以促進大鼠骨髓間充質干細胞分泌更多的具有胰腺保護作用的細胞因子。
糖尿病;胰腺提取物;干細胞,骨髓;細胞因子類
糖尿病的共同發病基礎是有功能的胰島β細胞團絕對或相對不足。研究發現,移植間充質干細胞(MSCs)可以部分逆轉糖尿病動物模型的高血糖狀態[1,2],但其機制尚未闡明,移植到體內的MSCs是否能分化為胰島素分泌細胞并發揮“替代補充”作用仍存在爭議[3,4]。2013年8月~2014年5月,我們應用大鼠胰腺提取物(RPE)在體外模擬胰腺微環境,探討RPE對MSCs細胞因子表達及分泌的影響。
1 材料與方法
1.1 材料 實驗動物:6~8周齡雄性Wistar大鼠,體質量150~200 g,清潔級,購自山東大學實驗動物中心。儀器及試劑:PCR儀(MJ Research公司,美國)、電泳成像分析系統(BIO-RAD公司,美國)、酶聯免疫檢測儀(INTEC公司,Reader 2010型)、流式細胞儀(BECKMAN COULTER公司)、細胞總RNA提取使用Trizol試劑(Invitrogen公司,美國)、逆轉錄反應試劑盒,PCR試劑盒(大連寶生物公司,中國),ELISA試劑盒(Adlitteram Diagnostic laboratories,USA)。
1.2 方法
1.2.1 RPE的制備[5]大鼠麻醉后,行胰腺大部分切除。48 h后,找到并切除殘留胰腺(即再生胰腺),經勻漿化處理,離心抽濾,即再生性大鼠胰腺提取物(R-RPE)。正常胰腺提取物(N-RPE)為未行胰腺大部切除的正常胰腺直接經過勻漿處理后提取的提取液。
1.2.2 大鼠MSCs條件培養液的制備 采用全骨髓貼壁培養法分離培養大鼠MSCs,取第三代MSCs培養于含10% FBS的LG-DMEM的培養板中,細胞融合至80%后,培養基中分別加入R-RPE及N-RPE,培養7 d,去除含RPE培養液,以無血清培養液培養MSCs 48 h,收獲細胞及培養上清液。根據處理方式不同分為三組:無RPE對照組(CTR-CM),N-RPE處理組(N-RPE-CM)和R-RPE處理組(R-RPE-CM)。
1.2.3 大鼠MSCs條件培養液細胞因子檢測 應用ELISA法測定大鼠MSCs條件培養液上清的胰島素樣生長因子-1(IGF-1)、肝細胞生長因子(HGF)、血管內皮生長因子(VEGF)及堿性表皮生長因子(bFGF)水平,嚴格按說明書操作,每組設5個復孔。
1.2.4 大鼠MSCs分泌細胞因子mRNA檢測 取經過R-RPE、N-RPE處理及未經處理的MSCs,計數1×106個細胞。采用TRIzol試劑一步法提取總RNA,嚴格按照逆轉錄試劑盒合成第一條cDNA,所得cDNA用于PCR擴增,設立β-actin作為內參照,引物設計參考文獻[6],由上海博亞生物公司合成;2%瓊脂糖凝膠電泳檢測PCR產物mRNA,紫外線下觀察電泳結果并照相,重復3次。

2 結果
2.1 骨髓MSCs形態及細胞表型 大鼠骨髓細胞在貼壁培養48 h后可見散在貼壁細胞。7~10 d后,貼壁細胞數目明顯增多,呈梭形或長多邊形,細胞排列整齊。原代培養10~14 d細胞80%~90%融合,有規律地排列成放射狀或旋渦狀。按1∶2的比例傳代,傳代后的MSCs形態與原代基本相似,經過3代后MSCs基本達到形態均一。流式細胞儀分析第三代MSCs細胞表型,細胞高表達CD44和CD90,而CD34、CD45低表達或表達陰性。
2.2 三組IGF-1、HGF、bFGF和VEGF水平比較 四種細胞因子在三組培養液上清中均可以檢測到,其中R-RPE-CM組及N-RPE-CM組中四種細胞因子與CTR-CM組相比均明顯升高(P均<0.05),R-RPE-CM組四種細胞因子水平高于N-RPE-CM組(P均<0.05)。見表1。
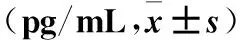
表1 三組IGF-1、HGF、bFGF和VEGF 水平比較
注:與CTR-CM組相比,#P<0.05;與N-RPE-CM組相比,*P<0.05。
2.3 三組IGF-1、HGF、bFGF和VEGF的mRNA相對表達量 半定量RT-PCR結果顯示,與CTR-CM組相比,經過N-RPE和R-RPE處理MSCs的IGF-1、HGF、VEGF及bFGF的mRNA相對表達量均明顯升高(P均<0.05)。R-RPE組與N-RPE組比較,IGF-1、HGF、VEGF及bFGF的mRNA相對表達量也均明顯升高(P均<0.05)。見表2。

表2 三組IGF、HGF、bFGF和VEGF的mRNA 相對表達量比較±s)
注:與CTR-CM組相比,#P<0.05;與N-RPE-CM組相比,*P<0.05。
3 討論
骨髓MSCs在體外易分離培養和擴增,植入體內僅有低免疫排斥反應,是糖尿病再生治療研究的熱點。移植到體內的MSCs定位到受損的糖尿病胰腺中可以促進宿主胰島細胞的再生,胰島素分泌增加,發揮降血糖作用。我們推測,MSCs可能通過分泌具有胰腺保護作用及促進胰島細胞增生的細胞因子而發揮作用[7]。
骨髓MSCs可以分泌多種細胞因子參與細胞形態的維系及組織發育,在不同的微環境下,MSCs分泌的細胞因子具有高度的可塑性。移植MSCs入心肌梗死患者體內,可以促進心肌細胞增生,有效減少梗死面積,改善心功能[8,9]。移植MSCs至腦梗死患者,可以促進內源性神經干細胞的增殖和分化,從而改善患者神經功能[10,11]。以上研究證實了MSCs分泌的細胞因子及發揮的作用與其定位的微環境有密切關系。
通過部分胰腺切除后獲得再生性胰腺,經過勻漿化處理后得到的再生性胰腺提取物,被認為可模擬受損的胰腺微環境,更接近于糖尿病患者的胰腺微環境[12,13]。我們在體外應用胰腺提取物孵育MSCs,模擬MSCs移植后定居于胰腺在胰腺微環境下MSCs分泌細胞因子的變化,結果顯示,有胰腺保護作用的相關細胞因子如IGF-1、HGF、bFGF和VEGF的分泌增加,相關細胞因子基因表達明顯增加,與對照組有統計學差異。并且應用再生性胰腺提取物處理后與正常胰腺提取物相比,細胞因子的分泌及基因表達升高更明顯,提示模擬受損胰腺微環境的再生胰腺提取物可以改變MSCs的基因表達,有胰腺保護作用的細胞因子表達和分泌明顯增加,進一步證實MSCs細胞因子的分泌與其所處的微環境密切相關。
在1型糖尿病的發生過程中,自身免疫攻擊導致體內炎性細胞浸潤,促進胰腺細胞壞死、凋亡,胰腺在病理情況下啟動胰島的再生。移植MSCs到糖尿病動物模型后,定居于胰島的MSCs分泌細胞因子的能力在再生性胰島環境下被激活,分泌具有胰腺保護作用細胞因子,發揮促進胰腺細胞再生,抑制細胞凋亡的作用,從而使胰島細胞團數量增加,分泌胰島素,降低血糖。MSCs在受損胰腺微環境下的旁分泌效應可能是改善糖尿病動物模型糖代謝的機制。
[1] Tang DQ, Cao LZ, Burkhardt BR, et al. In vivo and in vitro characterization of insulin-producing cells obtained from murine bone marrow[J]. Diabetes, 2004,53(7):1721-1732.
[2] Gabr MM, Zakaria MM, Refaie AF, et al. Insulin-producing cells from adult human bone marrow mesenchymal stem cells control streptozotocin-induced diabetes in nude mice[J]. Cell Transplant, 2013,22(1):133-145.
[3] Chhabra P, Brayman KL.Stem cell therapy to cure type 1 diabetes: from hype to hope[J]. Stem Cells Transl Med, 2013,2(5):328-336.
[4] Choi JB, Uchino H, Azuma K, et al. Little evidence of transdifferentiation of bone marrow-derived cells into pancreatic beta cells[J]. Diabetologia, 2003,46(10):1366-1374.
[5] Gao X, Song L, Shen K, et al. Transplantation of bone marrow derived cells promotes pancreatic islet repair in diabetic mice[J]. Biochem Biophys Res Commun, 2008,371(1):132-137.
[6] Lee J, Han DJ, Kim SC. In vitro differentiation of human adipose tissue-derived stem cells into cells with pancreatic phenotype by regenerating pancreas extract[J]. Biochem Biophys Res Commun, 2008,375(4):547-551.
[7] Li X, Zhang L, Meshinchi S, et al. Islet microvasculature in islet hyperplasia and failure in a model of type 2 diabetes[J]. Diabetes, 2006,55(11):2965-2973.
[8] Gnecchi M, Danielip P, Cervia E. Mesenchymal stem cell therapy for heart disease[J]. Vascul Pharmacol, 2012,57(1):48-55.
[9] Kuraitis D, Ruel M, Suuronen EJ. Mesenchymal stem cell therapy for cadiovascular regeneration [J]. Cardiovasc Drug Ther, 2011,25(4):349-362.
[10] Kim SJ, Choi SW, Hur KJ. Synergistic effect of mesenchymal stem cells infected with recombinant adenovirus expressing human BDNF on erectile function in a rat model of cavernous nerve injury[J]. Korean Urol, 2012,53(10):726-732.
[11]Motoyoshi YA, Tamura M, Moriyama M. Activation of cultured atrocities by amphotericin B: Stimulation of NO and cytokines production and changes in neurotrophic factors production[J]. Neurochem Int, 2013,5:232-240.
[12] Hardikar AA, Bhonde RR. Modulating experimental diabetes by treatment with cytosolic extract from the regenerating pancreas[J]. Diabetes Res Clin Pract, 1999,46(3):203-211.
[13] Choi KS, Shin JS, Lee JJ, et al. In vitro trans-differentiation of rat mesenchymal cells into insulin-producing cells by rat pancreatic extract[J]. Biochem Biophys Res Commun, 2005,330(4):1299-1305.
井慶平
10.3969/j.issn.1002-266X.2015.01.009
R587.1
A
1002-266X(2015)01-0025-03
2014-08-12)

