2015年ASCO年會腸癌藥物治療進展
牛海濤 李偉偉 黃鏡#
1中國醫學科學院腫瘤醫院腫瘤內科,北京100021
2新鄉醫學院第一附屬醫院腫瘤科,河南新鄉453100
2015年ASCO年會腸癌藥物治療進展
牛海濤1李偉偉2黃鏡1#
1中國醫學科學院腫瘤醫院腫瘤內科,北京100021
2新鄉醫學院第一附屬醫院腫瘤科,河南新鄉453100
腸癌是我國常見惡性腫瘤,晚期腸癌預后不良。全球領先的腫瘤專家學術組織美國臨床腫瘤學會(American Society of Clinical Oncology,ASCO)2015年的年會上有關腸癌的熱點較多,本文匯總了腸癌在輔助治療、新輔助治療、靶向治療、免疫治療等方面的研究結果,以為臨床和科研工作指引方向。
腸癌;化療;靶向治療
2015年美國臨床腫瘤學年會(The ASCO Annual Meeting)主題是啟示與創新:將數據轉化為認知——是關于我們如何將精準醫療和臨床實踐所獲取的海量數據轉化成最有效和恰當的處理患者的方式。
在腸癌領域,有些研究結果給我們的臨床工作帶來了啟示,對于研究領域有一定的創新意義。
1 免疫治療與腸癌
本次會議上,來自約翰霍普金斯醫院的Dr. Deng公布了抗PD-1抗體治療腸癌的最新進展——“PD-1阻滯劑在錯配修復功能缺陷型腫瘤中的研究(NCT01876511研究)[1]”。該臨床研究僅是一個入組41例患者的Ⅱ期臨床研究,但《新英格蘭醫學雜志》同日在線發表了這個研究結果,可以認為該研究代表了免疫治療在腸癌治療的新突破。
在NCT01876511研究中,根據DNA錯配修復(mis-match repair,MMR)狀態,患者被分為三組進行單臂治療:即MMR缺乏(dMMR)的腸癌、MMR豐富(pMMR)的腸癌和dMMR的其他腫瘤。目前已經接受過所有標準治療失敗后的晚期腸癌患者進入此研究接受抗PD-1抗體Pembrolizumab(默沙東公司,商品名Keytruda)治療(用法:10mg/kg,每2周給藥,靜脈滴注)。該研究的主要終點是20周時的免疫相關的客觀反應率(irORR)和免疫相關的無疾病進展生存率(irPFS),目的在于尋找MMR狀態引導下的抗PD-1免疫治療在晚期腫瘤中的價值。
患者被分為三組接受治療:dMMR腸癌組11例,pMMR腸癌組21例,dMMR其他腫瘤組9例(其中4例壺腹/膽管癌,2例子宮內膜癌,2例小腸癌,1例胃癌)。dMMR腸癌組、pMMR腸癌組、dMMR其他腫瘤組的20周irORR分別是:40%、0、71%;20周irPFS分別是:78%、11%、67%;按RECIST標準評估的ORR和疾病控制率(disease control rate,DCR)分別為:40%、90%,0、11%,71%、71%。dMMR組中位PFS和OS均未達到;而pMMR腸癌組分別為2.2個月和5.0個月,兩組間差異具有統計學意義(P<0.05)。本研究還進行了全外顯子組腫瘤體細胞突變分析,發現dMMR腫瘤平均出現1782個突變,pMMR腫瘤平均出現73個突變,兩組間差異具有統計學意義(P= 0.007),突變數也與PFS顯著相關(P=0.02)。
對于同樣的組織學類型,dMMR與pMMR對腸癌的免疫修飾是不同的;對于不同的組織學類型(如子宮內膜癌、胃癌、膽管癌和小腸癌等),由于其在基因水平存在dMMR,腫瘤免疫狀態更容易被機體免疫系統識別,使免疫治療有效。基于dMMR的抗PD-1免疫治療在腸癌治療領域有創新意義,并將會是免疫治療的突破口。
2 新輔助治療與腸癌
以術前氟尿嘧啶(5-FU)為基礎的放化療是局部晚期直腸癌的標準治療。5-FU是放療增敏劑,但對有遠處轉移患者的治療效果不佳。放療會帶來一些如肛門和性功能損傷的問題,且不能使生存期進一步延長。為了避免不必要的放療,中山大學附屬第六醫院汪建平教授等研究了m FOLFOX6作為新輔助治療的策略(FOWARC研究),并在此次ASCO大會報告了FOWARC研究的初步結果[2]。
495例局部進展期直腸癌被隨機分為三組:5-FU化療+放療組、m FOLFOX6化療+放療組、mFOLFOX6單純化療組。三組患者的病理完全緩解率(pathologic complete response,pCR)分別為12.5%、31.3%、7.4%(P=0.001),且m FOLFOX6同步放療組pCR顯著優于其他兩組。三組患者之間腫瘤R0切除率和降期率無顯著統計學差異。該研究結果為:與5-FU單藥化療方案相比,采用m FOLFOX6同步放療的新輔助治療用于局部晚期直腸癌,可提高患者的pCR和緩解率,毒性略有增加并未降低依從性;兩種方案具有相近R0切除率、緩解率,低手術并發癥發生率和相似的低位直腸癌患者療效。
FOWARC研究是針對我國直腸癌患者特征開展的多中心隨機對照Ⅲ期臨床研究,也是第一個關于中國直腸癌新輔助治療的大型研究。研究結果提示以mFOLFOX6為基礎的同步放化療可能代替現有標準治療,并且部分患者可能并不需要進行放療就可獲得良好的手術切緣狀態。對于該研究,需要關注的是五年生存率、局部復發率及無病生存期等指標,期待其為直腸癌臨床治療標準的修訂提供重要參考。
3 靶向治療與腸癌
意大利研究者在大會報告了HERACLES研究[3]:曲妥珠單抗和拉帕替尼聯合治療HER2擴增,KRAS基因2號外顯子野生型轉移性結直腸癌患者的Ⅱ臨床研究。
此研究納入對象為經氟尿嘧啶、奧沙利鉑、伊立替康、貝伐珠單抗、西妥昔單抗或帕尼單抗治療后疾病發生進展的轉移性結直腸癌患者,且HER2+(FISH陽性)或IHC3+。研究方法為:拉帕替尼口服給藥,每日1次;曲妥珠單抗靜脈給藥,每周1次;均為標準劑量,每8周進行療效評估。研究的主要終點是客觀緩解率(objective response,OR)。
該研究的入組患者為913例,HER2陽性者44例(4.8%),其中23例符合評價標準。主要終點OR為35%(8/35);8例部分緩解的患者療效持續時間分別為8+、12+、14+、24、24.5+、32、54+和55+周;中位疾病進展時間為5.5個月(95%CI:3.7~9.8),且不良反應可控。
對于KRAS基因2號外顯子野生型mCRC患者,5%具有HER2基因擴增。HERACLES研究表明對于此部分患者,可采用雙重抗HER2治療,該方法是一種用于HER2+mCRC的有價值的全新治療方法。
4 輔助治療與腸癌
Zaanan在大會上對經FOLFOX+/-西妥昔單抗治療的Ⅲ期結腸癌患者中MMR與臨床預后分析[4]的研究結果進行了報道。此研究匯總了2項大型隨機輔助治療研究的數據:NCCTG N0147[5]和PETACC-8[6]。該研究的目的是評價接受FOLFOX為基礎輔助治療的Ⅲ期結腸癌患者中dMMR狀態(包括散發型和家族型)對預后的影響。研究者分別對MMR蛋白(MLH1,MSH2,MSH6)表達和BRAF(V600E)突變進行了測定,任何MMR蛋白缺失均計為MMR缺乏(dMMR)。研究在MLH1缺失和BRAF基因野生型(WT)的腫瘤中分析了MLH1基因啟動子的甲基化,并對MMR的狀態與OS等臨床預后指標進行了相關性分析。(表1)
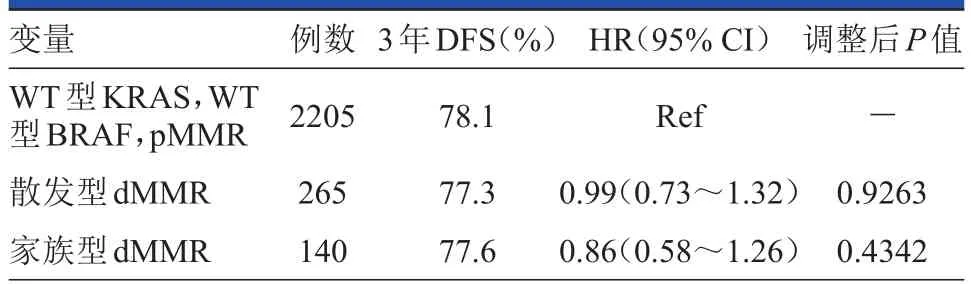
表1 MMR狀態與臨床預后指標的相關性
研究發現在接受FOLFOX為基礎輔助化療的Ⅲ期結腸癌患者中,微衛星不穩定性(microsatellite instability,MSI)并不是一個顯著的預后因子,MMR狀態與預后無關。在亞組分析中,對于單純FOLFOX輔助化療亞組患者,MSI是DFS和OS的預后因子;對于FOLFOX+西妥昔單抗輔助化療亞組患者而言不是。在MSI人群中,散發型dMMR病例較家族型dMMR病例臨床結局更差。需對西妥昔單抗影響MSI預后判斷作用的原因做進一步研究。
腸癌是我國常見惡性腫瘤。開展規范化和個體化的多學科綜合治療是提高大腸癌療效的關鍵。2015ASCO年會上有關腸癌的輔助治療、新輔助治療、靶向治療、免疫治療等方面的研究成果為我們的臨床和科研工作帶來諸多啟示,也為臨床治療指引了方向。
[1]Le DT,Uram JN,Wang H,et al.PD-1 blockade in tumors w ith m ismatch repair deficiency[J].N Engl JMed, 2015,372(26):2509-2520.
[2]Deng YH,Chi P,Lan P,et al.A multi-center randomized controlled trial ofm FOLFOX6 w ith or w ithout radiation in neoadjuvant treatment of local advanced rectal cancer(FOWARC study):prelim inary results[J].J Clin Oncol,2015,33(15 Suppl):3500.
[3]Siena S,Sartore-Bianchi A,Lonardi S,et al.Trastuzumab and lapatinib in HER2-amplified metastatic colorectal cancer patients(mCRC):the HERACLES trial[J].JClin Oncol,2015,33(15 Suppl):3508.
[4]Zaanan A,Shi Q,Taieb J,et al.Analysis of DNA mismatch repair(MMR)and clinical outcome in stage III colon cancers from patients(pts)treated w ith adjuvant FOLFOX+/-cetuximab in the PETACC8 and NCCTG N0147 adjuvant trials[J].JClin Oncol,2015,33(15 Suppl):3506.
[5]Sinicrope FA,Mahoney MR,Yoon HH,et al.Analysis of molecularmarkers by anatomic tumor site in stage IIIcolon carcinomas from adjuvant chemotherapy trial NCCTG N0147(A lliance)[J].Clin CancerRes,2015.
[6]Taieb J,Tabernero J,M ini E,et al.Oxaliplatin,fluorouracil,and leucovorin w ith or w ithout cetuximab in patients w ith resected stage III colon cancer(PETACC-8): an open-label,randomised phase 3 trial[J].Lancet Oncol,2014,15(8):862-873.
R735.3
A
10.11877/j.issn.1672-1535.2015.13.04.03
#通信作者(corresponding author),e-mail:huangjingwg@163.com
2015-07-01)

