雷帕霉素增強卵巢癌細胞系對順鉑敏感性的機制研究△
張永清 徐春玉 李銳銳 盧靜 焦坤 黃杰 周童亮 苗勁蔚#
1首都醫科大學附屬北京婦產醫院婦瘤科,北京100026 2首都醫科大學基礎醫學院動物實驗室,北京100069
3美國俄亥俄州立大學基礎醫學院實驗室,哥倫布200060 4中日友好醫院基礎實驗室,北京100029
雷帕霉素增強卵巢癌細胞系對順鉑敏感性的機制研究△
張永清1徐春玉1李銳銳1盧靜2焦坤2黃杰3周童亮4苗勁蔚1#
1首都醫科大學附屬北京婦產醫院婦瘤科,北京1000262首都醫科大學基礎醫學院動物實驗室,北京100069
3美國俄亥俄州立大學基礎醫學院實驗室,哥倫布2000604中日友好醫院基礎實驗室,北京100029
目的研究雷帕霉素對卵巢癌細胞系順鉑敏感性的影響,以及PI3K/AKT/m TOR信號通路(簡稱m TOR信號通路)與卵巢癌細胞系順鉑耐藥的相關性;初探雷帕霉素增強卵巢癌細胞系順鉑敏感性的分子機制。方法采用CCK-8法檢測卵巢癌順鉑耐藥細胞系SKOV3/DDP的耐藥指數(resistance index,RI)、細胞增殖抑制率;采用克隆平板實驗觀察不同用藥方案對卵巢癌順鉑非耐藥細胞系及SKOV3細胞系兩種細胞系克隆形成的影響;采用蛋白質印跡法(Western blot)檢測兩種細胞系的蛋白表達差異。結果①SKOV3/DDP細胞系的RI為6.10,屬中度耐藥。②在SKOV3細胞系中,順鉑聯合雷帕霉素作用24 h、48 h后的細胞增殖抑制率明顯高于單用順鉑組,差異有統計學意義(P<0.01),兩組間的72 h細胞增殖抑制率無明顯的統計學意義(P>0.05);順鉑聯合雷帕霉素作用于SKOV3/DDP細胞系24 h、48 h、72 h后的細胞增殖抑制率均明顯高于單用順鉑組,差異有統計學意義(P<0.01)。③雷帕霉素聯合順鉑作用于SKOV3細胞系4 h后,其克隆形成抑制率明顯高于單用順鉑組,差異有統計學意義(P<0.01)。④SKOV3/DDP細胞系比SKOV3細胞系p-mTOR、p-AKT的表達升高,而m TOR、AKT的表達則相似。⑤聯合用藥組比單用順鉑組的PARP斷裂增加。⑥雷帕霉素作用SKOV 3細胞系24 h,BCL2表達下調,LC3B由LC3BⅠ向LC3BⅡ轉化增加;在SKOV3/DDP細胞系中未發現這兩種作用。結論①在體外培養條件下,雷帕霉素能增強SKOV3及SKOV3/DDP細胞系對順鉑的敏感性。②m TOR信號通路激活可能在卵巢癌細胞系順鉑耐藥機制中起重要作用。③雷帕霉素增強SKOV3細胞系對順鉑敏感性的分子機制包括:增強順鉑所致的DNA斷裂、下調抗凋亡蛋白BCL2及引起細胞自噬;雷帕霉素增強SKOV3/DDP對順鉑敏感性分子機制可能與增強順鉑所致的DNA斷裂有關。
卵巢癌;雷帕霉素;順鉑耐藥;mTOR通路
Oncol prog,2015,13(4)
卵巢癌起病隱匿,確診時約70%的患者病情已屬晚期,治療效果差[1]。目前,晚期卵巢癌的治療包括腫瘤細胞減滅術及術后含鉑類藥物聯合化療,在一定程度上提高了卵巢癌患者的生存率,但其5年平均生存率卻在30%左右[2]。研究表明,約70%的卵巢癌患者對首次術后化療有效,但其中大部分患者2年內出現復發或轉移[4-5]。鉑類是晚期卵巢癌患者化療的一線藥物,但在治療過程中會出現耐藥。化療耐藥是晚期卵巢癌治療的難點。
近年發現m TOR通路在卵巢癌順鉑耐藥機制中起重要作用[3-4]。作為細胞生存通路,其在細胞增殖、生長、生存和代謝中起重要作用。在生長因子的刺激下,PI3K激活并磷酸化PIP2轉化成PIP3,PIP3招募下游AKT分子到細胞膜,使AKT第308位蘇氨酸和第473位絲氨酸磷酸化激活,繼而使多種底物磷酸化而發揮功能。其中最重要的底物——哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,m TOR)是一種絲/蘇氨酸激酶。AKT直接或通過磷酸化抑制TSC2間接激活mTOR。激活的m TOR與m TOR調節相關蛋白形成復合物,激活核糖體40S小亞基S6蛋白激酶并磷酸化抑制4E-BP1,引起蛋白轉錄增加。該通路異常激活與卵巢癌順鉑耐藥的發生有關:透明細胞癌本身就對鉑類敏感性差,其p-m TOR的表達比在漿液性腺癌中的高[5]。小干擾RNA敲除AKT基因,使AKT磷酸化激活減少,能增強順鉑對SKOV3細胞增殖的抑制作用[6]。雷帕霉素抑制該通路激活,能增強鉑類對卵巢癌細胞系增殖的抑制作用[7]。
本研究選擇人卵巢癌順鉑非耐藥細胞系SKOV3及順鉑耐藥細胞系SKOV3/DDP,采用CCK-8法、克隆平板實驗、Western blot等方法檢測雷帕霉素對兩種細胞系順鉑敏感性的影響,研究m TOR信號通路與SKOV3/DDP順鉑耐藥的相關性,初步探究雷帕霉素抑制卵巢癌細胞系增殖的分子機制。
1 材料和方法
1.1 材料來源
1.1.1 試劑/抗體 順鉑購于齊魯制藥廠;雷帕霉素和單克隆抗體(m TOR、p-m TOR、AKT、p-AKT、PARP、LC3B、BCL2)購于美國CST(Cell Signal Techenology)公司;CCK-8試劑購于碧云天生物技術有限公司。
1.1.2 細胞系和培養條件 SKOV3細胞系及SKOV3/DDP細胞系均購于中國醫學科學院腫瘤醫院細胞庫。兩種細胞系均培養于RPM I 1640、10%胎牛血清和1%雙抗組成的完全培養基中,在37℃、5%CO2恒溫細胞培養箱中孵育。SKOV3/ DDP細胞系采用小劑量順鉑循序誘導耐藥,耐藥穩定。為保持SKOV3/DDP細胞系對順鉑的耐藥性,實驗前1周用低濃度順鉑(0.5μg/m l)含藥培養基對其進行培養。
1.2 方法
1.2.1 RI測定 取生長良好的SKOV3細胞系,濃度為每毫升5×104個,每孔100μl接種至96孔板,培養過夜后,以含有6個梯度濃度的順鉑培養基替換原培養基(分別為0.3125μg/m l、0.625μg/m l、1.25μg/m l、2.5μg/m l、5μg/m l、10μg/m l),每孔100μl,孵育24 h,每一個濃度設4個平行孔,重復3次。每孔加入CCK-8試劑10μl,孵育2 h。以450 nm波長測定吸光度(OD值)。SKOV3/DDP的測定方法相同。同時設空白組(即含等體積含藥培養基及CCK-8試劑,不含細胞),測定細胞增殖抑制率。細胞增殖抑制率=[1-(ODexp-OD空白)/(ODctrl-OD空白)]×100%(Exp:實驗組,Ctrl:對照組)。用SPSS 16.0軟件描繪細胞增殖抑制率與順鉑濃度的關系方程,求出半數抑制濃度(IC50)。RI=IC50SKOV3/DDP/IC50SKOV3。
1.2.2 細胞增殖分析 96孔板中加入生長良好SKOV3細胞,濃度為每毫升2×104個,每孔為100μl,隔日棄去培養基。對照組換用等體積不含藥完全培養基,設4個平行孔,重復3次;實驗組再分為3組,即雷帕霉素20 nmol/L組(RP 20 nM組)、順鉑5μg/m l組(CIS 5μg/m l組)及雷帕霉素20 nM+順鉑5μg/m l組(聯合用藥或RP 20 nM+CIS 5μg/m l組),每組亦設4個平行孔,重復3次。每組每孔中分別加入對應的含藥培養基各100μl。每組分別設空白組(含等體積對應含藥培養基及CCK-8試劑,不含細胞)。采用CCK-8法在24 h、48 h、72 h后測定450 nm波長處的OD值。SKOV3/DDP細胞系分析方法相同。細胞增殖抑制率計算同前。
1.2.3 克隆形成分析 6孔培養板中加入生長良好的SKOV3細胞,濃度為每毫升100個,每孔為2m l,隔日棄去培養基。對照組換用不含藥完全培養基2m l,設6個平行孔,重復3次;實驗組分3組,即RP 20 nM組、CIS 5μg/m l組及RP 20 nM+CIS 5 μg/m l組,每組設6個平行孔,重復3次,每組每孔中分別加入對應的含藥培養基各2m l。實驗組每組按藥物作用時間不同再分為3組:2 h組、4 h組和24 h組。到達孵育時間后,立即更換不含藥完全培養基。14天后,計數細胞克隆(>50個考慮在內)。克隆形成抑制率=(1-Rexp/Rctrl)×100%(R=細胞克隆數)。
1.2.4 Western blot蛋白分析 細胞培養并離心棄上清,用冰預冷PBS沖洗兩次,加蛋白裂解液,4℃冰上裂解15分鐘;4℃、12 000 rpm離心機離心10m in,取上清液分裝,測蛋白濃度。等量蛋白質通過SDS-PAGE分離,并轉移至聚偏氟乙烯膜。TBST配制5%BSA(牛血清白蛋白),將膜浸入,室溫下封閉1 h。將各種特異性抗體孵育,4℃過夜;封閉液稀釋辣根過氧化酶,標記稀釋后的二抗,與膜共同孵育,沖洗。增強化學發光法(enhanced chem ilum inescence,ECL)顯色,曝光。
1.3 統計學方法
數據分析采用SPSS 16.0統計學軟件。細胞增殖抑制率、克隆形成抑制率多組比較用方差分析,P<0.05為差異有統計學意義;采用SPSS擬合細胞增殖抑制率與順鉑濃度之間的線性方程,計算IC50;采用Labworks灰度分析軟件分析Western blot圖像。
2 結果
2.1 RI計算
如表1所示,順鉑抑制兩種細胞系的增殖,隨著順鉑濃度的提高,細胞增殖抑制率亦增加。SPSS擬合兩者的關系方程:Y1=0.202+0.049X(Y1:SKOV3細胞增殖抑制率;X:順鉑濃度);Y2= 0.018+0.013X(Y2:SKOV3/DDP細胞增殖抑制率)。IC50SKOV3=6.08μg/m l,IC50SKOV3/DDP=37.08μg/m l。SKOV3/ DDP細胞系RI=IC50SKOV3/DDP/IC50SKOV3=37.08/6.08=6.10。
2.2 不同用藥方案對兩種細胞系增殖抑制率的影響
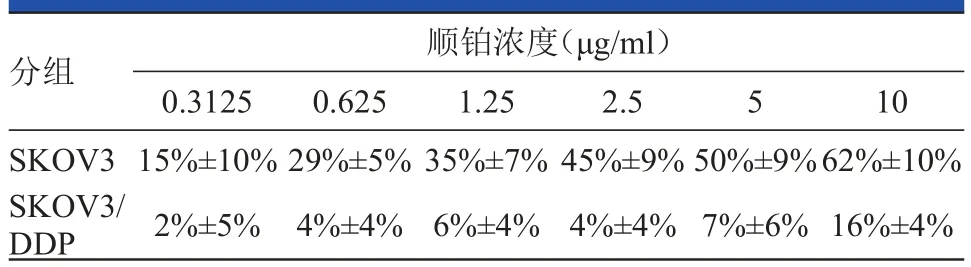
表1 順鉑梯度濃度作用24 h兩種細胞系增殖抑制率
在SKOV3細胞系中,聯合用藥及單用順鉑24 h、48 h、72 h,細胞增殖抑制率分別為18%± 4%、54%±9%、79%±1%,以及7%±5%、39%±6%、77%±19%)(圖1 A)。其中聯合用藥組的24 h、48 h細胞增殖抑制率明顯高于單用順鉑組,差異有顯著的統計學意義(P<0.01);兩組間的72 h細胞增殖抑制率比較,差異無統計學意義(P>0.05)。
在SKOV3/DDP細胞系中,聯合用藥及單用順鉑24 h、48 h、72 h,細胞增殖抑制率分別為58%± 7%、77%±3%、79%±4%,以及31%±12%、61%± 23%、64%±3%)(圖1 B)。聯合用藥組24 h、48 h、72 h細胞增殖抑制率明顯高于單用順鉑組,其差異有統計學意義(P<0.01)。

圖1 不同用藥方案對SKOV3細胞系及SKOV3/DDP細胞系增殖抑制率的影響
2.3 不同用藥方案對兩種細胞系克隆形成的影響
在SKOV3細胞系中,CIS 5μg/m l、RP 20 nM、聯合用藥作用2 h、4 h及24 h,其克隆形成抑制率分別為8%±2%、3%±5%、100%±0,7%±9%、4%± 6%、5%±8%及10%±8%、89%±6%、100%±0)(圖2 A,圖3 A)。
在SKOV3/DDP細胞系中,CIS 5μg/m l、RP 20 nM、聯合用藥作用2 h、4 h及24 h,其克隆形成抑制率分別為87%±4%、97%±1%、100%±0,48%± 15%、62%±19%、39%±19%及75%±12%、100%±0、100%±0)(圖2 B,圖3 B)。
多組間的比較采用方差分析,結果如下:SKOV3細胞系,不同方案作用4 h,F=425.89,P<0.01。多重比較,方差齊,采用LSD檢驗:CIS 5 μg/m l組vs聯合用藥組及RP 20 nM組vs聯合用藥組,差異均有明顯的統計學意義(P<0.01)。SKOV3/DDP細胞系,不同方案作用2 h,F=19.20,P<0.01。多重比較,方差不齊,采用Tamhane檢驗:CIS 5μg/m l組vs RP 20 nM組,差異有顯著的統計學意義(P<0.01);RP 20組vs聯合用藥組,差異有統計學意義(P<0.05)。作用4 h,F=22.76,P<0.01,差異有顯著的統計學意義。多重比較,方差不齊,采用Tamhane檢驗:三組間兩兩比較,差異均有顯著的統計學意義(P<0.01)。

圖2 不同用藥方式對SKOV3細胞系及SKOV3/DDP細胞系克隆形成抑制率的影響

圖3 細胞克隆平板實驗——培養14天后的結晶紫染色
2.4 mTOR通路相關蛋白在兩種細胞系中的表達差異
SKOV3細胞系和SKOV3/DDP細胞系的pm TOR、p-AKT、m TOR、AKT灰度值分別為0.334、0.402、1.316、1.183,以及0.938、0.912、1.392、1.310(圖4)。灰度分析表明,SKOV3/DDP細胞系比SKOV3細胞系p-m TOR、p-AKT的表達升高,而m TOR、AKT的表達相似。

圖4 m TOR通路相關蛋白在兩種細胞系中的表達差異
2.5 雷帕霉素聯合順鉑對兩種細胞系PARP表達的影響
SKOV3細胞系和SKOV3/DDP細胞系單用順鉑組、單用雷帕霉素組、聯合用藥組PARP的灰度值分別為0.358、0.142、0.517及0.397、0.240、0.845(圖5)。灰度分析表明,單用雷帕霉素不引起明顯的PARP斷裂;聯合用藥組比單用順鉑組使細胞系PARP斷裂增加。

圖5 不同用藥方案對PARP表達的影響
2.6 雷帕霉素對兩種細胞系BCL2及LC3B表達的影響
雷帕霉素作用于SKOV3細胞系及SKOV3/ DDP細胞系各24 h,其BCL2、LC3B灰度值分別為0.623、1.101及0.586、0.378,對照組灰度值分別為1.227、0.451及0.362、0.706(圖6)。灰度分析表明,在SKOV3細胞系中,雷帕霉素使BCL2表達下調,使LC3B由LC3BⅠ向LC3BⅡ轉化增加;而在SKOV3/DDP細胞系中未發現這兩種作用。

圖6 雷帕霉素對兩種細胞系BCL2和LC3B表達的影響
3 討論
3.1 雷帕霉素對癌細胞系的作用
本研究顯示,SKOV3/DDP細胞系RI為6.10,屬順鉑中度耐藥,適合進行卵巢癌細胞系順鉑耐藥體外研究。Mazzoletti等[8]在卵巢癌細胞系及前列腺癌細胞系中研究發現,雷帕霉素可抑制下游AKT蛋白磷酸化。Lu等[9]提出,雷帕霉素可增強卵巢癌細胞的自噬作用。本研究結果表明,雷帕霉素能明顯增強順鉑對SKOV3及SKOV3/DDP細胞系增殖的抑制作用,與文獻報道相符合。另外,兩種細胞系對雷帕霉素的敏感性也不同。單用RP 20 nM對SKOV3/DDP細胞系增殖抑制作用強,可能與SKOV3/DDP細胞系m TOR通路存在更多激活有關。
3.2 mTOR通路與卵巢癌細胞耐藥相關性
當mTOR通路激活時,AKT和m TOR被磷酸化為p-AKT、p-m TOR。Peng等[10]發現順鉑可誘導卵巢癌細胞中PI3K通路的激活,通過抑制AKT或m TOR的表達來增強耐藥株對順鉑的敏感性。Wang等[11]發現m icroRNA-199a通過下調mTOR的表達來逆轉卵巢癌細胞對順鉑的耐藥性。Jeong等[12]發現PI3K在卵巢癌紫杉醇耐藥細胞及卵巢癌組織中表達明顯增高,以siRNA沉默PI3K表達可通過抑制S期激酶相關蛋白——Skp2的表達,阻斷細胞由G1期向S期過渡,從而增強耐藥細胞對紫杉醇的敏感性;另建立裸小鼠耐藥移植瘤模型,進一步證實了沉默PI3K在體內的化療增敏作用。本研究數據顯示,SKOV3/DDP中p-AKT和pm TOR的表達明顯高于SKOV3,推測卵巢癌順鉑耐藥可能與m TOR通路激活有關。
3.3 雷帕霉素增強卵巢癌細胞系順鉑敏感性可能的分子機制
鉑類耐藥機制尚不完全清楚,研究認為由多因素導致,包括:鉑類藥物與DNA結合不充分、細胞解毒作用增強、DNA修復增強、運載體表達下調、腫瘤細胞染色體改變、癌基因激活及抑癌基因缺失,以及細胞凋亡途徑相關基因表達改變,如p53基因[13]。
順鉑能結合細胞DNA,形成鏈間交聯及鏈內二元N7位加合物,引起DNA損傷,從而抑制DNA復制。大量文獻表明,PARP可作為DNA損傷的感受器,它是細胞凋亡的標志[14]。Peng等[10]報道,聯用雷帕霉素及順鉑使卵巢癌順鉑敏感株OV433及耐藥株OV433-CR PARP斷裂增加。Schlosshauer等[7]發現,雷帕霉素能增強卡鉑引起的DNA斷裂,使PARP表達增加。本研究結果顯示,單用雷帕霉素不引起PARP斷裂,聯合用藥比單用順鉑能明顯增加PARP的斷裂,結果與文獻描述相吻合。
目前,學者們已普遍達成共識,細胞對程序性死亡產生抵抗是導致化療耐藥的一個主要原因[15]。BCL2蛋白家族通過線粒體膜外抗凋亡成員和促凋亡成員的比例來控制線粒體膜的完整性,決定細胞的生存與凋亡。細胞自噬涉及可控自噬小體形成,其與溶酶體融合,自噬小體內分子消化,導致細胞死亡。本研究顯示:雷帕霉素作用于SKOV3細胞系24 h后,BCL2比對照組的表達降低,LC3BⅠ向LC3BⅡ的轉化增加;而作用于SKOV3/DDP細胞系24 h后,BCL2的表達比對照組升高,未發現LC3BⅠ向LC3BⅡ轉化。這表明雷帕霉素抑制SKOV3細胞系增殖的分子機制可能與下調抗凋亡蛋白BCL2的表達及引起細胞自噬有關;在SKOV3/DDP細胞系中未發現下調BCL2及細胞自噬作用。
本研究首次采用抗凋亡蛋白BCL2及細胞自噬相關蛋白LC3B研究雷帕霉素增強卵巢癌細胞系SKOV3及SKOV3/DDP順鉑敏感性的分子機制,目前國內外尚未見報道。m TOR信號通路與卵巢癌順鉑耐藥相關性及雷帕霉素抑制腫瘤細胞增殖的研究,為學者們認識卵巢癌耐藥機制及臨床應對卵巢癌順鉑耐藥提供了新思路。
[1]Sogabe M,Nozaki H,Tanaka N,et al.Novel glycobiomarker for ovarian cancer that detects clear cell carcinoma[J].JProteome Res,2014,13(3):1624-1635.
[2]曹澤毅.中華婦產科學(臨床版)[M].2012,北京:人民衛生出版社,641.
[3]Fan Y,Wang L,Han X,et al.Rab25 is responsible for phosphoinositide 3-kinase/AKTmediated cisplatin resistance in human epithelial ovarian cancer cells[J].Mol Med Rep,2015,11(3):2173-2178.
[4]Cai Y,Tan X,Liu J,et al.Inhibition of PI3K/Akt/m TOR signaling pathway enhances the sensitivity of the SKOV3/DDP ovarian cancer cell line to cisplatin in vitro [J].Chin JCancer Res,2014,26(5):564-572.
[5]Kashiyama T,Oda K,Ikeda Y,et al.Antitumor activity and induction of TP53-dependent apoptosis toward ovarian clear cell adenocarcinoma by the dual PI3K/m TOR inhibitor DS-7423[J].PLoSOne,2014,9(2):e87220.
[6]Kim KW,Myers CJ,Jung DK,et al.NVP-BEZ-235 enhances radiosensitization via blockade of the PI3K/ m TOR pathway in cisplatin-resistant non-small cell lung carcinoma[J].Genes Cancer,2014,5(7-8):293-302.
[7]Schlosshauer PW,LiW,Lin KT,et al.Rapamycin by itself and additively in combination w ith carboplatin inhibits the grow th of ovarian cancer cells[J].Gynecol Oncol,2009,114(3):516-522.
[8]Mazzoletti M,Bortolin F,Brunelli L,et al.Combination of PI3K/m TOR inhibitors:antitumor activity and molecular correlates[J].Cancer Res,2011,71(13):4573-4584.
[9]Lu Z,Yang H,Sutton MN,et al.ARHI(DIRAS3)induces autophagy in ovarian cancer cells by downregulating the epidermal grow th factor receptor,inhibiting PI3K and Ras/MAP signaling and activating the FOXo3a-mediated induction of Rab7[J].Cell Death Differ,2014,21 (8):1275-1289.
[10]Peng DJ,Wang J,Zhou JY,et al.Role of the Akt/ mTOR survival pathway in cisplatin resistance in ovarian cancer cells[J].Biochem Biophys Res Commun, 2010,394(3):600-605.
[11]Wang Z,Ting Z,Li Y,et al.M icroRNA-199a is able to reverse cisplatin resistance in human ovarian cancer cells through the inhibition of mammalian target of rapamycin[J].Oncol Lett,2013,6(3):789-794.
[12]Jeong JY,Kim KS,Moon JS,et al.Targeted inhibition of phosphatidyl inositol-3-kinase p110beta,but not p110alpha,enhances apoptosis and sensitivity to paclitaxel in chemoresistant ovarian cancers[J].Apoptosis, 2013,18(4):509-520.
[13]Yang-Hartw ich Y,Soteras MG,Lin ZP,et al.P53 protein aggregation promotes platinum resistance in ovarian cancer[J].Oncogene,2014,http://www.ncbi.nlm.nih. gov/pubmed/%2025263447.
[14]Kim TH,Kim JS,Kim ZH,et al.Khz(fusion product of Ganoderma lucidum and Polyporus umbellatus Mycelia)induces apoptosis in human colon carcinoma HCT116 cells,accompanied by an increase in reactive oxygen species,activation of Caspase 3,and Increased Intracellular Ca2+[J].JMed Food,2015,18(3):332-336.
[15]Hu W,Wang F,Tang J,et al.Proapoptotic protein Smac mediates apoptosis in cisplatin-resistant ovarian cancer cells when treated w ith the anti-tumor agent AT101[J].JBiol Chem,2012,287(1):68-80.
Mechanism of rapamycin increasing the chemosensitivity of ovarian cancer cell lines to cisplatin△
ZHANG Yong-qing1XU Chun-yu1LIRui-rui1LU Jing2JIAO Kun2HUANG Jie3ZHOU Tong-liang4M IAO Jin-wei1#1DepartmentofGynecologicOncology,theBeijingObstetricsandGynecology A ffiliated HospitalofCapitalMedicalUniversity,Beijing100026,China
2Laboratory of PreclinicalMedicine,Schoolof PreclinicalMedicine,CapitalMedicalUniversity,Beijing 100069,China3Laboratory of PreclinicalMedicine,Schoolof PreclinicalMedicine,Ohio State University,Columbia200060,United States4Laboratory of PreclinicalMedicine,Sino-Japanese Friendship Hospital,Beijing 100029,China
ObjectiveThe study is aimed to learn the influence of rapamycin on the sensitivity of cisplatin inovarian cancer cell lines,and to investigate the relationship between them TOR signaling pathway and cisplatin-resistance in ovarian cancer cell lines,besides,themolecularmechanism of the cytotoxic effects of rapamycin on ovarian cancer cell lines is preliminarily explored.MethodThe resistance index(RI)and cell proliferation inhibition rate were analyzed by CCK-8 assay.A fter the adm inistration of different therapies,the influence of colony formation on the two cell lines were evaluated w ith clone tablet experiment.The different expression of proteins in both cell lines were detected using Western blot.Result1)The RIof SKOV3/DDP cell line was 6.10,indicating amoderate resistance to cisplatin.2)In SKOV3 cell line,the cell proliferation inhibition rate of combined therapy groups were significantly higher than that of cisplatin groups after treatment for 24 h and 48 h(P<0.01),while there was no statistical difference after 72 h treatment(P>0.05).In SKOV3/DDP cell line,the cell proliferation inhibition rates of combined therapy groupswere significantly higher compared to cisplatin groups in 24 h,48 h,72 h,w ith statistically significant difference(P<0.01).3)In SKOV3 cell line,when cells were incubated w ith cisplatin+rapamycin for 4h,the colony formation inhibition rate was significantly higher when compared w ith the cisplatin groups(P<0.01).4)Gray-scale analysis showed that p-mTOR and p-AKT were overexpressed in SKOV3/DDP,while mTOR,AKT had similar expression.5)Rapamycin+cisplatin had more cleavage than cisplatin groups.6)SKOV3 cell line had a decreased expression of BCL2,and an increased transformation from LC3BI to LC3BII when treated w ith rapamycin for 24 hours;And those were not observed in SKOV3/DDP cell line.Conclusion1)In vitro,rapamycin can enhance the chemosensitivity of SKOV3 and SKOV3/DDP cell lines to cisplatin.2)The activation of the m TOR pathway may play an important role in the development of cisplatin-resistance.3)Rapamycin increases the chemosensitivity of SKOV3 cell line to cisplatin,of which the underlying molecularmechanismsmay include:enhancement of cisplatininduced DNA cleavage,downregulation of BCL2 and induce of autophagy,while the mechanisms involved in SKOV3/DDP cell line only include the enhancement of cisplatin-induced DNA cleavage.
ovarian cancer;rapamycin;cisplatin resistance;mTOR pathway
R737.3
A
10.11877/j.issn.1672-1535.2015.13.04.14
北京市留學人員科技活動擇優資助項目(20080002)
#通信作者(corresponding author),e-mail:miaojinweigyn@163.com
2014-12-10)

