多發性骨髓瘤伴椎管浸潤2例
宋 敏 王建寧 孟慶齊 包紅雨 付行財 侯艷秋 張柳波 蔣蘇豫
南京醫科大學第二附屬醫院血液科,江蘇南京 210011
多發性骨髓瘤(multiple myeloma,MM)是一種漿細胞的惡性克隆性增殖性疾病,約占血液系統惡性腫瘤的10%。隨著社會老年化進程,其發病率逐漸上升。絕大多數MM患者骨髓瘤細胞局限于骨髓和骨,臨床上常表現為廣泛的溶骨性病變或骨質疏松、高鈣血癥、腎功能損害和貧血等,但臨床上可見疾病初發或疾病過程中時有髓外浸潤的表現[1-2],是MM預后不良的獨立預后因素[3]。MM伴椎管浸潤的病例非常罕見[4],預后極差。及早發現、診斷和個體化治療是改善預后的關鍵,患者一旦出現截癱,治療效果差,進展迅速,預后差。本文報道2例MM伴椎管浸潤病例的臨床表現、相關治療過程及疾病的進展情況,希望能為臨床工作者的診治帶來一定的啟發。
1 臨床資料
病例1:患者,女性,62歲,主因“乏力、骨痛3年,雙下肢癱5個月,上腹痛3個月”于2013年11月1日入院。患者入院3年前無明顯誘因出現乏力、胸壁骨痛漸加重,2011年3月28日入南京醫科大學第二附屬醫院(以下簡稱“我院”)消化科查胸部CT+上腹部CT示:兩側多發肋骨破壞、骨折,胸骨及胸椎、肩胛骨骨質破壞改變,轉入我院血液科(以下簡稱“我科”)。血常規示:白細胞計數 (WBC)4.1×109/L,血紅蛋白(HB)71.0 g/L,血小板計數(PLT)181×109/L。球蛋白:29.2 g/L,乳酸脫氫酶(LDH):245 U/L,腎功能正常。IgA:0.26g/L,IgG:9.47 g/L,IgM:0.24 g/L。血清輕鏈κ:2.51 g/L,血清輕鏈 λ:1.15 g/L。尿輕鏈 κ:7.76 mg/L,尿輕鏈 λ<3.66 mg/L。免疫固定電泳提示KAP鏈陽性。骨髓細胞學示:粒系、紅系、巨核系三系增生骨髓象,漿細胞占1.2%,異形性明顯,可見三核漿細胞,網狀細胞易見,成熟紅細胞輕度緡錢狀。骨髓活檢:骨髓增生活躍,網染輕度纖維組織增生,局灶漿細胞聚集。左側第10肋骨病灶活檢病理免疫組化:CD38+,CD138+,LCA+,CD3-,CD20-,CD45RO 灶 性+,CD79α-,PAX5- ,MPO- ,TDT- ,CD99- ,CKpan- ,EMA- ,S-100-,DES-,VIM+-,MyoD1-, 間皮細胞-,Syn-,CgA-。PET-CT提示多發性骨破壞。診斷:多發性骨髓瘤κ輕鏈型Ⅲ期A組,于2011年4月22日、5月13日、6月7日、7月6日應用硼替佐米+地塞米松(PD)方案化療 4 個療程,具體:地塞米松 20 mg,第 1~4、8~11 天;硼替佐米2 mg,第 1、4、8、11 天。然后檢查免疫固定、血清蛋白電泳、PET-CT等達CR,因經濟原因未再予以硼替佐米治療,予干擾素維持治療。2013年2月出現左下肢疼痛麻木漸加重,住院查尿輕鏈κ 8.74 mg/L,尿輕鏈 λ <3.66 mg/L。IgA 1.53 g/L,IgG 11.70 g/L,IgM 0.61g/L。血輕鏈κ 3.17g/L,輕鏈λ 1.21 g/L。免疫固定電泳:IgG陰性、IgA陰性、IgM陰性、κ陰性、λ陰性。但CT提示骨質密度異常,左側腹膜后及盆腔內占位,漿細胞瘤?考慮MM髓外復發,2013年3月11日開始局部放療,總照射劑量為45 Gy,放療結束后予以復查PET-CT:局部腫塊消退,腹腔臟器見多發高代謝影。2013年4月24日、5月14日再次應用PD方案化療。2013年5月23日突發雙下肢癱瘓,大小便不能控制,復查椎體磁共振示胸9~腰4腫塊,壓迫脊髓,考慮骨髓瘤椎管內浸潤,暫停化療,放療科會診后行局部放療:胸9~腰4髓內病灶區域,總劑量:36 Gy。2013年6月15日(圖1)復查磁共振提示:椎管內腫塊范圍較前2013年5月24日范圍略有縮小。放療期間出現上腹痛漸加重及上消化道出血,CT示:胃壁彌漫性、均勻性增厚。2013年7月2日予以胃鏡檢查示:胃底黏膜僵硬,可見黏膜潰爛,胃體大彎側黏膜僵硬伴潰爛,質脆易出血,胃竇黏膜充血水腫,黏膜面稍粗,欠平整。免疫組化:Ki-6790%+,CD38+,CD138+,LCA-,CD3-,CD5-,CD20-,CD45RO-,CD79α-,PAX5-,BCL-2+,BCL-6-,Mum-1+,Syn-,CgA-,CD30-,CD10-,CynlinD-(胃體黏膜)結合免疫組化,示漿細胞腫瘤。與家屬溝通,因患者一般情況欠佳,截癱,長期臥床,家屬拒絕手術治療,自2013年7月9日開始應用2個療程硼替佐米+地塞米松+吡柔比星(TPD)方案化療,骨髓抑制明顯,患者化療開始后曾有下肢、臀部淺表感覺(疼痛、麻木感)出現,然后再次消退。但兩次復查CT示胃壁彌漫性、均勻性增厚未見明顯好轉,效果欠佳,2013年9月予以胃區局部放療,總劑量為36 Gy。2013年10月6日,患者漸出現臀部,繼背、胸部等全身多發無痛性皮下結節并進行性增大,病理仍為骨髓瘤浸潤。2013年10月12日行雷那度胺+地塞米松(RD)方案化療,效果欠佳。繼予以小腸內插管腸內營養,長期導尿。病程中反復肺部感染、尿路感染,抗感染治療好轉并止痛對癥處理。患者最后一次于2013年11月1日入院時體格檢查:神清,精神萎,貧血貌,全身皮膚黏膜未見明顯黃染及出血點,臀部可見兩處皮下結節。鞏膜無黃染,胸廓無畸形,兩側肋骨有壓痛,左側為著,腹膨隆,劍突下壓痛+,肝脾肋下未及,兩下肢Ⅱ度可凹性水腫。雙下肢癱瘓,肌力0級。入院診斷:MM;椎管內、腹腔內、胃、皮下浸潤;截癱,低蛋白血癥。患者入院后繼續對癥支持治療,2013年11月2日起出現持續發熱,予以抗感染、抗真菌、止痛、補液等對癥處理效果欠佳,于2013年11月13日終因循環呼吸衰竭死亡。
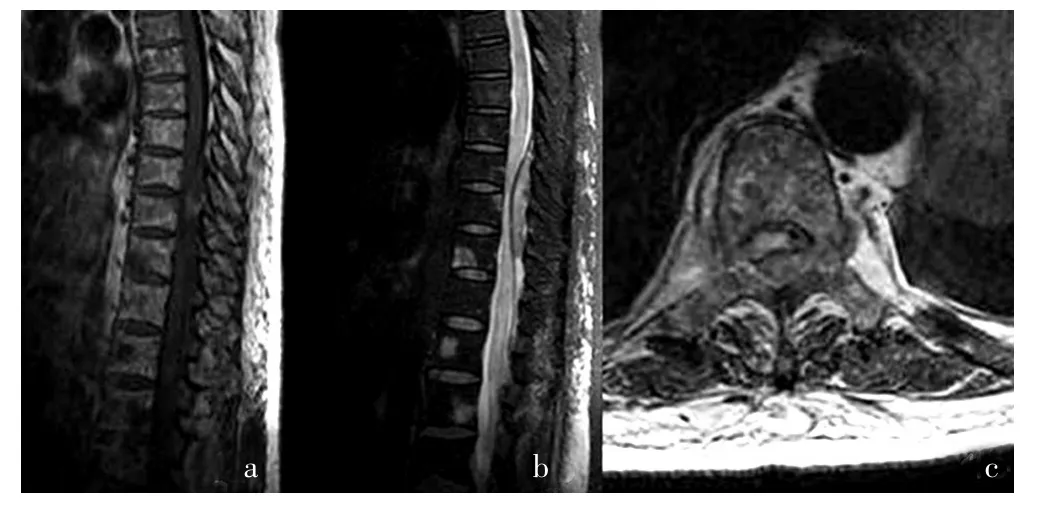
圖1 病例1胸腰段磁共振平掃
病例2:患者,男性,77歲,主因“反復雙下肢乏力1年余,雙下肢癱5個月”于2010年3月22日入院。患者2009年2月因外傷出現背部疼痛,雙下肢乏力、麻木,后癥狀逐步加重。2009年4月來我院行胸椎磁共振平掃:胸2~7椎體水平椎管內硬膜外、右側椎旁、胸腔腫塊。胸3~10、12椎異常信號。腰椎平掃:①腰椎退行改變,②腰 4~5椎間盤突出,③腰 3~4、腰 5、骶 1椎間盤膨隆,④腰4椎體滑脫。胸椎磁共振增強(圖2):胸2~7椎體水平椎管內硬膜外,胸2~4椎體水平胸腔后壁、胸5~11椎體,部分胸椎、肋骨異常信號,考慮轉移瘤可能,建議穿刺活檢。于2009年5月14日在全身麻醉下行椎管減壓和占位切除術。術中見腫塊呈長條形約1.5 cm×10 cm,暗褐色,血供豐富,邊界清,包膜尚完整,位于硬膜外,壓迫胸3~7節段脊髓,使之變扁。手術完整摘除腫塊,見受壓脊髓隆起。術后病理示:漿細胞骨髓瘤,免疫組化CD38+、CD138+,ECT示多處骨破壞。骨髓漿細胞10.8%,幼稚漿細胞易見。血常規:WBC 3.9×109/L、HB 119.0 g/L、PLT 187×109/L。β-MG:4.46 mg/L,尿輕鏈正常。IgA:11.6 g/L,IgG:3.55 g/L,IgM:0.28 g/L。輕鏈 κ 增高為主,免疫固定電泳示IgA、κ陽性,診斷“多發性骨髓瘤IgA、κ型Ⅲ期A組,伴胸椎椎管內、胸腔后壁、右側胸壁浸潤”。因經濟原因未能使用硼替佐米及其他強烈的靜脈用藥全身化療,分別于6、7月予以TMD方案化療,具體為:沙利度胺200 mg,1次/d,馬法蘭 10 mg/d,第1~4天,地塞米松20 mg,第1~4天。患者雙下肢乏力好轉,后患者家屬未同意繼續聯合化療。2009年10月患者再次出現雙下肢乏力,椎體磁共振胸椎平掃:第6、8、9、10胸椎椎體內見多發小圓形異常信號,胸8~10椎水平椎管內脊髓后方見條形等T1等T2信號,相應水平胸髓受壓;諸椎間盤未見膨隆或突出;椎間隙不窄;骨性椎管無狹窄。印象:胸椎多發異常信號伴椎管內占位,符合MM表現。2009年10月19日在全身麻醉下行胸椎管內骨髓瘤摘除術,術中見胸8~10椎椎板多發性“魚肉樣”病灶,該節段椎管內見5 cm×2.5 cm×2 cm大小、不規則腫塊,位于硬膜背側,呈暗紅色,未見明顯包膜,邊界尚清楚,與硬膜輕度粘連,壓迫胸段脊髓。手術沿腫塊分離粘連,完整摘除腫塊。見脊髓減壓充分。手術順利,但術后出現下肢癱瘓,予以抗感染、補液、消腫、營養神經及高壓氧等對癥處理,并于2009年11月24日~12月21日予胸1~12椎放療,40.5 Gy(20次)。雙下肢肌力 1~2級,足趾活動可,出院。術后病理仍示漿細胞骨髓瘤。后未繼續治療在家。2010年3月22日入院時一般情況差,進食少,消瘦明顯。大小便失禁。查體:神清,惡液質,臀部壓瘡,雙下肢肌力 0 級。血常規:WBC 5.3×109/L,HB 64.0 g/L,PLT 80×109/L。球蛋白> 60 g/L,IgA 28 g/L,診斷:MM,截癱,2型糖尿病,惡病質,壓瘡。一般情況差,不能耐受化療,家屬放棄積極治療,于2010年4月4日終因循環呼吸衰竭死亡。
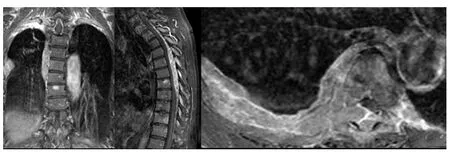
圖2 病例2胸椎磁共振增強
2 討論
MM是漿細胞在骨髓中呈惡性克隆增生的疾病,合并有髓外浸潤的MM患者治療困難,預后差,尤其在使用造血干細胞移植、沙利度胺治療后[5-7]。合并有椎管浸潤的患者,非常罕見,常見于伴其他部位髓外浸潤者,治療更棘手,預后更差,對這類患者目前國內外尚無標準的治療方案[8-10]。
鐘玉萍等[11]分析 2007~2009年北京朝陽醫院10例MM伴椎管浸潤住院患者中有8例患者在診斷MM時就是以髓外漿細胞瘤為主要表現,主要采取的方法為手術及化療。2例患者行手術治療后再進行化療(1例硼替佐米+VAD方案,1例MP+雷利度胺),8例患者單純接受化療(DECP方案),他們認為盡早手術對患者的神經功能恢復有一定的幫助,但一旦出現脊髓壓迫截癱,即使手術取出腫物,完全恢復的可能性也很小。主要治療以全身化療為主。對于疾病進展后出現髓外浸潤的患者,傳統化療方案往往難以奏效,而要選擇二線藥物或新的藥物。國外有類似報道,以PD方案治療MM伴髓外浸潤取得了較好的療效[12]。Li等[13]研究早期診斷的重要性,治療對傳統藥物療效不佳,而對包括新藥方案,如含硼替佐米的方案等有較好的反應。對有累及神經根癥狀的患者,建議盡可能早期實行手術切除腫塊,解除脊髓受壓,改善患者預后和生活質量。
復習文獻,目前關于椎管減壓術治療MM合并脊髓壓迫癥多為個案報道,對于其預后及生活質量改善的研究分析較少且無統計數據支持[14-15]。石磊等[16]總結北京2006~2012年積水潭醫院MM合并脊髓壓迫癥患者28例,患者均行化療,其中以硼替佐米為主的方案聯合化療10例,阿霉素/吡喃阿霉素+長春新堿/長春地辛+地塞米松(NCP)方案化療11例,以馬法蘭為主的方案聯合化療7例,其中7例在化療后進行脊髓壓迫部位的放療。根據是否進行椎管減壓術分為椎管減壓術組13例、非手術組15例,隨訪12個月,椎管減壓術組與非手術組的Frankel分級和美國東部腫瘤協作組體能狀態評分標準(ECOG-PS)的生活質量明顯改善率比較,差異無統計學意義。他們認為,椎管減壓術雖能在術后緩解患者的脊髓壓迫癥狀,但并不能使聯合化療的MM合并脊髓壓迫癥患者預后及生活質量得到進一步改善,且椎管減壓術及其并發癥有可能導致延誤放、化療時機,增加感染風險;以急性脊髓壓迫癥初診者在未明確MM診斷前,進行以腫物切除明確病理診斷同時進行減壓治療為目的的手術,可作為確診及緩解急性壓迫的手段,可先于聯合化療進行;明確診斷MM合并脊髓壓迫癥的初治病例和由于MM病情進展而造成的脊髓壓迫癥復發患者,則應首選聯合化療作為治療方案。本組病例2為首診因出現早期脊髓壓迫癥狀就診,即發現椎管內腫塊,胸外科行椎管減壓和占位切除術,結合術后病理、影像學、骨髓細胞學、血清學等相關檢查診斷:多發性骨髓瘤IgA、κ型,予TMD方案化療2個療程,效果佳,經濟原因未能堅持治療。從病程開始發現早期的脊髓壓迫癥狀始至死亡總病程約13個月,手術聯合全身化療2個療程,治療效果佳,蜜月期持續達5個月,再次出現脊髓壓迫癥狀,椎管內新病灶,手術治療輔以局部放療,效果差,5個月后死亡。
MM伴椎管內浸潤,預后差,進展快,治療困難,診治過程中應密切觀察、詢問患者的不適癥狀,尤其神經系統的表現,部分患者早期或僅有腰背部不適等主述,應引起重視,早期予以影像學檢查發現病灶,早期積極治療,盡可能地提高患者的生活質量,通過積極、多方案的聯合治療,延長患者生存期。部分MM患者出現椎管內浸潤的臨床表現常為急性脊髓壓迫癥狀加重的出現,迅速出現截癱,出現肢體感覺的異常,24 h內即出現截癱,發展非常迅速。本組病例1即為出現肢體感覺的異常迅速出現截癱。該患者為多發性骨髓瘤輕鏈κ型Ⅲ期A組,行PD方案治療達完全緩解(CP)后予干擾素維持,隨訪,免疫固定電泳陰性。患者PD方案治療后1.5年始出現髓外浸潤,首先發現腹腔腫塊,予局部放療后再次PD方案化療,化療過程中出現突發截癱,大小便失禁,磁共振提示胸椎和腰椎椎管內浸潤,壓迫脊髓,家屬放棄手術治療,予放療效果欠佳,放療中、后相繼出現胃部及皮下骨髓瘤浸潤,予TPD、RD等方案化療效果欠佳。患者總體病程近3年,出現截癱至死亡時間恰為5個月。
此外,筆者還收治1例67歲男性患者,為輕鏈型復發患者,M2方案治療達CR,隨診半年后復發,復發后治療過程中,一出現下肢麻木立即出現雙下肢截癱,因該患者曾行心臟支架術(Firebird2),該支架類型不能行磁共振檢查,僅予以CT檢查,因CT對椎管內浸潤影像學診斷的敏感性較差,未能發現有椎管內的占位表現,但該患者疾病進展迅速,數天內即因心力衰竭死亡。盡管沒有影像學的診斷依據,結合病史及臨床,仍應考慮患者椎管內占位引起的截癱可能。亦符合MM伴椎管內浸潤一旦出現截癱預后極差,治療效果差。同時提示考慮椎管內占位檢查應以磁共振為主,CT可能不能完全反映椎管內占位的情況。
總之,對MM患者應密切觀察病情變化,如早期的神經系統癥狀等,及早發現MM髓外浸潤的可能,并及早發現椎管內浸潤的可能性,早期根據患者的具體情況,制訂相應的治療方案,以改善患者預后[17]。MM髓外復發治療仍無標準方案,有報道,含來那度胺、硼替佐米等多藥聯合方案可能對髓外復發的MM患者治療有效[3,18-19],但都基于個案報道。早期使用含硼替佐米的治療方案并不能降低髓外復發率[20-22],本組病例結果與之符合。MM伴椎管內浸潤目前的研究都基于個案報道和回顧性分析,因此更多的前瞻性臨床研究將有助于探索最合適的治療方案。
[1]Varettoni M,Corso A,Pica G,et al.Incidence,presenting features and outcome of extramedullary disease in multiple myeloma:a longitudinal study on 1003 consecutive patients[J].Ann Oncol,2010,21(2):325-330.
[2]Katodritou E,Terpos E,Symeonidis AS,et al.Clinical features,outcome,and prognostic factors for survival and evolution to multiple myeloma of solitary plasmacytomas:a report of the Greek myeloma study group in 97 patients[J].Am J Hematol,2014,89(8):803-808.
[3]BladéJ,deLarreaCF,RosinolL.Extramedullaryinvolvement in multiple myeloma [J].Haematologica,2012,97(11):1618-1619.
[4]Repko M,Chaloupka R,Grosman R,et al.Surgical options in the treatment of myeloma of the spine[J].Vnitr Lek,2006,52(12):32-40.
[5]Katodritou E,Gastari V,Verrou E,et al.Extramedullary(EMP)relapse in unusual locations in multiple myeloma:is there an association with precedent thalidomide administration and a correlation of special biological features with treatment and outcome?[J].Leuk Res,2009,33(8):1137-1140.
[6]Lee SE,Kim JH,Jeon YW,et al.Impact of extramedullary plasmacytomas on outcomes according to treatment approach in newly diagnosed symptomatic multiple myeloma[J].Ann Hematol,2015,94(3):445-452.
[7]Billecke L,Murga Penas EM,May AM,et al.Cytogenetics of extramedullary manifestations in multiple myeloma[J].Br J Haematol,2013,161(1):87-94.
[8]Shin HJ,Kim K,Lee JW,et al.Comparison of outcomes after autologous stem cell transplantation between myeloma patients with skeletal and soft tissue plasmacytoma[J].Eur J Haematol,2014,93(5):414-421.
[9]Kumar AK,Dakhil C,Teeka Satyan M,et al.Extramedullary progression ofmultiplemyelomadespiteconcomitant medullary response to multiple combination therapies and autologous transplant:a case report[J].J Med Case Rep,2014,8(8):299.
[10]Pour L,Sevcikova S,Greslikova H,et al.Soft-tissue extramedullary multiple myeloma prognosis is significantly worse in comparison to bone-related extramedullary relapse[J].Haematologica,2014,99(2):360-364.
[11]鐘玉萍,陳世倫,李新,等.多發性骨髓瘤伴椎管浸潤10 例臨床分析[J].中國實驗血液學雜志,2010,18(2):466-468.
[12]Dytfeld D,Matuszak M,Lewandowski K,et al.Bortezomib in combination with thalidomide and dexamethasone—a successful treatment regimen in refractory extram edullary multiple myeloma[J].Ann Hematol,2008,87(3):253-254.
[13]Li X,Sun WJ,Chen SL,et al.Clinical analysis of multiple myeloma with extramedullary plasmacytomas[J].Zhonghua Yi Xue Za Zhi,2012,27,92(12):838-841.
[14]Pan J,Qian ZL,Sun ZY,et al.Open kyphoplasty in the treatment of a painful vertebral lytic lesion with spinal cord compression caused by multiple myeloma:a case report[J].Oncol Lett,2013,5(5):1621-1624.
[15]Papanastassiou ID,Eleraky M,Murtagh R,et al.Comparison of unilateral versus bilateral kyphoplasty in multiple myeloma patients and the importance of preoperative planning[J].Asian Spine,2014,8(3):244-252.
[16]石磊,肖斌,左杏果,等.椎管減壓術對多發性骨髓瘤合并脊髓壓迫癥患者生活質量的影響[J].山東醫藥,2013,53(48):43-44.
[17]Mont′Alveme F,Vallée JN,Guillevin R,et al.Percutaneous vertebroplastyformultiplemyelomaofthecervicalspine[J].Neuroradiology,2009,51(4):237-242.
[18]Kumar SK,Flinn I,Noga SJ,et al.Bortezomib,dexamethasone,cyclophosphamide and lenalidomide combination for newly diagnosed muhiple myeloma:phase 1 results from the multicenter evolution study[J].Leukemia,2010,24(7):1350-1356.
[19]Ito C,Aisa Y,Mihara A,et al.Lenalidomide is effective for the treatment of bortezomib-resistant extramedullary disease in patients with multiple myeloma:report of 2 cases[J].Clin Lymphoma Myeloma Leuk,2013,13(1):83-85.
[20]Calvo-Villas JM,Alegre A,Calle C,et al.Lenalidomide is effective for extramedullary disease in relapsed or refractory multiple myeloma [J].Eur J Haematol,2011,87(3):281-284.
[21]Weinstock M,Ghobrial IM.Extramedullary multiple myeloma[J].Leuk Lymphoma,2013,54(6):1135-1141.
[22]Papanikolaou X,Repousis P,Tzenou T,et al.Incidence,clinicalfeatures,laboratoryfindingsandoutcomeofpatients with multiple myeloma presenting with extramedullary relapse[J].Leuk Lymphoma,2013,54(7):1459-1464.

