缺素對土沉香幼苗根系生長和葉綠素熒光參數的影響
賈曉紅 周再知 馬華明 梁坤南 黃桂華 余雪標


摘 要 采用營養液培養法,以土沉香幼苗為試驗材料,研究在缺乏9種營養元素(即-N、-P、-K、-Ca、-Mg、-Fe、-Mn、-B、-Zn)環境條件下,苗木的根系生長、根系活力和葉綠素熒光參數的變化和響應機制。結果表明:(1)與全素對照相比,不同缺素處理下的土沉香幼苗根系生物量值和根系活力顯著下降,其中,-Ca和-K處理影響最顯著,其次為-Fe處理;(2)不同缺素處理穩態熒光產量(Ft),光適應時最大熒光(Fm′),葉綠體光系統II(PSⅡ)在部分反應中心關閉下實際光化學量子產量(Yield),非循環電子傳輸速率(ETR),光下最小熒光(Fo′)以及潛在最大光化學量子產量(Fv/Fm)值與CK處理差異顯著,其中,-P處理Ft值最小,Fe和P元素對Fm′抑制最明顯,-Fe處理對Yield值影響最大,-Mg處理的ETR值最小,-Fe處理抑制Fo′值最明顯,-P處理抑制Fv/Fm值最明顯。
關鍵詞 土沉香;缺素;根系生物量;根系活力;葉綠素熒光參數
中圖分類號 S567.19 文獻標識碼 A
土沉香[Aquilaria sinensis(Lour.)Gilg](別名白木香、女兒香、牙香樹、莞香、六麻樹),為瑞香科(Thymelaeaceae)沉香屬(Aquilaria Spp.),熱帶、亞熱帶常綠喬木,是傳統名貴藥材和天然香料,主要分布于廣東、海南、云南、廣西、福建、臺灣等地區,被列為國家二級重點保護植物名錄[1-4]。近年來,在培育土沉香人工林過程中,時常出現苗期或者種植時期,植株葉片發黃、矮小、萎蔫等癥狀,為了解決這些問題,學者開始致力于土沉香立地、營養施肥等方面的研究。王冉等[5]設置6個施肥量處理,進行珍貴樹種馬來沉香與土沉香苗期 N 素指數施肥試驗研究,探究不同 N 素供應水平對其苗期生長、光合生理特性的影響。楊曉清等[6]以土沉香3個種源的幼苗為材料,模擬水分脅迫,研究了氮素營養與水分脅迫對土沉香不同種源幼苗相關生理生化指標的耦合影響。但是利用葉綠素熒光技術進行土沉香營養診斷研究尚未見報道。因此,本試驗試圖利用溫室營養液培養法,觀測土沉香幼苗在不同缺素(即缺乏氮、磷、鉀、鈣、鎂、鐵、錳、硼、鋅)條件下根系生長、根系活力和葉綠素熒光參數的變化,為土沉香在缺素環境下的生理適應機制以及土沉香人工林的健康發展提供科學依據。
1 材料與方法
1.1 材料
采用長勢良好,大小均一(平均高度為9.2 cm,地徑為2.1 mm)的土沉香幼苗,用去離子水洗凈根部,于圓形黑色容器(上下口徑19 cm×高20 cm,容積5 L)內,用海綿固定幼苗,置于中國林業科學研究院熱帶林業研究所溫室內進行懸浮培養。
1.2 方法
1.2.1 試驗設計及處理 試驗采用隨機區組設計,10個處理,重復3 次,每個處理3株苗。10個處理分別是:①對照(CK,全素營養液);②缺氮(-N);③缺磷(-P);④缺鉀(-K);⑤缺鈣(-Ca);⑥缺鎂(-Mg);⑦缺鐵(-Fe);⑧缺錳(-Mn);⑨缺硼(-B);⑩缺鋅(Zn)。
移苗后用1/2濃度量的全營養液(即霍格蘭大量元素及阿農微量元素1938 a配方[7])培養1周。從第2周起,采用全濃度和10個處理配置營養液(即不同缺素及對照)培養。容器內營養液以能淹沒土沉香幼苗根系為宜,培養期間每天充氧氣1次,持續45 min,每隔1周換1次營養液,并及時清理掉水箱內青苔。定期用NaOH溶液或HCl調整箱內 pH值至6.5,減少光照溫度等外因的干擾并注意保持溫室內的清潔衛生,通氣良好。試驗期間,溫室不使用人工光源,白天平均溫度應保持在23~38 ℃,平均濕度 54%~78%。試驗從2012年9月開始到2013年6月結束,持續9個月,期間觀測不同缺素處理幼苗的表型特征,收獲時候測定幼苗的根系生物量、根系活力以及葉綠素熒光參數。
1.2.2 取樣調查與指標測定 試驗結束時,剪下植株根系測定其鮮重,并在70 ℃的烘箱中烘至恒重,稱取根干重。用氯化三苯基四氮唑(TTC)法測定根活力[8];并于晴朗無風天氣,采用便攜式調制葉綠素熒光儀PAM2500測定每株苗木3片健康葉片的穩態熒光產量Ft(Chlorophyll fluorescence)、光適應時最大熒光Fm′( Maximum fluorescence)、葉綠體光系統II(PSII)在部分反應中心關閉下實際光化學量子產量Yield(Photochemical quantum yield of PSII in the light)以及非循環電子傳輸速率ETR(Electron transport rate);暗適應下的初始熒光Fo和最大熒光Fm值于晚上20 : 30測定。按下列公式計算光下最小熒光Fo′(Minimum fluorescence light)和潛在最大光化學量子產量Fv/Fm(Potential maximum PSII quantum yield)[9]。
Fo′=Fo/(Fv/Fm+Fo/Fm′);Fv/Fm=(Fm-Fo)/Fm。
1.3 數據處理
用Excel2007對數據進行整理統計,SPSS18.0進行方差分析和Duncan多重比較。
2 結果與分析
2.1 不同缺素處理對土沉香幼苗根系生長和活力的影響
植物根系是活躍的吸收器官和合成器官,根的生長情況和活力水平直接影響地上部分的營養狀況及產量水平[10]。由表1可知,CK處理的根系生物量均顯著高于各缺素處理(p<0.05),其值為根系生物量值最小-K和-Ca處理的3.53倍。9個缺素處理中,地下部分生物量最大的是-Mn和-B處理,比-K和-Ca處理增大了1.33倍,各處理之間差異不顯著。
缺素處理環境下土沉香幼苗的根系活力有顯著性差異(p<0.05)。各處理的根系活力從高到低依次為CK>-Zn>-Mn>-B>-N>-Fe>-P>-Mg>-K>-Ca,其中,CK處理的根系活力顯著高于其他缺素處理;缺素處理中對根系活力影響最顯著的是-Ca處理和-K處理,均比CK處理分別降低了80.0%;對根系活力影響最小的為-Zn處理,其次為-P、-Mg和-Fe處理,分別比CK處理降低了10.0%,60.0%和70.0%。
2.2 不同缺素處理對土沉香幼苗葉綠素熒光參數影響
植株的生長發育離不開光合作用,光合作用是生物界所有物質代謝和能量代謝的物質基礎,通過測定植株光合作用對不同外界環境的生理響應,可以判斷植物的生長和健康狀況與其生境之間的關系,葉綠素熒光參數能夠反映光合作用的“內在性”特點[9-11]。
2.2.1 缺素處理對穩態熒光產量(Ft)的影響 方差分析表明,不同缺素處理對土沉香幼苗的葉綠素熒光參數有顯著影響(p<0.05)。除了-Ca和-B處理之外的其他缺素處理均使土沉香幼苗葉片的Ft值顯著低于CK處理,其中Ft值最小的是-P處理,比CK處理降低了40.0%;其次為-K和-Fe處理,分別比CK處理降低了32.0%和36.0%。9個缺素處理的Ft值大小依次為-B>-Ca>-Zn>-Mn>-N>
-Mg>-K>-Fe>-P,其中-B處理與除-Ca處理外的其他缺素處理差異性顯著,比-P處理增大了0.40倍(圖1)。
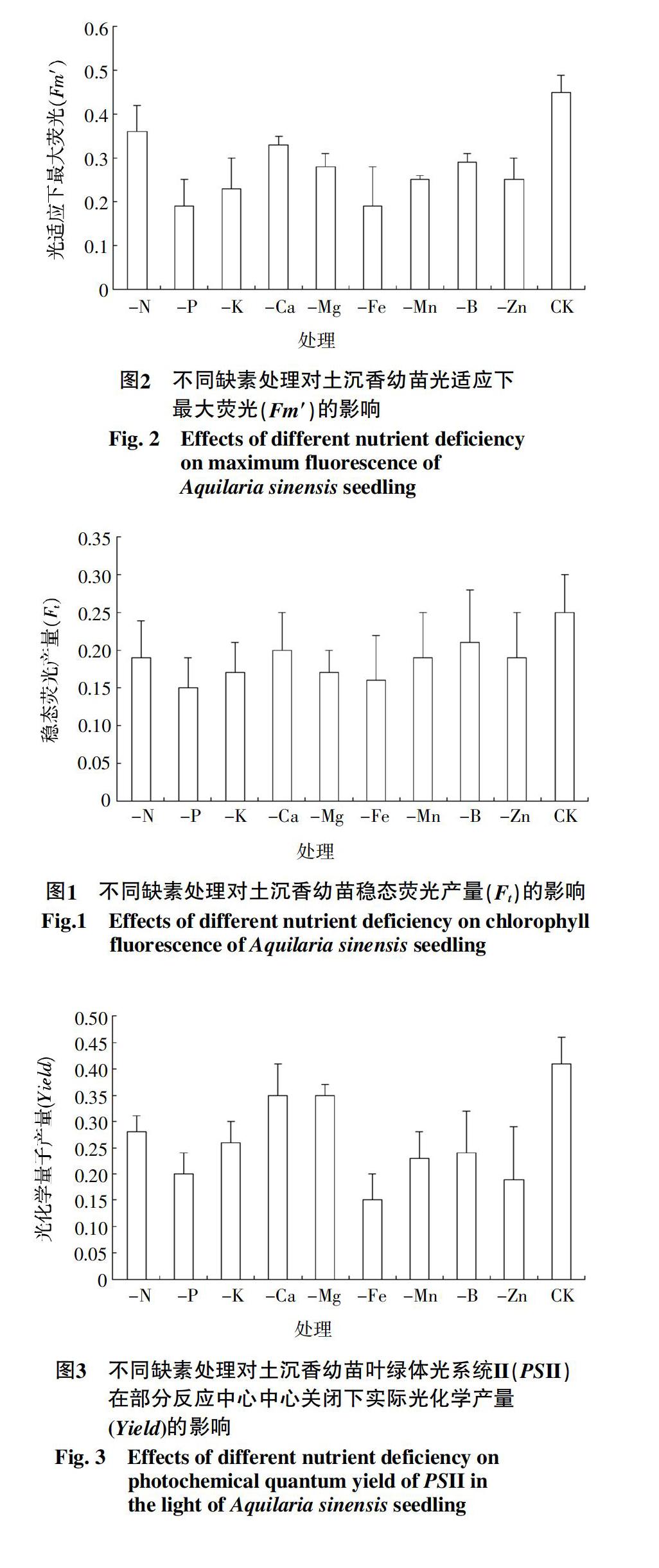
2.2.2 缺素處理對光適應下最大熒光(Fm′)的影響
各缺素處理中除-N處理之外均使土沉香幼苗的Fm′值顯著低于CK處理,其中土沉香幼苗Fm′ 值受到最明顯抑制的是-Fe處理和-P處理,值均為0.19,比CK處理降低了57.68%;其次為-K處理,比CK處理降低了20.0%。9個缺素處理的Fm′值大小順序為-N>-Ca>-B>-Mg>-Mn>-Zn>-K>
-P>-Fe,其中-Fe處理與其他缺素處理的差異性顯著,約占最大值-N處理的1/2(圖2)。
2.2.3 缺素處理對葉綠體光系統II(PSII)在部分反應中心關閉下的實際光化學量子產量(Yield)的影響
由圖3可知,-N,-Ca以及-Mg處理的土沉香幼苗的葉片Yield值與CK處理差異性不顯著,-P,-K,-Fe,-Mn,-B和-Zn處理的Yield值顯著低于CK處理,其中對其值抑制最明顯的是-Fe處理,值僅為0.15,比CK處理降低了63.4%;其次為-Zn處理和-P處理,分別比CK處理降低了53.7%和51.2%。各個缺素處理的Yield值大小順序是-N >-Mg>-Ca>-K>-B>-Mn>-P>-Zn>-Fe,其中-Fe處理與-N,-Mg,-Ca,-K,-B以及-Mn處理的差異性顯著,約占最大值-N處理的2/5。
2.2.4 缺素處理對非循環電子傳遞速率(ETR)的影響
各個缺素處理的土沉香幼苗的葉片ETR值顯著低于CK處理,其中-Mg處理的ETR值最小,僅為6.67,比CK處理降低了69.91%,其次為-Ca處理和-K處理,分別比CK處理降低了68.2%和67.7%。各個缺素處理的ETR值大小順序是-N>
-Mn>-B>-Zn>-Fe>-P>-K>-Ca>-Mg,其中-Mg處理與-N,-Mn,-B,-Zn和-Fe處理的差異性顯著,約占最大值-N處理的2/5(圖4)。
2.2.5 缺素處理對光下最小熒光(Fo′)的影響 圖5表明,9個缺素處理中,除-N和-Ca處理外的其他缺素處理的土沉香幼苗的葉片Fo′值均顯著低于CK處理,其中抑制Fo′值最明顯的是-Fe處理,比CK處理降低了48.3%;其次為-P處理和-K處理,分別比CK處理降低了44.8%和40.0%。各個缺素處理的Fo′值大小順序是-N>-Ca>-B>-Mg>-Mn>
-Zn>-K>-P>-Fe,其中-Fe處理與-N處理的差異性顯著,約占最大值-N處理的1/2。
2.2.6 缺素處理對潛在最大光化學量子產量(Fv/Fm)的影響 如圖6所示,9個缺素處理中,除-Fe和-Zn處理外的其他缺素處理的土沉香幼苗葉片Fv/Fm值均顯著低于CK處理,其中抑制Fv/Fm值最明顯的是-P處理和-Ca處理,值均為0.09,比CK處理降低了60.9%;其次為-N處理,比CK處理降低了52.2%。各個缺素處理的Fv/Fm值大小順序為-Zn>-Fe>-B>-K>-Mn>-Mg>-N>-Ca>-P,其中-Fe和-Zn處理與其他7個處理的差異性顯著,且-Zn處理比-P處理增大了1.11倍。
3 討論與結論
植物生長發育需要各種礦質元素以維持正常的生理活動[12],缺乏不同的礦質元素均會影響植株的根系生長和發育,進而影響葉片的光化學反應。根系生長對礦質元素反應敏感,營養元素的虧豐一定程度上影響根系生物量的積累。本試驗中,9個缺素處理的土沉香根系總生物量都低于全素處理(CK),與King等[13]對火炬松(Pinus taeda Linn.)和北美黃松(Pinus ponderosa)苗木試驗的結論相似。影響土沉香苗木根系生物量生長最顯著的是-K處理,這是由于K是植物體內許多酶的活化劑,對韌皮部傳導,滲透調節等具有重要作用。根系活力是反映植株根系代謝能力強弱的指標之一,其大小影響植株的生長和抗逆性,關系到植株對水分和礦質營養的吸收利用[14]。麥榮章等[15]的研究結果顯示,缺磷、氮和鈣處理的春石斛(Dendrobium spp.)普遍表現出根系活力的降低,試驗處理l個月后缺磷處理最低;2個月后缺氮處理最低,其次為缺鈣處理。本試驗與其研究結果略有差異,9個缺素處理中,對土沉香根系活力影響最顯著的是-K和-Ca處理,可能因為Ca是植物細胞壁胞間層中果膠酸鈣的組成成分,因此,缺鈣時,細胞分裂不能進行或不能完成,而形成多鈣細胞。也有研究報道指出,鈣對于植株細胞壁和原生質膜穩定性具有重要作用[16],因此,-Ca處理土沉香幼苗葉片呈淡綠色,繼而根尖出現壞死現象。同時,K在植物根系的生長發育過程中扮演著重要的角色,推測原因可能是缺K改變了土沉香對K的吸收轉運,引起表皮細胞內K+濃度的變化,進而影響根系活力高低。
多個研究結果表明,礦質元素的缺乏會導致植株葉綠素熒光參數(Fm,Fv,ETR等)值的降低[17-19]。本試驗結果顯示,P、Mg、Ca和Fe是影響土沉香幼苗葉綠素熒光參數的主要元素。P是許多參與光合和呼吸作用的輔酶如NAD+、NADP+等的成分,Mg是葉綠素的組成成分之一,在光合和呼吸過程中,可以活化各種磷酸變位酶和磷酸激酶,Fe也是許多和光合有關的酶的輔基,土沉香幼苗在缺乏這幾種元素的生長環境下,Ft、Fm′、Yield、ETR、Fo′、Fv/Fm值顯著降低,說明缺素已經造成了光抑制,導致其PSII潛在活性中心受到損傷,其反應中心的光化學效率受到明顯影響,光合結構遭到破壞,不利于激發能由捕光色素蛋白復合體(LHC)向PSII進行傳遞。這與李紹長等[20]、楊勇等[21]研究結果一致。
本試驗研究的時間比較長,可能原因是土沉香葉革質,耐貧瘠,對缺素培養的反應不靈敏造成的。而且本試驗整個過程都是在溫室內進行,試驗環境與野外相比存在一定的差異,因此,今后還需要進一步通過其他診斷方法(砂培法等)開展野外試驗,為土沉香的快速營養診斷提供科學參考。
參考文獻
[1] 江蘇新醫學院. 中藥大辭典[M]. 上海: 人民出版社, 1977.
[2] 裘樹平, 劉仲荃. 中國保護植物[M]. 上海: 上海科技教育出版社, 1994.
[3] 李林海, 壽海洋, 馬清溫. 土沉香(瑞香科) 的地理分布研究[J]. 安徽農業科學, 2012, 40(17): 9 254-9 256.
[4] 國家林業部, 國家農業部令. 國家重點保護野生植物名錄(第一批)(第4號)[EB]. http: //www.gov.cn/gongbao/content/2000/content_60072.htm, 1999-09-09.
[5] 王 冉, 何 茜, 丁曉綱, 等. N素指數施肥對沉香苗期光合生理特性的影響[J]. 北京林業大學學報, 2011, 33(6): 58-33.
[6] 楊曉清, 周再知, 梁坤南, 等. 氮素對模擬脅迫下土沉香幼苗抗旱生理的影響[J]. 熱帶作物學報, 2013, 34(6): 1 121-1 127.
[7] 陳 琳. 西南樺苗期營養診斷與氮素施肥[D]. 北京: 中國林業科學研究院, 2010.
[8] 李合生. 植物生理生化實驗原理和技術[M].北京: 高等教育出版社, 2000.
[9] 朱成剛, 李衛紅, 馬曉東, 等. 塔里木河下游干旱脅迫下的胡楊葉綠素熒光特性研究[J].中國沙漠, 2011, 31(4): 917-936.
[10] 李 曉, 馮 偉, 曾曉春. 葉綠素熒光分析技術及應用進展[J]. 西北植物學報, 2006, 26(10): 2 186-2 196.
[11] Oxborought K, Baker N R. Resolving chlorophylla fluorescence images of photosynthetic into photo-chemical and non-photochemical components-calculation of qP and Fv′/Fm′ without measuring Fo′[J]. Photo- synthesis Research, 1997, 54: 135-142.
[12] 潘瑞熾. 植物生理學[M]. 北京: 高等教育出版社, 2003.
[13] King J S, Thomas R B, Strain B R. Morphology and tissue quality of seeding root systems of Pinus teada and Pinus ponderosas affected by varying CO2, temperature and nitrogen[J]. Plant and Soil, 1997, 195: 107-119.
[14] 頓 穎. 柑橘水培體系優化及N、 Fe脅迫下根系形態研究[D]. 武漢: 華中農業大學, 2011.
[15] 麥榮章, 李 麗, 甘林葉. 不同營養液和缺素處理對春石斛幾個生長指標的影響[C]. 中國觀賞園藝研究進展, 2009: 347-354.
[16] Ericsson T. Growth and shoot: root ratio of seedlings in relation to nutrient availability[J]. Plant and Soil, 1995, 168-169: 205-214.
[17] 郭培國, 陳建軍, 鄭燕玲. 氮素形態對烤煙光合特性影響的研究[J]. 植物學通報, 1999, 16(3): 262-267.
[18] 董彩霞, 趙世杰, 田紀春, 等. 不同濃度的硝酸鹽對高蛋白小麥幼苗葉片葉綠素熒參數的影響[J]. 作物學報, 2002, 28(1): 59-64.
[19] 郭延平, 陳屏昭, 張良誠等. 缺磷脅迫加重柑橘葉片光合作用的光抑制及葉黃素循環的作用[J]. 植物營養與肥料學報, 2003, 9(3): 359-363.
[20] 李紹長, 胡昌浩, 龔 江, 等. 低磷脅迫對磷不同利用效率玉米葉綠素熒光參數的影響[J]. 作物學報, 2004, 30(4): 365-370.
[21] 楊 勇, 蔣德安, 孫駿威, 等. 不同供鎂水平對水稻葉片葉綠素熒光特性和能量耗散的影響[J]. 植物營養和肥料學報, 2005, 11(1): 79-86.

