射波刀治療原發性肝癌的臨床研究
彭 巍 馮國生 梁 平 陸合明 盧幻真
(廣西壯族自治區人民醫院臨床腫瘤中心,廣西 南寧 530021)
射波刀治療原發性肝癌的臨床研究
彭 巍 馮國生 梁 平 陸合明 盧幻真
(廣西壯族自治區人民醫院臨床腫瘤中心,廣西 南寧 530021)
目的 通過觀察射波刀(Cyber Knife)治療原發性肝癌的臨床療效及不良反應,探討射波刀在原發性肝癌治療上的臨床應用價值。方法 回顧性分析2008年1月至2011年8月收治的78例未經手術、肝移植等治療的原發性肝癌患者,其中單純射波刀治療38例,射波刀聯合灌注栓塞化療(transcatheter arterial chemoembolization,TACE)40例。觀察患者治療后不良反應、疾病控制率(disease control rate,DCR)、無疾病進展時間(progression free survival,PFS)、患者1年和2年的總生存率(Overall survival,OS)。結果 接受射波刀治療的肝癌患者均顯示出較好耐受性,不良反應率低,多數為1~2級不良反應。78例患者經治療后3例CR,18例PR,47例SD,10例PD,DCR為87.2%,中位PFS 11個月。患者1年和2年OS分別是78.2%和66.9%。在亞組分析中,射波刀聯合TACE治療患者中2例CR,10例PR,24例SD,4例PD,DCR為90.0%,中位PFS 15個月,1年和2年OS分別是82.1%和76.2%。單純射波刀治療患者中1例CR,8例PR,23例SD,6例PD,疾病控制率DCR為84.2%,中位PFS 7個月,1年和2年OS分別是73.3%和53.3%。兩組患者的DCR、中位PFS、1年及2年OS差異無統計學意義(P值分別為0.670、0.105、0.241和0.164)。結論 單純射波刀及射波刀聯合TACE治療原發性肝癌均取得較好的治療效果,不良反應小,提示射波刀在肝癌治療上有重要作用。
射波刀;立體定向放療;TACE;肝癌
原發性肝癌(primary hepatic carcinoma,PHC)是進展快速、對多種治療耐受的癌癥種類之一[1]。其病死率在我國已上升為癌癥病死率的第二位[2]。原發性肝癌確診時多為晚期,失去手術機會,手術切除率不足30%[3],非手術治療方式如肝動脈灌注栓塞化療、射頻消融、經皮無水酒精注射、局部放療等均被廣泛于運用于肝癌患者的治療[4]。肝動脈栓塞化療是不能手術的中晚期肝癌首選治療方法。但是由于肝癌血供的特殊性,栓塞后門脈供血及側支循環形成,單純TACE術難以使腫瘤完全壞死,難以提高遠期生存率。近十余年來,隨著計算機技術及影像學的發展,尤其是三維適形放療及射波刀在臨床上的應用,精確放療在肝癌的綜合治療中起到了一定的作用[5-7]。放療聯合TACE治療原發性肝癌的臨床研究取得了一定療效[8-10]。本研究將進一步探討射波刀治療原發性肝癌的臨床療效、安全性、不良反應。現將2008年1月至2011年8月收治的78例經射波刀或射波刀聯合TACE治療的原發性肝癌患者,報道如下。
1 資料與方法
1.1 研究對象:收集2008年1月至2011年8月在廣西中醫藥大學附屬瑞康醫院收治的78例原發性肝癌患者,所有病例均滿足以下條件:①體力狀態ECOG評分≤2分。②經病理學診斷或臨床診斷證實為原發性肝癌。③因各種原因不能手術切除及肝移植或不愿行手術切除的肝癌患者。④根據Child-Pugh分級標準分為A級或B級。⑤未經過手術切除、肝移植、無水酒精注射等治療,僅經過射波刀治療或TACE聯合射波刀治療的患者。⑥無肝外轉移的患者。⑦無彌漫性肝癌、肝癌伴大量腹腔積液及晚期惡液質患者。
在78例原發性肝癌患者中,男73例,女5例,年齡33~74歲,中位年齡53歲,腫瘤最大徑2.0~18.0cm,合并門脈癌栓16例。行TACE次數1~5次,射波刀治療次數1~2次。78例患者中經單純射波刀治療38例,射波刀聯合TACE治療40例。
1.2 研究方法
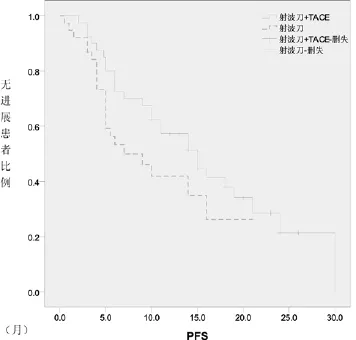
圖1 兩亞組患者PFS的比較
1.2.1 射波刀治療:使用G3型射波刀,TPS 2.0.5版本設計治療計劃,射波刀治療總放療劑量(42.2±7.27)Gy,(4.1±1.91)分割,單次放療劑量為(12.3±5.0)Gy,按照L-Q模式中生物效應劑量(biologically effective dose,BED)計算公式,腫瘤組織(早反應組織)取α/β值為10,總放療劑量相當于常規放療劑量(77.0±16.03)Gy。
1.2.2 肝動脈插管栓塞化療:采用Seldinger技術經皮穿刺股動脈插管至肝動脈,造影確定腫瘤供血動脈,導管超選擇至肝固有動脈、肝右動脈或肝左動脈后行灌注化療和栓塞術。化療藥物:8~9 mg平陽霉素(pingyangmycin,PYM)。栓塞劑為40% 10~30 mL碘化油和明膠海綿顆粒。間隔約1個月行第2次TACE術,多數患者栓塞1~2次。
1.3 觀察指標:治療近遠期療效、治療相關不良反應及其嚴重程度。進行生存率隨訪(6、12、18、24個月)。
1.4 統計學方法:運用SPSS17.0軟件包,1、2年生存率及生存時間計算采用Kaplan-Meier法。P<0.05為差異有統計學意義。
2 結 果
2.1 近期療效:治療后復查CT,78例患者經治療后3例CR,18例PR,47例SD,10例PD,DCR為87.2%。在亞組分析中,射波刀聯合TACE治療患者中2例CR,10例PR,24例SD,4例PD,疾病控制率DCR為90.0%。單純射波刀治療患者中1例CR,8例PR,23例SD,6例PD,DCR為84.2%。兩組患者的DCR差異無統計學意義(P值為0.670)。
2.2 遠期療效:全部患者自治療開始后即開始隨訪,隨訪至2013年2月,隨訪時間最短22個月,最長62個月,中位隨訪期35個月。全體患者中位PFS 11個月,1年和2年OS分別是78.2%和66.9%。亞組分析中,射波刀聯合TACE治療的患者中位PFS 15個月,1年和2年OS分別是82.1%和76.2%。單純射波刀治療的患者中位PFS 7個月,1年和2年OS分別是73.3%和53.3%,聯合治療較單純射波刀治療似乎有更好的生存獲益,但兩組患者PFS、1年和2年總生存率比較P值分別為0.105、0.241和0.164,差異無統計學意義。兩組的PFS及生存曲線見圖1、2。
2.3 不良反應
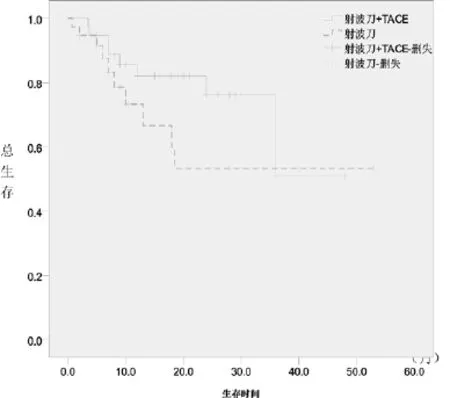
圖2 兩亞組患者生存曲線的比較
2.3.1 急性不良反應(治療后1個月內發生):不良反應均為1~2級,出現肝功能損害加重10例(12.8%),腹瀉腹脹10例(12.8%),腹痛10例(12.8%),納差8例(10.2%),乏力6例(7.8%),胃部不適4例(5.1%),低熱4例(5.1%),骨髓抑制2例(2.6%)。對癥治療后好轉,均未影響后續治療。
2.3.2 亞急性不良反應(治療后1個月至3個月發生):放射性胃炎及放射性腸炎多在射波刀治療完成后約1個月后出現。出現放射性胃炎6例(7.8%),出現放射性腸炎2例(2.6%)。亞急性不良反應發生率較低,且大部分患者對治療的不良反應均耐受均良好。
3 討 論
肝癌的放療經歷了局部放療、全肝放療和全肝移動照射等階段,由于正常肝組織放療耐受性差,易導致放射性肝損害,肝臟的全肝放射耐受量僅為25~40 Gy,而肝癌常規放療根治劑量需要60 Gy,全肝放療很難給予肝癌根治劑量,僅能起到抑制腫瘤作用,因此療效不明顯。但隨著影像技術的發展,放療的精確度不斷提升,肝癌靶區劑量得以提高,周邊正常肝組織受照劑量銳減,確保了肝癌放療的治療效果并且降低了放療相關不良反應的發生率。放療在肝癌中的地位有了新的提升[11-12]。
Price[13]進行了單純立體定向放療治療肝癌的臨床研究,2005年~2008年入組26例患者,中位放療總劑量42 Gy,3~5次分割。CR+PR率達73%,1年及2年生存率分別為77%和60%。Andolino[14]為評價立體定向放療在原發性肝癌治療中的有效性及安全性,從2005年~2009年入組了60例患者,其中Child-Pugh評級A級36例,中位放療劑量44Gy,3次分割;評級B級24例,中位放療劑量40 Gy,5次分割。2年的PFS及OS分別為48%和67%,中位疾病進展時間(Time to disease progression,TTP)47.8個月。未見3級以上非血液學毒性。13%患者大于1級血液學毒性或肝功能損害。23例患者接受了肝移植。研究表明立體定向放療在原發性肝癌治療中安全有效,并可作為等待肝移植前的治療方式之一。Huang[15]2012年報道了射波刀治療36例不能手術的肝癌患者,中位總劑量37 Gy(25~48 Gy),4~5次分割。2年的生存率達72.6%,與對照組(未接受射波刀治療)的42.1%相比有統計學意義。射波刀治療的不良反應輕微,患者多可耐受。
本研究中接受射波刀治療的患者不良反應發生率較低,未出現放療后嚴重急性肝臟反應,患者均耐受良好。可能的原因有以下幾點:①射波刀放療定位精準,減少了對肝臟正常組織的照射。②放療多為大分割,照射次數少,患者易接受。③治療過程中兩組均運用了祖國醫學中藥對不良反應進行對癥處理,使得大部分不良反應得到減輕[16]。
本研究入組的多為巨塊型肝癌患者,診斷時多數已失去手術切除機會。完成射波刀治療后觀察近期療效,顯示了較好的疾病控制率。國內外相關研究中亦看到較高的疾病控制率,如Goyal[6]的研究中單純射波刀治療局部控制率為82%。與國內外研究結果對比,本研究疾病控制率略高。本研究中患者1年和2年生存率分別是78.2%和66.9%。在Louis[5]研究中射波刀治療肝癌1年及2年生存率分別為79%和52%,Dewas[17]研究中射波刀治療肝臟腫瘤患者1年及2年生存率分別為80.4%和72.5%。本研究療效結果與國外研究結果相近。本研究對療效結果進行亞組分析,顯示接受單純射波刀治療與射波刀聯合TACE治療的患者在近遠期療效上無明顯差異,故射波刀聯合何種治療方式能提高療效有待進一步探討。
Yoon[18]報道三維適形放療聯合TACE治療肝癌門靜脈侵犯的患者412例,中位生存期10.6個月,1年、2年生存率分別為42.5%和22.8%。10%患者出現3-4度放射性肝損害,3.6%患者出現2-3度放射性胃腸道反應。何漢平[19]進行了三維適形放療聯合TACE治療對比單純TACE治療中晚期肝癌的臨床研究,單純介入組30例,聯合治療組27例。放療為1次/天,2~2.5 Gy/次,5次/周,放療總劑量為52~62 Gy。介入組與聯合組1,2年生存率分別為53.3%,43.3%及70.7%,55.5%(P=0.023)。三維適形放療聯合TACE治療肝癌有一定療效,但與射波刀治療肝癌研究中報道的生存率相比較低。不良反應發生率及嚴重程度較射波刀治療高,可能有以下幾個方面原因:①射波刀總治療時間明顯縮短,減少了治療期間腫瘤細胞再增值對療效的影響。根據時間-劑量因子學說,即相同的照射劑量,因照射次數和時間不同其療效也不同。為提高放療效果,提倡在不引起正常組織急性放療反應的前提下,盡量縮短治療總時間。射波刀治療周期短,一般治療不超過5次,多能在1周內完成治療。②增加分次劑量會加重晚反應組織的損傷,以往均將腫瘤組織作為早反應組織看待,由于腫瘤組織的不均質性,腫瘤組織中完全可能存在類似晚反應組織的部分,所以增加分次劑量同樣會增加對這部分腫瘤組織的殺傷。③國內外多項研究證實原發性肝癌放射治療劑量是影響肝癌患者預后的重要因素。肝癌細胞的放療常規根治劑量需要60Gy/30次,6周左右,按照L-Q模式中生物效應劑量計算公式,取α/β值為10,射波刀治療總照射劑量一般為38~45 Gy,約相當于常規放療劑量71~94 Gy,均達到或超過根治劑量。④靶體積的確定:放療的有效率在一定程度上取決于對腫瘤體積的準確判斷,為了準確確定放射靶區,有必要采用多種影像診斷技術,如CT、MRI和PET技術的融合。射波刀采用了CT與MRI影像融合技術確定靶區,可大大提高了靶區定位的正確性。
本研究中死亡病例數未達到一半,目前無法統計出中位生存期,需要繼續進行隨訪觀察。單純射波刀或射波刀聯合TACT治療原發性肝癌能取得較好的治療效果,不良反應小,提示射波刀在肝癌治療上有重要作用。
[1] Okuda K.Hepatocellular carcinoma[J].J Hepatol,2000,32(1 Suppl): 225-237.
[2] 王建華.肝癌綜合介入治療的現狀[J].中華肝臟病雜志,2005,13(10):721-723.
[3] 常旭,陳積圣,區莊嘉,等.原發性肝癌的治療[M].鄭州:河南醫科大學出版社,1999:5-6.
[4] Cheng JW,Lv Y.New progress of non-surgical treatments for hepatocellular carcinoma[J].Med Oncol,2013,30(1):381.
[5] Louis C,Dewas S,Mirabel X,et al.Stereotactic radiotherapy of hepatocellular carcinoma: preliminary results[J].Technol Cancer Res Treat,2010,9(5):479-487.
[6] Goyal K,Einstein D,Yao M,et al.Cyberknife stereotactic body radiation therapy for nonresectable tumors of the liver:preliminary results[J].HPB Surgery,2010.pii: 309780.
[7] Zhao JD,Xu ZY,Zhu J,et a1.Application of active breathing control in 3-dimensional conformal radiation therapy for hepatocelular carcinoma:the feasibility and benefit[J].Radiother Oncol,2008,87(3):439.
[8] Cupino AC,Hair CD,Angle JF,et al.Does external beam radiation therapy improve survival following transarterial chemoembolization for unresectable hepatocellular carcinoma? [J].Gastrointest Cancer Res,2012,5(1):13-17.
[9] Xu LT,Zhou ZH,Lin JH,et al.Clinical study of transarterial chemoembolization combined with 3-dimensional conformal radiotherapy for hepatocellular carcinoma[J].Eur J Surg Oncol,2011,37(3):245-251.
[10] Ren ZG,Zhao JD,Gu K,et al.Three-dimensional conformal radiation therapy and intensity-modulated radiation therapy combined with transcatheter arterial chemoembolization for locally advanced hepatocellular carcinoma: an irradiation dose escalation study[J].Int J Radiat Oncol Biol Phys,2011,79(2):496-502.
[11] 黎功.肝癌放療研究進展[J].腫瘤學雜志,2010,16(7):516-519.
[12] Ursino S,Greco C,Cartei F,et al.Radiotherapy and hepatocellular carcinoma: update and review of the literature[J].Eur Rev Med Pharmacol Sci,2012,16(11):1599-1604.
[13] Price TR,Perkins SM,Sandrasegaran K,et al.Evaluation of response after stereotactic body radiotherapy for hepatocellular carcinoma[J]. Cancer,2012,118(12):3191-3198.
[14] Andolino DL,Johnson CS,Maluccio M,et al.Stereotactic body radiotherapy for primary hepatocellular carcinoma[J].Int J Radiat Oncol Biol Phys,2011,81(4):e447-453.
[15] Huang WY,Jen YM,Lee MS,et al.Stereotactic body radiation therapy in recurrent hepatocellular carcinoma[J].Int J Radiat Oncol Biol Phys,2012,84(2):355-361.
[16] 白廣德,吳潔.中藥聯合射波刀治療原發性肝癌25例臨床研究[J].江蘇中醫藥,2012,44(5):20-22.
[17] Dewas S,Bibault JE,Mirabel X,et al.Prognostic factors affecting local control of hepatic tumors treated by stereotactic body radiation therapy[J].Radiat Oncol,2012,7(1):1-9.
[18] Yoon SM,Lim YS,Won HJ,et al.Radiotherapy plus transarterial chemoembolization for hepatocellular carcinoma invading the portal vein: long-term patient outcomes[J].Int J Radiat Oncol Biol Phys,2012,82(5):2004-2011.
[19] 何漢平,黃志勇,郭友全,等.介入聯合三維適形放療治療中晚期肝癌的臨床研究[J].現代腫瘤醫學,2011,19(4):724-726.
Clinical Study of CyberKnife T reatment for Patients with Primary Hepatic Carcinoma
PENG Wei, FENG Guo-sheng, LIANG Ping, LU He-ming, LU Huan-zhen
(Clinical Cancer Center, the People’s Hospital of Guangxi Zhuang Autonomous Region, Nanning 530021, China)
Objective By observing the clinical efficacy and adverse reactions of CyberKnife treatment for patients with inoperable primary hepatic carcinoma(PHC), this study was to explore the clinical value of CyberKnife for PHC. Methods This retrospective analysis enrolled 78 cases of primary liver cancer patients treated without surgery or liver transplantation from January 2008 to August 2011. 38 patients were treated with CyberKnife, 40 patients were treated with CyberKnife combined with TACE. We observed the toxicity, disease control rate (DCR), progression free survival (PFS), 1 year and 2 years overall survival (OS) after the treatment of CybeKnife. Results After the treatment of CyberKnife, patients showed well tolerability. Adverse reaction rate was low. Most adverse reactions were I-II degree. All patients: 3 CR,18 PR,47 SD,10 PD,DCR 87.2%, median PFS was 11 months, 1 year and 2 years OS were 78.2% and 66.9%. In the subgroup analysis: The combined therapy: 2 cases CR, 10 cases PR, 24 cases SD, 4 cases PD, DCR 90.0%,median PFS was 15 months, 1 year and 2 years OS were 82.1% and 76.2%. The simple CyberKnife therapy: 1 case CR, 8 cases PR, 23 cases SD, 6 cases PD, DCR 84.2%,median PFS was 7 months, 1 year and 2 years OS were 73.3% and 53.3%. Between two subgroups, DCR, PFS, 1-year and 2-year OS were no significant difference (P=0.670,0.105,0.241,0.164). Conclusion CyberKnife treatment for PHC can achieve good therapeutic effect and low toxicity, showed that CyberKnife played an important role in the treatment of PHC.
CyberKnife; Stereotactic radiotherapy; TACE; Liver cancer
R735.7
B
1671-8194(2015)14-0001-03
E-mail:fengguosheng88988@163.com

