豬用疫苗中牛病毒性腹瀉病毒污染的檢測與分析
張 志,張美晶,董雅琴,王 佳,吳發興,劉 爽,邵衛星,李曉成,王樹雙
(中國動物衛生與流行病學中心,山東青島 266032)
豬用疫苗中牛病毒性腹瀉病毒污染的檢測與分析
張志,張美晶,董雅琴,王佳,吳發興,劉爽,邵衛星,李曉成,王樹雙
(中國動物衛生與流行病學中心,山東青島266032)
為調查我國豬用疫苗中牛病毒性腹瀉病毒(BVDV)的污染情況,本文用巢式RT-PCR方法檢測了部分藍耳病弱毒疫苗和豬瘟細胞苗中的牛病毒性腹瀉病毒,并分析其核酸序列的遺傳特性,結果共檢測出9份BVDV陽性樣品,分子遺傳分析表明污染的牛病毒性腹瀉病毒分別屬于BVDV的1a型和1b型。
牛病毒性腹瀉病毒;PCR;豬瘟;豬藍耳病;疫苗
我國的生豬產量占世界總產量的50%以上,但同時我國養豬場的豬病也極為復雜,豬瘟、豬藍耳病、豬偽狂犬病、豬流行性腹瀉等疫病廣為流行。目前我國豬群重大疫病的防控主要依賴疫苗免疫,因此疫苗的質量高低就直接關系到我國生豬產業的發展。豬用商品化疫苗以弱毒疫苗為主。弱毒疫苗具有可誘導體液和細胞雙重免疫、只接種一次即可起到良好的預防效果、持續時間長、不需佐劑等優點。但是,弱毒疫苗的使用可能導致如下問題:易受外源病毒污染、發生交叉感染、有毒力殘留等。疫苗一旦被污染以后,不僅疫苗使用效價降低,起不到預防和控制傳染病的功效,甚至還會造成疾病的傳播。
我國豬用弱毒疫苗中,屢有外源病原污染情況,常見污染源為支原體和牛病毒性腹瀉病毒(bovine viral diarrhea virus,BVDV)[1]。牛病毒性腹瀉病毒自首次被報道以來,在全世界很多畜牧業發達國家中流行[2],如:澳大利亞、德國等國家豬群中BVDV抗體陽性率達3%~40%,荷蘭達15%~20%。各種年齡的牛都可感染牛病毒性腹瀉,以幼齡牛易感性最高,在垂直傳播后,會產生病毒血癥[3]。以含BVDV的血清作為原料時,就會污染制備的生物制品,如豬瘟細胞苗生產過程中會使用到牛睪丸細胞以及牛血清;藍耳病疫苗(尤其是弱毒疫苗)生產工藝中在傳代細胞培養中會使用到牛血清,如果血清材料含有BVDV病原或抗體,會使豬瘟細胞苗和藍耳病疫苗污染[3-4]。豬瘟活疫苗BVDV污染在我國早已有報道[5],但近年來,我國豬瘟細胞苗和豬藍耳病弱毒疫苗生產廠家都有數十家之多,若不能及時監測出疫苗中BVDV污染情況,會造成重大經濟損失甚至會導致傳染病的流行。因此,對豬瘟和藍耳病疫苗受BVDV污染情況的監測與分析十分有必要。本文擬采用套式RT-PCR方法對CSF和PRRS弱毒疫苗污染BVDV情況進行檢測與分析,這對指導畜牧業生產中科學使用疫苗有重要的意義。
1 材料與方法
1.1疫苗
豬瘟細胞苗和豬藍耳病弱毒疫苗為14個省份送來的招標疫苗。這些疫苗每只用5 mL 0.01M的滅菌PBS溶解后,備用。
1.2試驗試劑
RNA提取試劑Trizol,購自?nvitrogen公司;RT-PCR Kit,購自大連寶生物公司。
1.3RNA提取
取稀釋的疫苗250 μL加入750 μL Trizol,振蕩混勻后,室溫放置5 min,加入氯仿250 μL,劇烈振蕩后,室溫放置10 min,4℃ 12 000 r/min離心15 min,取500 μL上清,加入等量異丙醇,混勻,-80℃沉淀30 min后4℃ 12 000 r/min離心10 min,去上清,沉淀用1 mL 75%的乙醇洗滌,4℃ 12 000 r/min離心5 min棄上清,室溫干燥RNA沉淀20 min,加入30 μL DEPC水,充分溶解后-80℃凍存備用。
1.4巢式RT-PCR擴增
[6]建立的巢氏PCR方法,設計合成了2對引物,用于巢式RT-PCR擴增,引物序列位于BVDV的NS5B基因,詳見表1。
第一次擴增的反應體系為:Enzyme Mix 1 μL,2×1 Step Buffer 12.5 μL,P1(20 μM)0.5 μL,P2(20 μM)0.5 μL,RNA 3 μL,DEPC水7.5 μL,反應總體積為25 μL。反應條件為:50℃反轉錄30 min;94℃預變性5 min;94℃變性30s,55℃退火45 s,72℃延伸2 min,35個循環;最后72℃延伸10 min。第二次擴增時取第一次PCR產物作為模板,反應體系為:Ex-Taq 0.5 μL,2×1 Step Buffer 12.5 μL,P3(20 μM)0.5 μL,P4(20 μM)0.5 μL,一擴PCR產物2 μL,DEPC水9 μL,反應總體積為25 μL。反應程序為:94℃預變性3min;94 ℃變性30 s,55℃退火30 s,72℃延伸30 s,33個循環;最后72 ℃延伸7 min。PCR產物于1%瓊脂糖凝膠電泳觀察,選擇出現特異性條帶的樣品送至上海生工公司進行測序。
1.5序列分析
從GenBank上下載BVDV相關的參考毒株,共20株(表2),分別來自日本、美國、加拿大、中國等的不同的基因型,序列分析采用DNAStar、CLUSTAL1.83和MEGA6.06軟件,分析疫苗中污染的BVDV毒株的核苷酸同源性,并繪制了NS5B基因序列的系統進化樹。
2 結果
2.1巢式PCR擴增結果
以疫苗提取的RNA為模板,采用P1、P2引物進行RT-PCR的產物再以P3、P引物巢式PCR擴增后,進行瓊脂糖凝膠電泳,發現豬藍耳病弱毒疫苗中有6個樣品為陽性(樣品編號為BVDV16,BVDV17,BVDV18,BVDV19,BVDV20和BVDV21),豬瘟細胞苗有3份為陽性(編號為BVDV26,BVDV27和BVDV30),詳見圖1和圖2。
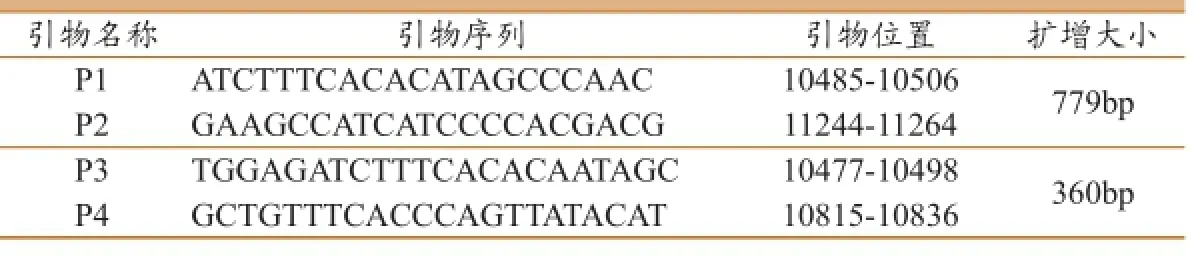
表1 BVDV擴增的引物

表2 BVDV參考序列
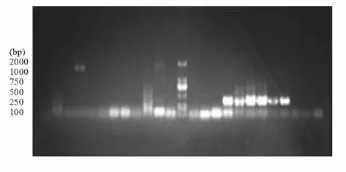
圖1 豬藍耳病疫苗BVDV 巢式擴增結果

圖2 豬瘟細胞苗BVDV 巢式擴增結果
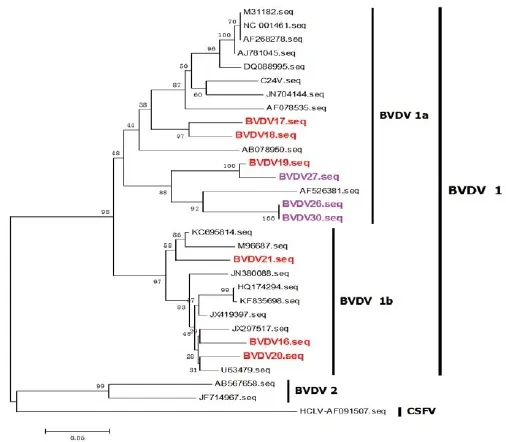
圖3 BVDV不同毒株的進化樹分析
2.2進化樹分析
將這9份陽性樣品測序后進行BLAST分析發現,這9份樣品全部為BVDV毒株,進一步與BVDV參考毒株進行進化樹分析發現,這些BVDV可以分為BVDV 1型和2型兩個進化分支,其中BVDV 1型為優勢分支,它又可以分為1a和1b兩個亞型,1a為參考毒株或經典毒株的進化分支。本文檢測的9株BVDV中,來自豬瘟疫苗的3個毒株BVDV-26、27、30和來自豬藍耳病疫苗的BVDV-17、18、19均屬于1a分支,而另外3個來自豬藍耳病疫苗的BVDV16、20、21屬于1b分支(圖3),并且來自豬瘟疫苗的BVDV19和來自豬藍耳病疫苗的BVDV27位于同一個更小的進化分支內,這提示二者可能有共同的來源。
2.3同源性比較
本文從疫苗中所測的9株BVDV污染毒株之間的同源性為80.7%~99.4%,其中,BVDV-26和BVDV-30毒株之間的同源性最高,為99.4%,BVDV-20和BVDV-30毒株之間的同源性最低,僅為80.7%。9株BVDV與參考株NC_001461的同源性為82.8%-86.8%,與其他BVDV 1型毒株的同 源 性 為78.8%~96.0%,與BVDV 2型毒株的同源性為69.6%~76.8%,與外類群HCLV-AF091507的同源性為68.9%~73.0%(圖4)。
3 討論
BVDV是疫苗中常見的一種污染源,由于BVDV毒株在細胞上難以產生明顯的細胞病變,因此PCR方法就成為最常用的BVDV檢測方法[1]。考慮到BVDV與CSFV和BDV均屬于黃病毒屬,三者在基因組上的同源性較高,常規的PCR擴增容易因交叉反應而產生假陽性結果,為保證檢測結果的準確性和特異性,本文在試驗前首先對國內外PCR檢測方法進行了篩選比較,最后確定采用NS5B區的一段保守序列進行擴增的套式引物,該引物可以有效區分BVDV和CSFV,同時具有較高的靈敏度[6]。本文的檢測結果也充分表明了該檢測方法的可行性和有效性。

圖4 BVDV各毒株的同源性比較結果
近年來,一些學者對疫苗中的外源病原污染進行了研究,2008年,范學政等[5]報道豬瘟疫苗中BVDV的感染率為21.74%;2011年,葉兆美等[7]對四川市售的豬藍耳病疫苗和豬瘟疫苗進行了檢測,結果10份豬瘟疫苗和9份豬藍耳病疫苗中BVDV的污染率為10.53%;2011年,范仲鑫等[8]對湖南省內的48個批次的豬瘟疫苗進行了BVDV檢測,陽性率為18.75%。這些檢測結果提示我國豬用疫苗中BVDV的污染較為嚴重。
從本次豬藍耳病疫苗和豬瘟疫苗中檢測BVDV的基因型來看,6株為1a型,3株為1b型,這一結果與牛群中BVDV的血清型分布類似[2,9],提示這些疫苗中的BVDV污染很可能來自牛血清中的BVDV持續性感染所致。因此,要進一步加強血清的檢測和監管,避免帶毒血清流入市場。
參考文獻:
[1]毛曉娜,繆芬芳,季偉.牛病毒性腹瀉病毒在豬瘟疫苗中的污染情況及檢測方法的研究進展[J].中國畜牧獸醫,2013,40(2):175-179.
[2]鄧宇.我國部分地區豬源牛病毒性腹瀉病毒研究[D].雅安:四川農業大學,2012.
[3]朱禮倩,周艷君,于海,等. 牛病毒性腹瀉在中國的流行現狀分析[J]. 中國動物傳染病學報,2011,19(5): 83-86.
[4]宋永峰,張志,張燕霞,等. 豬源牛病毒性腹瀉病毒的流行初探[J]. 中國動物檢疫,2008,25(7):25-27.
[5]范學政,寧宜寶,王琴,等.用RT-PCR方法檢測檢測豬瘟細胞苗中污染牛病毒性腹瀉病毒[J].中國獸醫雜志,2010,46(1):8-10.
[6]朱紫祥,顧立偉,張志,等.豬源牛病毒性腹瀉病毒PCR檢測方法的建立及NS5b區基因序列分析[C]//中國畜牧協會.《2010中國豬業進展》論文集. 北京:中國畜牧協會,2010.
[7]葉兆美.豬瘟和藍耳疫苗中BVDV和PCV污染情況調查[J].四川畜牧獸醫,2012,39(3):31-33.
[8]范仲鑫,張朝陽,劉道新,等.豬瘟細胞苗污染牛病毒性腹瀉病毒情況調查[J].畜牧與獸醫,2011,43(7):84-85.
[9]王建領,付彤,劉杰,等. 牛病毒性腹瀉分子及血清流行病學研究進展[J]. 河南農業科學,2012,41(3):7-11.
(責任編輯:胡藕祥)
Detection and Analysis of Bovine Viral Diarrhea Virus Contamination in Classical Swine Fever and Porcine Reproductive and Respiratory Syndrome Vaccines
Zhang Zhi,Zhang Meijing,Dong Yaqin,Wang Jia,Wu Faxing,Liu Shuang,Shao Weixing,Li Xiaocheng,Wang Shushuang
( China Animal Health and Epidemiology Center,Qingdao,Shandong 266032)
To investigate BVDV contamination in classical swine fever (CSF) and porcine reproductive and respiratory syndrome (PRRS) vaccines,vaccine samples were collected and detected by nest RT-PCR for BVDV,resulting in 9 positive BVDV-contaminated vaccine samples. The contaminating BVDVs were identified as BVDV type 1a and 1b.
bovine viral diarrhea virus;PCR;classical swine fever;porcine reproductive and respiratory syndrome;vaccine
S859.79+7
A
1005-944X(2015)11-0076-04
科技基礎性工作專項(2012FY111000);青島市民生計劃項目(13-1-3-91-nsh)
李曉成

