AXL調控的MIRNA表達在NSCLC吉非替尼獲得性耐藥中的意義*
曹新廣,呂慧芳,陳貝貝,常吉梅,唐 菲,朱彩華,樊鑫鑫,秦建軍,陳小兵#
1)鄭州大學附屬腫瘤醫院普外科;河南省腫瘤醫院普外科 鄭州450008 2)新鄉醫學院第三附屬醫院 新鄉453003
與化療相比,表皮生長因子受體(epidermal growth factor receptor,EGFR)酪氨酸激酶抑制劑(tyrosine kinase inhibitor,TKI)如吉非替尼對EGFR突變型晚期非小細胞肺癌(non-small cell lung cancer,NSCLC)的臨床療效顯著[1],但大多數患者最終會出現耐藥。Axl(Anexelekto)為受體酪氨酸激酶亞家族成員之一,與生長停滯特異性基因6(growth arrest specific protein 6,Gas6)結合可激活其酪氨酸激酶活性,激活下游信號轉導途徑,參與細胞黏附、增殖、凋亡等過程[2]。Axl 基因異常表達在多種腫瘤發生、發展過程中發揮重要作用。最新研究[3]結果顯示,Axl 參與調控NSCLC 吉非替尼獲得性耐藥,但機制仍不清楚。
miRNA 是一類長18~25 nt 的非編碼單鏈RNA,通過與靶mRNA 的3’-UTR 端結合,抑制靶mRNA 翻譯或促進其降解[4-5]。NSCLC 細胞內miRNA 表達失調與TKI 耐藥和腫瘤形成關系密切[6-7]。該研究通過比較EGFR 突變型NSCLC 細胞株HCC827 及其吉非替尼耐藥株HCC827-Gef 中Axl mRNA 和蛋白的表達,探討Axl 與HCC827 細胞吉非替尼耐藥的關系,再利用微陣列分析鑒定表達失調的一系列miRNA,采用實時熒光定量PCR(qRTPCR)檢測Axl 沉默對HCC827-Gef 細胞相關miRNA表達的影響;同時作者還對不同Axl mRNA 表達水平的NSCLC 患者相關miRNA 表達及生存狀況進行比較;探討Axl 對miRNA 的表達調控在NSCLC 吉非替尼獲得性耐藥中的意義。
1 材料與方法
1.1 主要試劑 RPMI 1640 培養液、Trizol、NCodeTMVILOTMmiRNA cDNA 合成試劑盒和EXPRESS SYBRRGreenERTMmiRNA qRT-PCR 試劑盒購于美國Invitrogen 公司,新生胎牛血清購自Gibco 公司,吉非替尼購自Astra Zeneca 公司,GAPDH 及Axl 單抗購自Santa Cruz 公司,GeneChipRHuman Gene 2.0 ST Array 及GeneChip WT Terminal Labeling 試劑盒購自Affymetrix 公司,mirVanaTMRNA Isolation 試劑盒及WT Expression 試劑盒購自Ambion 公司。
1.2 NSCLC 細胞及新鮮組織來源
1.2.1 細胞來源 細胞EGFR 突變型NSCLC 細胞株HCC827 購自ATCC,用含體積分數10%胎牛血清、100 U/mL 青霉素、鏈霉素的RPMI 1640 培養液培養。參照文獻[8]構建對吉非替尼耐藥的細胞HCC827-Gef。用Superfect 脂質體轉染法將靶向Axl的endogenous siRNA(esiAxl)、空質粒轉染HCC827-Gef 細胞,得HCC827-Gef-esiAxl 和HCC827-Gef-空質粒細胞。
1.2.2 組織來源 收集2009年10月至2010年10月在鄭州大學附屬腫瘤醫院行肺葉切除術的肺癌患者的新鮮肺癌組織40例,置于液氮保存。患者中男22例,女18例;≤55歲15例,>55歲25例;腺癌18例,鱗癌22例;Ⅰ、Ⅱ期16例,Ⅲ、Ⅳ期24例;吸煙32例。該研究獲得鄭州大學附屬腫瘤醫院倫理審查委員會批準。隨訪60個月,以復發轉移或死亡為終點事件。
1.3 微陣列分析 轉染48 h 后,收集HCC827-Gef-空質粒和HCC827-Gef-esiAxl 細胞,采用mirVanaTMRNA Isolation 試劑盒離子交換柱吸附法抽提總RNA(嚴格按照說明書操作),應用GeneChipRHuman Gene 2.0ST Array,參照Affymetrix 基因芯片操作指南進行芯片雜交,檢測對象包括廣泛的編碼和長鏈非編碼RNA 轉錄組,聯合應用GeneChip WT Terminal Labeling 試劑盒和WT Expression 試劑盒分析雜交結果中的有義鏈,陣列隨后被染色和掃描,應用Partek Genomics Suite Software 分析數據,找出差異表達miRNA。共篩選出20個差異表達miRNA,其中miR-374a、miR-548b 敏感度最高。
1.4 NSCLC 細胞及新鮮組織中Axl mRNA 和miR-374a、miR-548b 的檢測 收集待檢細胞,應用qRT-PCR 法測定Axl mRNA 和miR-374a、miR-548b的表達。以HPRT1 為內參測定Axl mRNA,以U6 snRNA 作為內參測定相關miRNA。具體步驟及定量方法詳見試劑盒說明書。引物參見表1。同法檢測40例NSCLC 患者樣本中Axl mRNA、miR-374a、miR-548b 的表達情況。
1.5 NSCLC 細胞中Axl 蛋白的Western blot 法檢測 收集HCC827、HCC827-Gef 細胞,提取總蛋白,通過聚丙烯酸胺凝膠電泳分離蛋白,轉移至PVDF膜上,蛋白封閉液37℃封閉1 h,PBST 洗滌,一抗(Axl 按1∶5 000 稀釋)4℃振蕩孵育過夜,TBST 洗滌3次,加二抗孵育1 h,TBST 洗滌3次,每次5 min。ECL 法室溫顯影,記錄結果。以目的蛋白條帶與內參條帶的比值表示目的蛋白的表達水平。
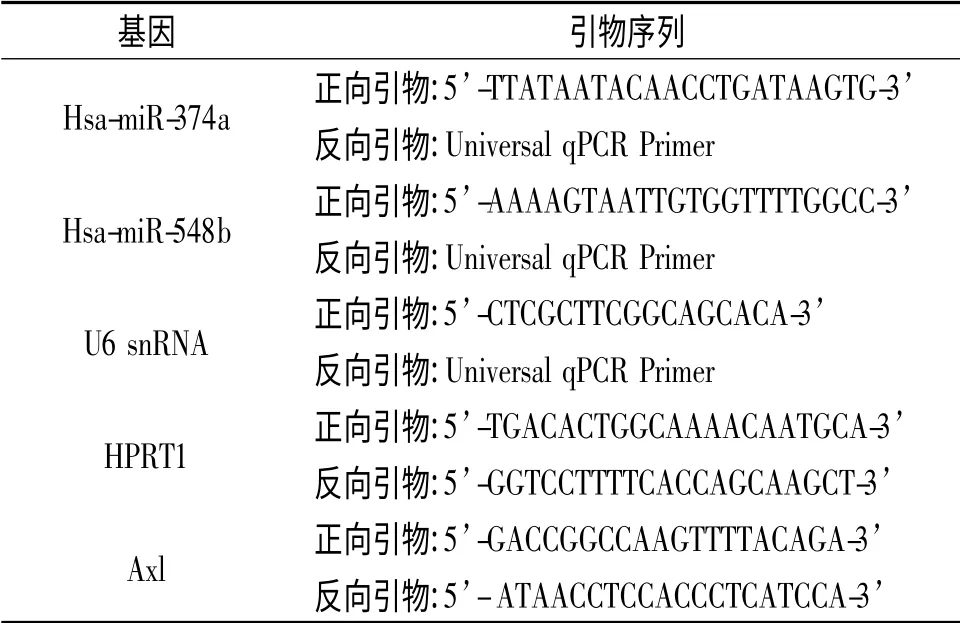
表1 qRT-PCR 引物
1.6 統計學處理 應用SPSS 13.0 進行數據分析。兩組間Axl mRNA 和miR-374a、miR-548b 表達的比較用兩獨立樣本t 檢驗;采用Kaplan-Meier 法繪制生存曲線并進行Log rank 檢驗;檢驗水準α=0.05。
2 結果
2.1 HCC827 和HCC827-Gef 細胞中Axl mRNA及蛋白表達的比較 HCC827-Gef 細胞中Axl mRNA及蛋白的表達均明顯高于HCC827 細胞,見表2。
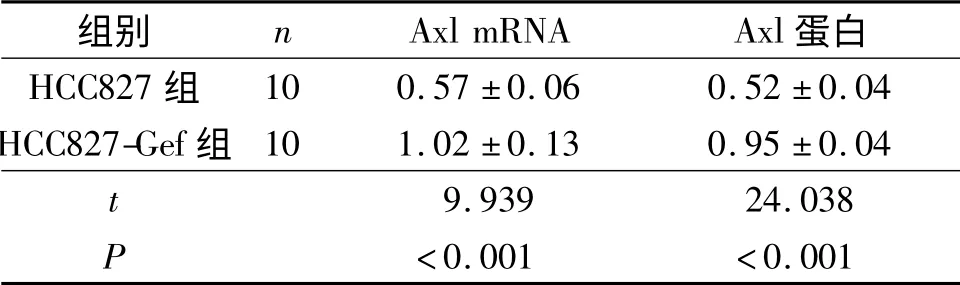
表2 HCC827 和HCC827-Gef 細胞中Axl mRNA 及蛋白的表達
2.2 HCC827-Gef-空質粒和HCC827-Gef-esiAxl細胞中Axl mRNA 和miR-374a、miR-548b 表達的比較 見表3。結果顯示,與HCC827-Gef-空質粒細胞比較,HCC827-Gef-esiAxl 細胞中Axl mRNA、miR-374a 表達顯著下降,miR-548b 表達則上調。
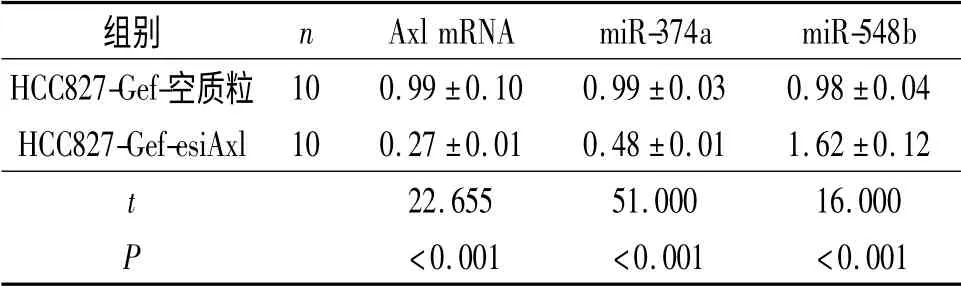
表3 細胞中與Axl 通路相關的miR-374a、miR-548b 的表達
2.3 NSCLC 患者Axl mRNA、miR-374a、miR-548b 表達的分析 以腫瘤組織中AXL/HPRT1 比值1 為臨界值,將NSCLC 患者分為Axl mRNA 高表達(20例)和低表達(20例)組。比較2組肺組織中miR-374a、miR-548b 的表達(表4),結果顯示,Axl mRNA 高表達組miR-374a 表達高于Axl mRNA 低表達組,而miR-548b 的表達則低于Axl mRNA 低表達組。兩組患者的生存曲線差異有統計學意義(圖1),Axl 低表達組患者的無病生存期延長更長(χ2=6.550,P=0.011)。
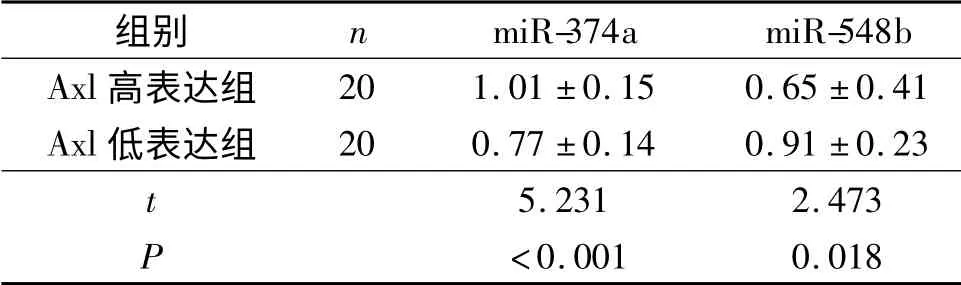
表4 Axl mRNA 高表達和低表達組NSCLC 患者腫瘤組織中miR-374a、miR-548b 表達的比較
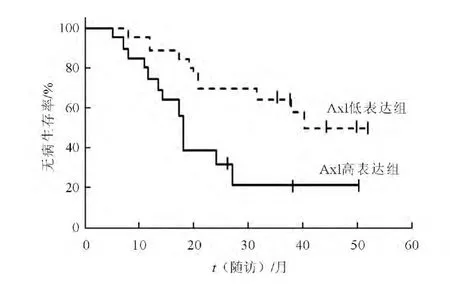
圖1 Axl mRNA 高表達和低表達組的生存曲線
3 討論
EGFR-TKI 靶向藥物如吉非替尼的發現,使EGFR 突變的NSCLC 患者生活質量明顯改善,生存時間更長,但大多數患者會出現耐藥,目前耐藥問題仍然NSCLC 治療中的一個主要的難題[9],而Axl 在EGFR-TKI 獲得性耐藥中作用已成為目前研究的焦點。如抗腫瘤藥物NPS-1034 通過激活Met 或Axl或ROS1 的重組,使對EGFR-TKI 敏感的NSCLC 患者出現獲得性耐藥[10]。一項研究[3]表明,EGFR 突變的肺癌細胞中Axl 表達升高,下調Axl 表達可延緩EGFR-TKI 獲得性耐藥的發生。此次實驗中,作者觀察到,耐吉非替尼肺癌細胞株HCC827-Gef 中Axl mRNA 和蛋白表達表達均高于不耐藥的HCC827 細胞,提示Axl 可能參與了HCC827 細胞的吉非替尼耐藥過程。
一個miRNA 可靶向上百個mRNA,調控一系列生物功能如細胞增殖、轉化和凋亡,在臨床診斷和預后判斷中扮演重要角色[11]。該研究闡述了對EGFR-TKI 耐藥的NSCLC 細胞中Axl 介導的miRNA 表達的變化,結果顯示,HCC827-Gef-esiAXL 細胞Axl基因沉默后,miR-374a 表達顯著下降,miR-548b 表達則上調。在對NSCLC 患者的分析結果顯示,Axl mRNA 高表達組miR-374a 表達高于Axl mRNA 低表達組,而miR-548b 的表達則低于Axl mRNA 低表達組;并且Axl mRNA 高表達組患者的無病生存期較Axl 低表達組明顯縮短。無病生存期縮短提示NSCLC 患者更容易對吉非替尼耐藥,并容易出現復發和轉移,與肺癌患者預后密切相關。
由此可見,Axl 及其調控的miR-374a 和miR-548b 在NSCLC EGFR-TKI 獲得性耐藥機制中發揮關鍵作用,它們可作為預后因子來判斷NSCLC 患者預后或成為潛在的治療靶點。
[1]Mok TS,Wu YL,Thongprasert S,et al.Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J].N Engl J Med,2009,361(10):947
[2]O'Bryan JP,Frye RA,Cogswell PC,et al.axl,a transforming gene isolated from primary human myeloid leukemia cells,encodes a novel receptor tyrosine kinase[J].Mol Cell Biol,1991,11(10):5016
[3]Zhang Z,Lee JC,Lin L,et al.Activation of the AXL kinase causes resistance to EGFR-targeted therapy in lung cancer[J].Nat Genet,2012,44(8):852
[4]Chen L,Jin H.MicroRNAs as novel biomarkers in the diagnosis of non-small cell lung cancer:a meta-analysis based on 20 studies[J].Tumour Biol,2014,35(9):9119
[5]Vannini I,Fanini F,Fabbri M.MicroRNAs as lung cancer biomarkers and key players in lung carcinogenesis[J].Clin Biochem,2013,46(10/11):918
[6]Wu X,Piper-Hunter MG,Crawford M,et al.MicroRNAs inthe pathogenesis of lung cancer[J].J Thorac Oncol,2009,4(8):1028
[7]Engelman JA,Zejnullahu K,Mitsudomi T,et al.MET amplification leads to gefitinib resistance in lung cancer by activating ERBB3 signaling [J].Science,2007,316(5827):1039
[8]Wang YS,Wang YH,Xia HP,et al.MicroRNA-214 regulates the acquired resistance to gefitinib via the PTEN/AKT pathway in EGFR-mutant cell lines[J].Asian Pac J Cancer Prev,2012,13(1):255
[9]Sequist LV,Waltman BA,Dias-Santagata D,et al.Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors[J].Sci Transl Med,2011,3(75):75
[10]Rho JK,Choi YJ,Kim SY,et al.MET and AXL inhibitor NPS-1034 exerts efficacy against lung cancer cells resistant to EGFR kinase inhibitors because of MET or AXL activation[J].Cancer Res,2014,74(1):253
[11]Jansson MD,Lund AH.MicroRNA and cancer[J].Mol Oncol,2012,6(6):590

